Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO
Related links
-
 Similars in
SciELO
Similars in
SciELO
Share
Revista del Nacional (Itauguá)
Print version ISSN 2072-8174
Rev. Nac. (Itauguá) vol.7 no.1 Itauguá June 2015
https://doi.org/10.18004/rdn2015.0007.01.017-023
ARTÍCULO ORIGINAL
Mortalidad en pacientes con dengue en la epidemia 2012-2013
Mortality during an outbreak of dengue 2012 - 2013
Arnaldo Fabián Aldama Negrete1, Dora Montiel-Jarolín2, Raúl Real2
RESUMEN
Introducción: el dengue presenta diversas formas clínicas, desde asintomáticas hasta fatales. Existen diversos factores de riesgo asociados a la mortalidad por dengue. Objetivo: determinar los factores de riesgo asociados a la mortalidad por dengue. Metodología: estudio de casos (adultos fallecidos por dengue) y controles (adultos sobrevivientes al dengue), durante la epidemia verano 2012-2013 en Paraguay. Resultados: los factores de riesgo asociados significativamente a la mortalidad por dengue fueron: presencia de comorbilidades, hemorragias, hepatitis, hipoproteinemia e hipoalbuminemia. El choque por dengue fue la causa de óbito más frecuente (49%). Conclusiones: los factores asociados a la mortalidad por dengue son inherentes al paciente (comorbilidades) y a la gravedad de la infección, resultante de las manifestaciones hemorrágicas, afectación sistémica y fuga capilar.
Palabras claves: dengue, mortalidad, factor de riesgo, fuga capilar
ABSTRACT
Introduction: Dengue has several clinical forms, from asymptomatic to fatal. There are several risk factors associated with mortality from dengue. Objective: To determine the risk factors associated with mortality from dengue. Methodology: case studies (death of dengue adults) and controls (survivors dengue adults) during summer 2012-2013 epidemic in Paraguay. Results: Risk factors significantly associated with mortality from dengue were: presence of comorbidities, hemorrhage, hepatitis, hypoproteinemia and hypoalbuminemia. Dengue shock syndrome was the most common cause of death (49%). Conclusions: The mortality associated with dengue factors are inherent to the patient (comorbidities) and the severity of infection, resulting in hemorrhagic manifestations, systemic involvement and capillary leak.
Keywords: dengue, mortality, risk factor, capillary leak
INTRODUCCION
El dengue es una enfermedad infecciosa aguda, producida por un virus, de carácter endémico - epidémico. Constituye la arbovirosis más importante a nivel mundial, en términos de morbilidad, mortalidad y afectación económica. Trasmitida principalmente por el mosquito Aedes aegypti, propio de áreas tropicales y subtropicales de todos los continentes, la incidencia es máxima tras la estación de las lluvias1.
Tiene diversas formas de expresión clínica, pero la mayoría se manifiesta en forma subclínica o asintomática (53% - 87%). En los sujetos sintomáticos, el cuadro puede variar entre una fiebre leve hasta formas graves de shock y hemorragias mortales. Su evolución es impredecible, siendo más grave en sujetos con comorbilidades1. Las llamadas formas "atípicas" resultan de la afectación particularmente intensa de un órgano o sistema causando encefalopatía, miocardiopatía, hepatopatía, afectación pulmonar, renal entre otras1,2.
El virus del dengue es un flavivirus. Se compone de cuatro serotipos estrechamente relacionados, pero antigénicamente distintos: DENV 1, DENV 2, DENV 3 y DENV 4. Todos estos serotipos del virus del dengue se pueden distinguir, tanto por métodos serológicos y moleculares2. Los 4 serotipos son capaces de producir formas graves, potencialmente fatales de la enfermedad y complicaciones sistémicas no específicas3,4.
Entre las proteínas no estructurales que constituyen el virus se encuentra la proteína NS1 de 50 kda (353 o 354 aminoácidos), una de las glicoproteínas que tiene una alta homología de aminoácidos y de nucleótidos entre los flavivirus. NS1 no forma parte del virión, pero se libera de las células infectadas por virus del dengue. Estudios preliminares han demostrado que esta glicoproteína no estructural está implicada en la replicación del ARN viral y se ha encontrado en muestras de sangre de fase aguda de pacientes con infecciones por el virus del dengue, primario o secundario. Esto ha sugerido una posible implicancia en la patogénesis de la enfermedad y su uso como un marcador diagnóstico adecuado para la infección por el virus del dengue2.
Se ha demostrado que las inmunoglobulinas contra la proteína NS1 pueden estimular la lisis mediada por el complemento y dependiente de anticuerpos, tanto en células infectadas como no infectadas. Este último fenómeno podría explicar, por lo menos en parte, los daños funcionales del endotelio que conducen al sangrado y a la extravasación plasmática, como se ha demostrado en los pacientes con diagnóstico de dengue grave5,6.
Desde hace más de 200 años se han venido notificando casos de dengue en las Américas. En la década de 1980 la magnitud del problema aumentó considerablemente por la marcada propagación geográfica de la enfermedad. En el año 1982 ocurre la primera epidemia en el Brasil y en 1988 la primera en el Paraguay3 con circulación del serotipo DENV 1, registrándose un total de 41.990 casos confirmados todo el territorio, siendo principalmente el área de ocurrencia la zona metropolitana de Asunción. La estimación de Organización Panamericana de la Salud/Organización Mundial de la Salud en aquella epidemia fue de 440.000 casos, incluyendo loas asintomáticos3. Sucesivos brotes ocurrieron en los años posteriores. Así, en el año 2001 se registraron 38 casos que se concentraron en Asunción. Por primera vez se detectó la circulación de DENV 2 durante este brote3.
La circulación viral registrada en 2012 corresponde al serotipo DENV 2 y DENV 43.
Desde el 30 de diciembre 2012 al 27 de julio de 2013 se ha notificado al sistema de vigilancia del Ministerio de Salud 149.983 casos febriles, de los cuales se confirmaron por laboratorio y nexo epidemiológico 129.479 casos (86,4%). El mayor número de notificaciones se registró en el Departamento Central con 101.887 pacientes febriles (68,3%) del total notificado en el país, seguido de Asunción con 23.075 (15,3%) y el Departamento de Alto Paraná con 5.630 notificaciones (3,7%). Los serotipos aislados fueron: DENV 1, DENV 2 y DENV 4. Persistía el DENV 2 como serotipo circulante predominante3.
Las primeras muertes por dengue en el Paraguay se registraron en la epidemia 2006-2007 con un total de 30 fallecidos. A partir de ese año, esta frecuencia aumentó con cada epidemia, siendo la epidemia 2012 - 2013 donde se registró el mayor número de fallecidos, situación que podría explicarse por el aumento del número de pacientes con infección secundaria y por la circulación del serotipo DENV 2 como predominante3.
Factores de gravedad
La fiebre hemorrágica por dengue (FHD) y el síndrome de shock por dengue (SCD) son las manifestaciones severas y/o fatales del dengue. Las epidemias de FHD/SCD ocurren sobre todo en países del sudeste asiático, donde afectan principalmente a los niños y se asocian con altas tasas de letalidad7-13.
La mortalidad en dengue también puede ser debido a la presencia de comorbilidades adquiridas tales como la obesidad, alcoholismo, tabaquismo, edad extrema de la vida y la presencia de otras enfermedades crónicas como la diabetes mellitus (DM), el asma, la hipertensión arterial (HTA), la enfermedad pulmonar obstructiva crónica, insuficiencia renal crónica, infección por HIV, tratamiento quimioterápico. Muchas veces la razón del óbito no es directamente la infección por dengue sino el empeoramiento de la comorbilidad14-18.
A nivel molecular las variantes genéticas del complejo de histocompatibilidad mayor de clase-secuencia B y fosfolipasa C épsilon relacionados con genes humanos, son factores de riesgo para desarrollar dengue grave19,20.
La variación en la mortalidad del dengue se relaciona con el tiempo de endemicidad. Un estudio realizado en el continente americano indica que las tasas de mortalidad se triplican cada 10 años de endemicidad13. Esta asociación puede explicarse por varios mecanismos. Uno de ellos es el hecho de que la propagación de la enfermedad se ve facilitada por que han sido han desactivadas las medidas preventivas o éstas han sido pobres o insuficientes, dando lugar a una mayor incidencia y consecuentemente un mayor número de muertes relacionadas con el dengue13,21,22. Además, un aumento en el tiempo de endemicidad empeora la probabilidad de que los individuos expuestos a una primera infección desarrollen una infección secundaria con otro serotipo, siendo este último el principal factor de riesgo reconocido para las formas graves de la enfermedad13,24-29.
Por otra parte, fenómenos como las interacciones virus-vector-huésped podrían conducir a cambios en la inmunidad de la población y en la selección de genotipos virales de mayor transmisibilidad y virulencia. En vista de estos hechos el tiempo de endemicidad fue el principal predictor de muerte por dengue en los brotes en las Américas entre 1995-200913.
El principal órgano blanco del dengue es el endotelio vascular y los elementos formes de la sangre como linfocitos, monocitos, macrófagos, mastocitos y células dendríticas18,23. El aumento de la permeabilidad vascular sin daño morfológico del endotelio capilar es la característica cardinal de la Fiebre Hemorrágica por Dengue y el Síndrome de Shock por Dengue. Sólo cambios inespecíficos leves se han detectado en los estudios histopatológicos de la microvasculatura. Los estudios sugieren que la interrupción transitoria de la función de la capa endotelial funcionaría como un tamiz molecular, restringiendo selectivamente moléculas dentro de plasma de acuerdo a su tamaño, carga y forma17,30-38.
La hipoalbuminemia y proteinuria se observan también durante la infección del dengue. Se pierden proteínas como la albúmina, ésto genera un cambio pequeño pero crucial en la filtración del glucocalix, el propio virus y la proteína NS1 del dengue se adhieren al heparán sulfato, un elemento estructural clave de la glucocalix. Un aumento en la excreción urinaria de heparán sulfato se ha detectado en niños con severa infección1,15,39-41.
Otros mecanismos del daño celular al endotelio se relacionan a los inmunocomplejos que pueden activar a las células endoteliales induciendo a la apoptosis. Pero lo más llamativo es la gran liberación de anticuerpos y citoquinas cuando ocurre una segunda infección, generando lo que se conoce como tsunami de citoquinas15,14,19,23.
Por otro lado es bien sabido que pueden generarse fenómenos autoinmunes por interacción con otros virus como HIV, hepatitis C, citomegalovirus, virus de herpes simple, virus Epstein Baar15.
La fuga vascular inicial es focal y se produce predominantemente en el espacio pleural y peritoneal. La explicación que prevalece para el SSD es que las respuestas inmunes a la infección por dengue producen una tormenta de citoquinas que conduce al compromiso transitorio generalizado de la función de la barrera endotelial y por consiguiente fuga capilar. Muchas citoquinas proinflamatorias como el factor de necrosis tumoral-a y los factores antigénicos como por ejemplo el factor de crecimiento endotelial vascular, puede disminuir la función de barrera endotelial y por lo tanto aumentar la permeabilidad vascular. Los niveles circulantes de muchos mediadores de permeabilidad vascular se incrementan en pacientes con FHD/SSD y puede ser producido por las células infectadas. Sin embargo, la mayoría de los pacientes infectados por dengue no muestran el desarrollo de un síndrome de fuga vascular17,19,42,43.
Varias proteínas y vías de señalización están implicadas en el mantenimiento de la función de barrera endotelial y uno de ellos implica la actividad de CD73 cuya función es reforzar las uniones adherentes y aumentar la función de barrera endotelial20.
Se demostró que la infección por el DENV 2 induce la producción de interferón de tipo I y regula la expresión de CD73, que sería también responsable de la lenta recuperación de la función de barrera endotelial20.
Una segunda infección DENV heteróloga sigue siendo el factor de riesgo relativo más significativo para el desarrollo de FHD/SSD. Los factores del huésped que promueven la producción de citoquinas proinflamatorias por la respuesta inmune adaptativa a la reacción, también favorecería el desarrollo de dengue hemorrágico20.
Durante el dengue la respuesta inmunitaria puede resolver la infección, sin causar grandes traumatismos en el individuo o por el contrario puede llevar al organismo a un aparente caos, donde la constante estimulación conlleva a la activación celular, el aumento de la expresión de mediadores y de receptores, que inducen en algunos casos daños tisulares irreversibles, lo que aumenta la gravedad de la enfermedad5,21.
Además el aumento de casos de dengue con manifestaciones atípicas, como miocarditis, encefalitis, hepatitis o insuficiencia renal, sugiere cambios en el perfil de la enfermedad que podrían deberse a cambios del tropismo del virus21. La infección por un serotipo produce inmunidad para toda la vida contra la reinfección del mimo serotipo, pero solo protección temporal que va de semana a meses contra los otros serotipos21. Los anticuerpos dirigidos contra el antígeno NS1, también presentan reactividad cruzada con las plaquetas, que lleva a la inflamación y destrucción de las mismas19.
Las formas graves de dengue se definen por uno o más de los siguientes criterios:
1. Shock por extravasación del plasma, acumulación de líquido con dificultad respiratoria, o ambas11.
2. Sangrado profuso que sea considerado clínicamente importante o afectación grave de órganos11.
Por lo general, cuando disminuye la fiebre, si se incrementa la permeabilidad vascular y la hipovolemia empeora, puede producirse choque por dengue. Esto ocurre con mayor frecuencia al cuarto o quinto día (rango de tres a siete días) de la enfermedad y casi siempre es precedido por los signos de alarma11. Durante la etapa inicial del choque, el mecanismo de compensación que mantiene normal la presión arterial sistólica también produce taquicardia y vasoconstricción periférica con reducción de la perfusión cutánea, lo que da lugar a extremidades frías y retraso del tiempo de llenado capilar11.
Los pacientes en estado de choque por dengue a menudo permanecen conscientes y lúcidos. Si se mantiene la hipovolemia, la presión sistólica desciende y la presión diastólica se mantiene, lo que resulta en disminución de la presión del pulso y de la presión arterial media11. En estadios más avanzados, ambas descienden hasta desaparecer de modo abrupto11.
El choque y la hipoxia prolongada pueden conducir a insuficiencia orgánica múltiple y a un curso clínico muy difícil11. Se considera que un paciente está en choque si la presión del pulso (es decir, la diferencia entre las presiones sistólica y diastólica) es de 20 mm Hg o menor, o si hay signos de mala perfusión capilar (extremidades frías, llenado capilar lento o pulso rápido y débil) en niños y en adultos33. Se debe tener en cuenta que en los adultos la presión de pulso de 20 mm Hg o menor puede indicar un choque más grave33. La hipotensión suele asociarse con choque prolongado, que a menudo se complica por sangrado profuso. Es importante el seguimiento de la presión arterial media para determinar la hipotensión. Una presión arterial media por debajo de 70 mm Hg se considera hipotensión11.
Las hemorragias graves son de causalidad múltiple: factores vasculares, desequilibrio entre coagulación y fibrinólisis, trombocitopenia, entre otros11. En el dengue grave puede haber alteraciones de la coagulación, pero éstas no suelen ser suficientes para causar hemorragias graves11. Cuando se produce un sangrado mayor, casi siempre se asocia a un choque profundo, en combinación con hipoxia y acidosis, que pueden conducir a falla orgánica múltiple y coagulopatía de consumo11. Puede ocurrir hemorragia masiva sin choque prolongado y ese sangrado masivo puede ser criterio de dengue grave. Ese tipo de hemorragia se presenta también cuando se administra ácido acetilsalicílico, antiinflamatorios no esteroideos o corticosteroides11.
Puede presentarse insuficiencia hepática aguda, encefalopatía, miocardiopatía o encefalitis, incluso en ausencia de extravasación grave del plasma o shock. Este compromiso serio de órganos es por sí solo criterio de dengue grave. La manifestación clínica es semejante a la de la afectación de estos órganos cuando se produce por otras causas33.
OBJETIVOS
Determinar los factores de riesgo asociados a la mortalidad en pacientes con dengue internados en el Hospital Nacional de Itauguá en la epidemia dengue 2012 - 2013.
Hallar la prevalencia de pacientes fallecidos con dengue internados en el período de noviembre de 2012 a octubre del 2013, en el Hospital Nacional de Itauguá.
Establecer las alteraciones clínicas, laboratoriales y ecográficas que se asociaron a la mortalidad por dengue.
MATERIALES Y MÉTODOS
Diseño metodológico: casos y controles.
Población de estudio: Casos: varones y mujeres, mayores de edad, fallecidos por dengue en el Hospital Nacional de Itauguá durante el período de noviembre de 2012 a octubre del 2013. Controles: varones y mujeres, mayores de edad, afectados por dengue en el Hospital Nacional de Itauguá y dados de alta vivos, durante el período de noviembre de 2012 a octubre del 2013.
Criterios de inclusión: Dengue con signos de alarma, confirmado por antígeno NS1y/o IgM positivo en periodo crítico o post febril, internados o que fallecieron durante su estancia en salas de Urgencias, Reanimación, Terapia Intensiva, Clínica Médica y Ginecología del Hospital Nacional de Itauguá.
Criterios de exclusión: Pacientes con cuadro febril sin confirmación laboratorial.
Variables: Variable dependiente: estado al alta: vivo, óbito
Variables independientes: días de internación, comorbilidades, hallazgos ecográficos (ascitis, hepatomegalia, edema vesicular), hemoglobina, hematocrito, plaquetas, hepatograma, albuminemia, proteinemia, tiempo de protrombina, presencia de sangrado.
Otras variables: sexo, edad, procedencia, causas de óbito
Reclutamiento: Los sujetos fueron identificados a través del Servicio de Bioestadística del Hospital Nacional. Los datos fueron extraídos de los expedientes clínicos por el autor.
Gestión de datos: Las variables fueron registradas en planilla electrónica y sometidas a análisis bivariado con el programa estadístico Epi Info 7©. Para las variables cuantitativas se utilizó la prueba ANOVA o Kruskal Wallis. Para las variables nominales se utilizó la prueba Chi2.
Hipótesis: Se consideró a la presencia de comorbilidades el principal factor de riesgo de óbito.
H0: no existe diferencia estadísticamente significativa en la proporción de comorbilidades entre casos y controles.
Ha1: la proporción de comorbilidades es estadísticamente mayor en los casos.
Ha2: la proporción de comorbilidades es estadísticamente mayor en los controles.
Cálculo de tamaño de muestra: Se utilizó el programa estadístico Epi Info 7©. Se consideró a la presencia de comorbilidades el principal factor de riesgo de óbito. Para un error alfa 5%, error beta 20%, proporción de comorbilidades=40% en controles y 80% en los casos, el tamaño mínimo calculado fue 28 casos y 28 controles.
Asuntos éticos: Se mantuvo total discreción y anonimato respecto a la identidad de los participantes de la investigación. Se respetaron los principios de la Bioética.
RESULTADOS
En este estudio se incluyeron 258 pacientes, de los cuales 61 eran casos (fallecidos por dengue) y 197 eran controles (sobrevivieron a la enfermedad). La edad media fue 51±17 años en los casos y 43 ± 18 años en los controles (p 0,05 prueba ANOVA).
La mayoría de los pacientes procedía de Itauguá (21%), Capiatá (15%), Itá (10%), J.A. Saldívar (10%) y otras ciudades circunvecinas.
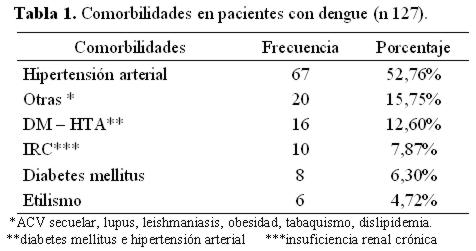
Las comorbilidades se detectaron en 127 sujetos, siendo la más frecuente la hipertensión arterial (HTA) en 52,7% (tabla 1).
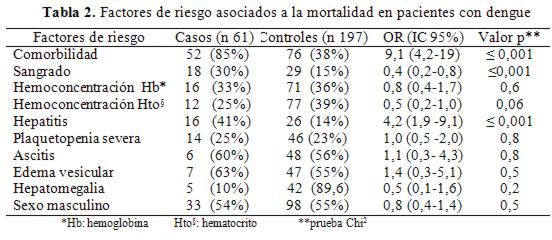
Entre los factores de riesgo asociados significativamente a la mortalidad resaltan la presencia de comorbilidades, el sangrado y la hepatitis (tabla 2).
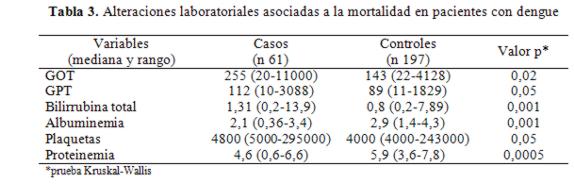
Otras variables laboratoriales asociadas significativamente a la mortalidad fueron el tiempo de protrombina bajo, la hipoalbuminemia y la hiperbilirrubinemia (tabla 3).
La media ± DE del tiempo de protrombina en los casos fue 55%±24 vs 88%±23 en los controles (p 0,0005 prueba ANOVA). Los días de internación fueron mayores en los controles: 5,1±3 días vs 2,9 ±4 días (p 0,002 prueba ANOVA). El tiempo de la enfermedad (desde que inicia los síntomas de la enfermedad hasta que acude a consultar) fue 6,4±3,8 días (rango 2-22 días) en ambas muestras.
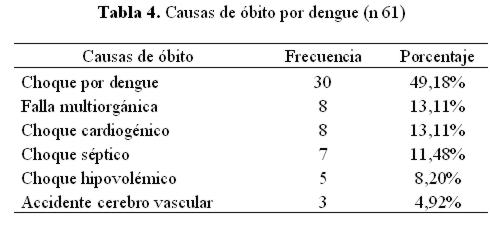
La principal causa de óbito fue el choque por dengue (tabla 4).
DISCUSIÓN
Los pacientes con las formas severas de FHD/SSD presentan riesgo elevado de mortalidad debido al choque refractario y a la falla multiorgánica. El reconocimiento precoz de los signos de alarma, además de la instauración rápida y apropiada del tratamiento, son de vital importancia para disminuir las tasas de morbimortalidad de las formas severas del dengue43.
Durante los últimos 5 años, en Paraguay ha habido un aumento constante en el número de hospitalizaciones, gravedad de la enfermedad y muertes por dengue. Estos resultados pueden explicarse por un cambio en el patrón de enfermedad que se caracteriza por hiperendemicidad, la circulación simultánea de varios serotipos del virus del dengue (DENV 1, DENV 2, DENV 3 y DENV 4) y la falta de conciencia de la población en cuanto a medidas de prevención o de formación del profesional de salud en el reconocimiento oportuno de las formas graves3,37.
Es importante que cuanto antes se identifique un factor de riesgo de muerte, mayor es la posibilidad de introducir intervenciones terapéuticas adecuadas para evitar la misma, lo que impone la necesidad de conocerlos44,45.
Los pacientes con infecciones secundarias por el virus del dengue tienen un mayor riesgo de desarrollar FHD/SSD44,45,47. Una limitante en nuestro estudio fue que no se consignaba en la mayoría de las historias clínicas acerca de que si era la primera o segunda infección. Para próximos estudios sería importante precisar dicha posibilidad, pues la literatura cita que las infecciones secundarias desencadenan casos fatales44.
La virulencia del virus es otro factor de riesgo46. El serotipo DENV 2 se asoció con cuadros fatales y es considerado un genotipo muy virulento44. En esta epidemia el predominante fue el DENV 2 cocirculando con el DENV 4, coincidiendo con la gravedad, incluyendo casos fatales3.
En el mundo hay aproximadamente de 50 a 100 millones de casos de fiebre tipo dengue, 500.000 casos desarrollaran formas graves de la enfermedad (FHD/SSD) y ocurren aproximadamente 24.000 muertes en el mundo con una tasa de mortalidad promedio de 5%47. La OMS menciona que sería lo ideal tener una tasa de mortalidad = 1% si aplicamos el protocolo de manejo correcto45. En nuestro estudio se observó una tasa de letalidad de 3,6%, similar a lo registrado en Colombia con una tasa de letalidad 4,28%. En otras regiones de las Américas fue 1,5%45, hecho que nos obliga a investigar las causas de mayor mortalidad y encontrar los factores de riesgo asociados a la misma, que podrían disminuir la tasa de letalidad del dengue en nuestro país3.
La principal causa de óbito en nuestro estudio fue el choque por dengue (49%), coincidiendo con la literatura que cita que el SSD puede acercarse al 47%, le sigue la falla multiorgánica y el choque cardiogénico por miocarditis e infarto agudo de miocardio, ambas con 13%. Le siguen en cuarto lugar el choque séptico por infecciones luego de haber superado la etapa aguda del dengue, sobre todo en pacientes que ingresaron a terapia intensiva donde la infección más frecuente fue la neumonía asociada al ventilador, en quinto lugar el choque hipovolémico (8%) como consecuencia de las hemorragias masivas siendo la más frecuente la hemorragia digestiva. La literatura cita que la mortalidad por hemorragia en la FHD se sitúa entre 1 % al 26%47. En Malasia se reporta que en niños con infecciones graves de dengue, existió asociación significativa entre la hemorragia grave y muerte (p 0,001)24,46.
En cuanto a la edad, nuestros casos eran de mayor edad en relación a los controles pero no fue estadísticamente significativo. Esto se relaciona a que los adultos mayores presentan más comorbilidades y por tanto más riesgo de complicaciones48.
Entre los casos predominó el sexo masculino. Esto podría ser por el hecho de que en general en nuestro país los hombres buscan los servicios de salud con menos frecuencia y tardíamente, y de esta manera se retrasa la oportunidad para el diagnóstico y tratamiento adecuado de dengue. En un estudio realizado en Brasil se encontró también que la mortalidad predominaba en los hombres y destaca no sólo una explicación biológica, sino también factores de riesgo conductuales coincidiendo con nuestras hipótesis44,45,48.
La mayoría de los fallecidos procedían del Departamento Central por ser el departamento con mayor número de personas expuestas al virus en ésta y anteriores epidemias, recordando que la infección secundaria es un factor de mayor gravedad. Otro motivo podría ser por los hábitos urbanos del vector37.
Las comorbilidades estuvieron fuertemente asociadas con la muerte en nuestro estudio, entre las que predominaban la hipertensión arterial, diabetes mellitus tipo 2 y la insuficiencia renal crónica. Las comorbilidades son citadas en la literatura como factor de mal pronóstico y estos pacientes tienen más riesgo de morir en relación a los que no la presentan3,48.
Los pacientes desnutridos están relativamente protegidos según varios estudios, probablemente debido a que tienen un sistema inmunitario poco reactivo. No obstante, sería interesante tener en cuenta el estado nutricional para ser investigado en estudios futuros44,47.
La hemoconcentración significativa (=20%) de hemoglobina y hematocrito que nos indica fuga capilar estuvo presente en los casos y controles, pero esta relación no fue significativa. Un estudio realizado en Brasil refiere que la fuga capilar tampoco fue un factor importante de riesgo de muerte, porque todos los controles (pacientes que sobrevivieron a la enfermedad) también tuvieron dengue grave con choque45.
También se encontró en nuestra investigación que la hepatitis estuvo significativamente asociada con la muerte, lo mismo que datos laboratoriales como el tiempo de protrombina bajo, la hipoalbuminemia y la hiperbilirrubinemia. Reportes anteriores en nuestro medio confirman la elevada frecuencia de manifestaciones sistémicas del dengue afectando múltiples órganos, aunque muchas veces pasan desapercibidos37.
La plaquetopenia no se asoció significativamente a la mortalidad, coincidiendo con la literatura que menciona que el grado de trombocitopenia no predice clínicamente sangrado significativo, por lo que las plaquetas no deben administrarse en caso de plaquetopenia severa, a no ser que el paciente presente sangrado11,47. Afortunadamente, la plaquetopenia es transitoria y facilita esta conducta expectante.
La estancia hospitalaria fue más corta en los casos que en los controles, lo que se debe a la mala condición clínica de los casos al ingreso, con el rápido desenlace fatal, coincidiendo con la literatura47.
Otro factor que pudo haber contribuido al mal pronóstico de los casos pudo haber sido que los equipos de salud no estaban preparados para brindar atención de emergencia a los pacientes con dengue grave, muchos no tenían acceso a terapia intensiva y llegaban al hospital con la enfermedad avanzada49. Esta hipótesis requiere otra investigación. Debido a que las unidades de cuidados intensivos son a menudo limitadas en entornos de escasos recursos, cualquier información que pueda ayudar a distinguir los pacientes con dengue grave con un mayor riesgo de progresar a la muerte puede ser crucial.
CONCLUSIONES
Los pacientes eran de ciudades circunvecinas al Hospital Nacional. La muerte por dengue predominó en varones y en los adultos mayores.
El factor de riesgo más fuertemente asociado a la mortalidad fue la presencia de comorbilidades entre las que predominó la hipertensión arterial, diabetes mellitus tipo 2 y la insuficiencia renal crónica.
Todos los pacientes presentaron signos clínicos de alarma. Las alteraciones laboratoriales que se asociaron significativamente a la mortalidad fueron el aumento de enzimas hepáticas, la hipoalbuminemia, la hipoproteinemia y la disminución del tiempo de protrombina.
La causa predominante de óbito fue el choque por dengue debido a la fuga capilar que éste desencadena y la mayoría de los pacientes fallecidos ya llegaban al Hospital en este estado.
La tasa de letalidad del dengue en este estudio fue de 3,6%.
REFERENCIAS
1. Simmons CP, Farrar JJ, Nguyen van VC, Wills B. Dengue. N Engl J Med. 2012 Apr 12;366(15):1423-32. [ Links ]
2. Wang SM, Sekaran SD. Evaluation of a commercial SD dengue virus NS1 antigen capture enzyme-linked immunosorbent assay kit for early diagnosis of dengue virus infection. J Clin Microbiol. 2010 Aug;48(8):2793-7. [ Links ]
3. Montiel D, Aldama F. Causas de óbito en pacientes con dengue internados en el Hospital Nacional. Epidemia 2013. Revista de Salud Pública del Paraguay. 2014 Sep ;4(1):35-43. Disponible en: http://www.ins.gov.py/revistas/index.php/rspp/article/view/298. (2014 12 5) [ Links ]
4. Vázquez C, Villalba S, Gamarra L. Características virológicas y serológicas de pacientes con dengue grave y fallecidos por dengue durante la epidemia del año 2011 en Paraguay. Rev Inst Med Trop. 2012;7(1):8-18. Disponible en: http://www.imt.edu.py/admin/uploads/Documento/v7n1a3.pdf (2014-12-5) [ Links ]
5. Velandia M, Castellanos J. Virus del dengue: estructura y ciclo viral. Infect. 2011; 15(1):33-43. Disponible en: http://www.scielo.org.co/pdf/inf/v15n1/v15n1a06.pdf (2014 12 5) [ Links ]
6. Tapia R, Betancourt M. Dengue: an escalating public health problem in Latin America. Paediatr Int Child Health. 2012 May;32 Suppl 1:14-7. [ Links ]
7. Lopes TF, Holcman MM, Barbosa GL, Domingos M de F, Barreiros RMOV. Laboratory evaluation of the development of Aedes Aegypti in two seasons: influence of different places and different densities. Rev Inst Med Trop Sao Paulo. 2014;56(5):369-74. Disponible en: http://www.scielo.br/pdf/rimtsp/v56n5/0036-4665-rimtsp-56-05-369.pdf (2015 2 9) [ Links ]
8. Arbo A. Dengue en Paraguay. Rev Inst Med Trop. 2008;3(2):6-7. [ Links ]
9. Arbo A, Lovera D. Dengue, gravedad y serotipos. Rev Inst Med Trop. 2012;7(1):4-5. [ Links ]
10. Araya S, Avalos C, Duarte M, Sanabria G, Apodaca S, Lovera D, et al. Comportamiento clínico del dengue en niños en los últimos años en Paraguay. Rev. Med. Trop. 2010;5(1):14-19. Disponible en: http://scielo.iics.una.py/pdf/imt/v5n1/v5n1a03.pdf (2013 12 7) [ Links ]
11. Paraguay. Ministerio de Salud Pública y Bienestar Social. Dirección de Vigilancia de la Salud. Dengue: guía de manejo clínico. 2012. Asunción: El Ministerio, 2012. P. 1-47 [ Links ]
12. Rivera AH, Rodríguez AP. Actualización en aspectos epidemiológicos y clínicos del dengue. Rev Cub Salud Pública. 2010 Mar;36(1):149-64. Disponible en: http://www.scielosp.org/pdf/rcsp/v36n1/spu15110.pdf (2013 12 7) [ Links ]
13. Díaz-Quijano FA, Waldman EA. Factors associated with dengue mortality in latin america and the caribbean, 1995-2009: An Ecological Study. Am J Trop Med Hyg. 2012 Feb;86(2):328-34. [ Links ]
14. Oliveira EC, Pontes ER, Cunha RV, Fróes IB, Nascimento Dd. Alteraciones hematológicas en pacientes con dengue. Rev Soc Bras Med Trop. 2009;42:682-85. [ Links ]
15. Basu A, Chaturvedi UC. Vascular endothelium: the battlefield of dengue viruses. FEMS Immunol Med Microbiol. 2008 Aug;53(3):287-99. [ Links ]
16. Burke DS, Nisalak A, Johnson DE, Scott RM. A prospective study of dengue infections in Bangkok. Am J Trop Med Hyg. 1988 Jan;38(1):172-80. [ Links ]
17. Halstead SB. Pathogenesis of dengue: challenges to molecular biology. Science. 1988 Jan 29;239(4839):476-81. [ Links ]
18. Jessie K, Fong MY, Devi S, Lam SK, Wong KT. Localization of dengue virus in naturally infected human tissues, by immunohistochemistry and in situ hybridization. J Infect Dis. 2004 Apr 15;189(8):1411-8. [ Links ]
19. Lin CF, Chiu SC, Hsiao YL, Wan SW, Lei HY, Shiau AL, et al. Expression of cytokine, chemokine, and adhesion molecules during endothelial cell activation induced by antibodies against dengue virus nonstructural protein 1. J Immunol. 2005 Jan 1;174(1):395-403. [ Links ]
20. Patkar C, Giaya K, Libraty DH. Dengue virus type 2 modulates endothelial barrier function through CD73. Am J Trop Med Hyg. 2013 Jan;88(1):89-94. [ Links ]
21. Rey J. El dengue. UF. IFAS Extensión. Univ. of Florida. 2014.Nov 26; pag. 1-5. Disponible en: https://edis.ifas.ufl.edu/pdffiles/IN/IN71900.pdf (2015 1 12) [ Links ]
22. Martínez Torres E. Dengue. Estud. Av. 2008 Dec;22(64):33-52. [ Links ]
23. Jessie K, Fong MY, Devi S, Lam SK, Wong KT. Localization of dengue virus in naturally infected human tissues, by immunohistochemistry and in situ hybridization. J Infect Dis. 2004 Apr 15;189(8):1411-8. [ Links ]
24. Malagon J, Padilla J, Rojas D. Guía de Atención Clínica Integral del paciente con dengue. Infectio. 2011;15(4):293-301. [ Links ]
25. Pang J, Thein TL, Leo YS, Lye DC. Early clinical and laboratory risk factors of intensive care unit requirement during 2004-2008 dengue epidemics in Singapore: a matched case-control study. BMC Infect Dis. 2014 Dec 5; 14: 649. [ Links ]
26. Mardani M, Abbasi F, Aghahasani M, Ghavam B. First iranian imported case of dengue. Int J Prev Med. 2013 Sep;4(9):1075-7. [ Links ]
27. Campagna D de S, Miagostovich MP, Siqueira MM, Cunha RV da. Etiology of exanthema in children in a dengue endemic area. J Pediatr (Rio J). 2006 Oct;82(5):354-8. [ Links ]
28. Kalayanarooj S, Vaughn DW, Nimmannitya S, Green S, Suntayakorn S, Kunentrasai N, et al. Early clinical and laboratory indicators of acute dengue illness. J Infect Dis. 1997 Aug;176(2):313-21. [ Links ]
29. Senanayake SN. Dengue and relative bradycardia. Emerg Infect Dis. 2008 Feb;14(2):350-1. [ Links ]
30. Lateef A, Fisher DA, Tambyah PA. Dengue and relative bradycardia. Emerging Infect Dis. 2007 Apr;13(4):650-1. [ Links ]
31. Srikiatkhachorn A, Krautrachue A, Ratanaprakarn W, Wongtapradit L, Nithipanya N, Kalayanarooj S, et al. Natural history of plasma leakage in dengue hemorrhagic fever: a serial ultrasonographic study. Pediatr Infect Dis J. 2007 Apr;26(4):283-90 [ Links ]
32. Dellamonica P. Dengue fever: clinical features. Arch Pediatr. 2009 Oct;16 Suppl 2:S80-4. [ Links ]
33. Hoyos Rivera A, Pérez Rodríguez A. Actualización en aspectos epidemiológicos y clínicos del dengue. Rev. Cubana de Salud Pública. 2010 Mar;36(1):149-64. [ Links ]
34. Rigau-Pérez JG, Laufer MK. Dengue-related deaths in Puerto Rico, 1992-1996: diagnosis and clinical alarm signals. Clin Infect Dis. 2006 May 1;42(9):1241-6. [ Links ].
35. Setiawan MW, Samsi TK, Wulur H, Sugianto D, Pool TN. Dengue haemorrhagic fever: ultrasound as an aid to predict the severity of the disease. Pediatr Radiol. 1998 Jan;28(1):1-4. [ Links ]
36. Binh PT, Matheus S, Huong VTQ, Deparis X, Marechal V. Early clinical and biological features of severe clinical manifestations of dengue in Vietnamese adults. J Clin Virol. 2009 Aug;45(4):276-80. [ Links ]
37. Real R, Rojas G, Correa D, Barrios M, Aldama F, Pinchi L, Irala G, et al. Manifestaciones sistémicas de dengue. Rev. Nac (Itaugua). 2013 Dic;5(2):8-16. [ Links ]
38. Valero C N, Reyes V I, Larreal E Y, Maldonado E M. [Aminotransferases serum levels in patients with Dengue type 3]. Rev Med Chil. 2007 Oct;135(10):1304-12. [ Links ]
39. Souza LJ de, Alves JG, Nogueira RM, Gicovate Neto C, Bastos DA, Siqueira EW, et al. Aminotransferase changes and acute hepatitis in patients with dengue fever: analysis of 1,585 cases. Braz J Infect Dis. 2004 Apr;8(2):156-63. [ Links ]
40. Tristão-Sá R, Kubelka CF, Zandonade E, Zagne SM, Rocha Nde S, Zagne LO, et al. Clinical and hepatic evaluation in adult dengue patients: a prospective two-month cohort study. Rev Soc Bras Med Trop. 2012 Dec;45(6):675-81. [ Links ]
41. Paes MV, Lenzi HL, Nogueira AC, Nuovo GJ, Pinhão AT, Mota EM, et al. Hepatic damage associated with dengue-2 virus replication in liver cells of BALB/c mice. Lab Invest. 2009 Oct;89(10):1140-51. [ Links ]
42. Lee IK, Lee WH, Liu JW, Yang KD. Acute myocarditis in dengue hemorrhagic fever: a case report and review of cardiac complications in dengue-affected patients. Int J Infect Dis. 2010 Oct;14(10):e919-22. [ Links ]
43. Duarte A, López L, Iramain V, Álvarez E, Basualdo W, Alfieri P. Management of Dengue Shock Syndrome (DSS) in a Pediatric Intensive Care Unit (PICU) Pediatr. (Asunción), 2009;36(1):11-15. Disponible en: http://scielo.iics.una.py/pdf/ped/v36n1/v36n1a03.pdf (2013 1 20) [ Links ]
44. Huy NT, Van Giang T, Thuy DH, Kikuchi M, Hien TT, Zamora J, et al. Factors associated with dengue shock syndrome: a systematic review and meta-analysis. PLoS Negl Trop Dis. 2013;7(9):e2412. [ Links ]
45. Branco Mdos R, Luna EJ, Braga Júnior LL, Oliveira RV, Rios LT, Silva Mdo S, et al. Risk factors associated with death in Brazilian children with severe dengue: a case-control study. Clinics (Sao Paulo). 2014 Jan;69(1):55-60. [ Links ]
46. Lum LC, Goh AY, Chan PW, El-Amin AL, Lam SK. Risk factors for hemorrhage in severe dengue infections. J Pediatr. 2002;140(5):629-31. [ Links ]
47. Karakus A, Banga N, Voorn GP, Meinders AJ. Dengue shock syndrome and rhabdomyolysis. Neth J Med. 2007 Feb;65(2):78-81. [ Links ]
48. Sam SS, Omar SF, Teoh BT, Abd-Jamil J, AbuBakar S. Review of Dengue hemorrhagic fever fatal cases seen among adults: a retrospective study. PLoS Negl Trop Dis. 2013;7(5):e2194. [ Links ]
49. Malagon JN, Padilla J, Rojas D. Guía de Atención Clínica Integral del paciente con Dengue. Infectio. 2011;15(4):293-301. [ Links ]
1. Médico Residente de Medicina Interna. Universidad Nacional de Itapúa. Encarnación, Paraguay
2. Médico Internista, Departamento de Medicina Interna. Hospital Nacional. Ministerio de Salud Pública y Bienestar Social. Itauguá, Paraguay
Correo electrónico: fabianaldama1987@gmail.com
Artículo recibido: 22 de marzo de 2015. Artículo aprobado: 04 de abril de 2015