Serviços Personalizados
Journal
Artigo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares em
SciELO
Similares em
SciELO
Compartilhar
Revista del Nacional (Itauguá)
versão impressa ISSN 2072-8174
Rev. Nac. (Itauguá) v.6 n.1 Itauguá 2014
ARTÍCULO ORIGINAL
Factores de riesgo para el desarrollo de complicaciones neurológicas en pacientes con hemorragia subaracnoidea no traumática
Risk factors for the development of neurological complications in patients with nontraumatic subarachnoid hemorrhage
Edgar Alcibíades López Noguera1
RESUMEN
Introducción: la hemorragia subaracnoidea (HSA) representa la extravasación de sangre, generalmente súbita, por rotura de una arteria o vena, en el espacio subaracnoideo. Constituye una emergencia médica y quirúrgica, ya que su pronóstico depende en parte de un diagnóstico precoz, tanto de su presencia como de su etiología. Objetivos: determinar los factores de riesgo que influyen en la aparición de complicaciones neurológicas. Material y métodos: estudio de casos y controles, de pacientes con HSA no traumática atendidos en el Hospital Nacional de Itauguá entre los años 2010 al 2013. Resultados: de los casos la edad media fue de 53 años y de los controles fue 50 años. Predominó el sexo femenino. La hipertensión arterial fue el antecedente patológico más frecuente. El tabaquismo y etilismo estuvieron presentes en un porcentaje bajo. La presión arterial tuvo una tendencia superior en los casos. En la escala de Glasgow de ingreso hubo una diferencia muy significativa con un valor de 11 para los casos y de 14 para los controles. Se hallaron aneurismas en el 55,7%, no habiendo hallazgos en un 28%. El recuento de glóbulos blancos y las cifras de glicemia fueron superiores en los casos. Conclusión: se observó una proporción entre sexos, antecedentes patológicos, similares a los publicados. Las escalas de Glasgow, Fisher, Hunt-Hess demostraron ser importantes indicadores pronósticos de desarrollo de complicaciones. El hallazgo significativo de cifras elevadas de glóbulos blancos y de glicemia en los casos, debería estudiarse en ensayos más grandes para determinar la importancia de los mismos.
Palabras claves: hemorragia subaracnoidea, hidrocefalia, aneurisma cerebral, factor de riesgo
ABSTRACT
Introduction: Subarachnoid hemorrhage (SAH) represents the extravasation of blood, generally sudden, due to the rupture of an artery or vein in the subarachnoid space. It constitute a medical and surgical emergency, the prognosis depends partly on early diagnosis, of its presence and etiology. Objectives: To determine the risk factors influencing the development of neurological complications. Methods: Retrospective case-control study of non-traumatic SAH patients treated at the National Hospital of Itauguá between 2010 to 2013. Results: The average age of cases were 53 years old and the controls were 50 years old, with females predominance. Hypertension was the most frequent medical antecedent. Smoking and drinking were present at a low percentage. Blood pressure had a higher tendency in cases. In the Glasgow score on admission, there was a significant difference with a value of 11 for cases and 14 for controls. We found aneurysms in 55.7% and there were no findings in 28%. The white blood cell count and blood glucose were higher in cases. Conclusion: Glasgow scales, Fisher score and Hunt-Hess score proved to be important prognostic indicators for development of complications. The significant finding of elevated levels of white blood cells and blood glucose in cases, should be studied in larger trials to determine the importance thereof.
Keywords: subarachnoid hemorrhage, hydrocephalus, cerebral aneurysm, risk factor
INTRODUCCION
El espacio subaracnoideo está localizado entre la aracnoides y la piamadre, dos de las meninges que envuelven tanto el cerebro como la médula espinal. La hemorragia subaracnoidea (HSA) representa la extravasación de sangre, generalmente súbita, por rotura de una arteria o vena, en el espacio subaracnoideo cerebral o espinal, sangre que puede extenderse a los ventrículos y parénquima cerebral. Esta entidad constituye una emergencia médica y quirúrgica, ya que su pronóstico depende en parte de un diagnóstico precoz, tanto de su presencia como de su etiología1.
La HSA es una de las enfermedades más temidas por su elevada mortalidad y generación de dependencia, con un impacto económico superior al doble del estimado para ictus isquémico, representando un 5% de todos los ictus2.
La presentación clínica de la HSA es una de las más distintivas en medicina. Es descripta por los pacientes como "la peor cefalea de mi vida". Se caracteriza por un inicio súbito, alcanzando inmediatamente su máxima intensidad (cefalea en trueno). Una cefalea centinela que precede a la HSA es reportada por 10-43% de los pacientes. Esta cefalea centinela aumenta la probabilidad de resangrado precoz unas 10 veces3.Una serie de complicaciones adicionales comúnmente se producen en pacientes que han sufrido una hemorragia subaracnoidea siendo el resangrado la mayor causa de mortalidad4.
Incidencia y prevalencia: existe una considerable variación en la incidencia anual de HSA aneurismática en las diferentes regiones del mundo. La incidencia permanece invariable en 9 casos/100.000 habitantes-año, según el estudio EuropeanRegisters of Stroke, similar a la referida en los meta-análisis internacionales a excepción de Japón y Finlandia, que duplican estas cifras2. La Organización Mundial de la Salud encontró una variación de 10 veces en la incidencia anual en países de Europa y Asia, de 2,0 casos por 100.000 habitantes en China a 22,5 casos por 100 000 en Finlandia. En una revisión sistemática realizada en el año 2007 por Rooij y colaboradores encontraron que la incidencia global de HSA es de aproximadamente 9 por 100.000 habitantes por año. Las tasas son más altas en Japón y Finlandia, y aumentan con la edad. La preponderancia de las mujeres sólo se inicia en la sexta década. La disminución de la incidencia de la HSA durante los últimos 45 años es relativamente moderada en comparación con la de los accidentes cerebrovasculares en general5. En Estados Unidos se estima que la incidencia de HSA aneurismática es del 9,7 por 100 000, pero en el 2003 el “NationwideInpatientSample” proporcionó una estimación de 14,5 por 100 0006. Aunque una serie de estudios basados en la población han indicado que la incidencia de HSA aneurismática se ha mantenido relativamente estable en los últimas 4 décadas, hay una ligera disminución en la incidencia entre 1950 y 2005 para las regiones que no sean Japón, América del Sur y Finlandia3.
La incidencia de HSA aumenta con la edad, con una típica edad media de inicio en los adultos a los 50 años de edad. Es relativamente poco común en los niños, las tasas aumentan a medida que los niños crecen, oscila desde 0,18 hasta 2,0 por 100.000. Se observa una mayor incidencia de HSA aneurismática en mujeres que en hombres. Personas de raza negra e hispánica tienen una mayor incidencia comparado con los americanos3.
Factores de riesgo y prevención
Los factores de riesgo modificables para la HSA aneurismática son la hipertensión, el tabaquismo, el abuso del alcohol y el uso de fármacos simpaticomiméticos como la cocaína3,6.
El tabaquismo es el factor de riesgo independiente más importante para la HSA, que ha sido probado en varias cohortes y en estudios de casos y controles en todo el mundo. En América del Norte y Europa, la prevalencia del tabaquismo en pacientes con HSA es 45 a 75%, mientras que en la población general adulta es de 20-35%. Del total de casos de HSA, el 40% puede ser atribuido al consumo de cigarrillos.7 Después del diagnóstico de un aneurisma no roto, el tamaño de aneurisma, la ubicación, la edad y el tabaquismo son predictores independientes para la posterior ruptura del mismo7.
El papel del alcohol como factor de riesgo para la HSA no ha sido tan bien establecido como el tabaquismo. La ingesta de 150 g/semana implica un riesgo de 2,1 en estudios de cohortes y de 1,5 en diseños de casos y controles, tanto en hombres como en mujeres, independientemente del consumo de cigarrillos, la edad y la historia de la hipertensión arterial7.
En el estudio de Ruigrok et al, el consumo de alcohol de más de 300 g por semana atribuye el 20% de los casos de hemorragia subaracnoidea en la población. Beber 100-299 g por semana representó el 11% de los casos de hemorragia subaracnoidea. La detección y el tratamiento preventivo de los pacientes con predisposición familiar de HSA solo causarían una modesta reducción de la incidencia de la HSA en la población general. En cambio, una mayor reducción se puede lograr mediante la reducción de factores de riesgo modificables como el consumo de alcohol, tabaquismo y la hipertensión8. El tabaquismo es el factor de riesgo modificable más importante para la formación, crecimiento y ruptura, por lo que debe ser desalentada. El abuso del alcohol y su consumo repentino en grandes cantidades es un factor de riesgo de ruptura del aneurisma7.
La historia de hipertensión arterial como factor de riesgo para la hemorragia subaracnoidea parece ser menos importante que para otros subtipos de ictus. La prevalencia de hipertensión entre los pacientes con HSA (20-45%) es algo más alta que en la población general; después de la edad, sexo, tabaquismo y consumo de alcohol, la historia de hipertensión no se ha demostrado que aumente significativamente el riesgo de HSA. Sin embargo, en todos los estudios de cohortes, y de casos y controles, la hipertensión sigue siendo un factor de riesgo importante7. La hipertensión puede ser considerada así como un factor de riesgo importante para HSA y posiblemente para la formación de aneurisma y la ruptura del mismo.
Además del sexo femenino, el riesgo de HSA aneurismática se incrementa por la presencia de un aneurisma cerebral sin ruptura, en particular las que son sintomáticas, grandes en tamaño y que están situados ya sea en la arteria comunicante posterior o en el sistema vertebrobasilar. También son de riesgo la historia de HSA aneurismática anterior con o sin aneurisma residual sin tratar, una historia de aneurismas familiares de al menos un familiar de primer grado con un aneurisma intracraneal y, sobre todo, si hay más de 2 familiares de primer grado afectados. Otros factores de riesgo son ciertos síndromes genéticos, como la poliquistosis renal autosómica dominante y el síndrome de Ehlers - Danlos3.
Los aneurismas en la circulación anterior parecen ser más propensos a la ruptura en los pacientes mayores de 55 años de edad, mientras que los aneurismas de las comunicantes posteriores se rompen con mayor frecuencia en los hombres. El tamaño en el que los aneurismas se rompen parece ser menor en aquellos pacientes con la combinación de hipertensión más tabaquismo que en aquellos con cualquiera de los factores de riesgo por sí solos. Los acontecimientos vitales importantes, como problemas financieros o legales en el último mes, puede aumentar el riesgo de HSA aneurismática. El tamaño del aneurisma mayor a 7 mm ha demostrado ser un factor de riesgo para la ruptura. No parece haber un mayor riesgo de HSA aneurismática en el embarazo, parto y puerperio3.
La inflamación parece jugar un papel importante en la patogénesis y el crecimiento de los aneurismas intracraneales. Aunque no existen estudios controlados en humanos, las estatinas y los bloqueadores de los canales de calcio pueden retardar la formación del aneurisma a través de la inhibición de ciertos mediadores como el NF-kB, factor de necrosis tumoral y otras vías9.
Entre los factores de riesgo claramente atribuibles y modificables de HSA aneurismática están el índice de masa corporal muy bajo, tabaquismo y consumo elevado de alcohol. Sin embargo, a pesar de las notables mejoras en el tratamiento de la hipertensión, la hiperlipidemia y la disminución de las tasas de tabaquismo a lo largo del tiempo, la incidencia de HSA aneurismática no ha cambiado de forma apreciable en 30 años. Es posible que la dieta aumenta el riesgo de accidente cerebrovascular en general y en particular de HSA aneurismática. En un estudio epidemiológico de los fumadores finlandeses que fueron controlados durante 13 años, el aumento del consumo de yogurt se asoció con un mayor riesgo de HSA. El consumo de verduras está asociada con un menor riesgo de accidente cerebrovascular y de HSA aneurismática. Consumo de café, té y suplementos de magnesio se asociaron con un menor riesgo de accidente cerebrovascular en general, pero no cambió el riesgo de HSA aneurismática3.
Aunque la letalidad de la HSA aneurismática se mantiene alta en todo el mundo, las tasas de mortalidad parecen haber disminuido en los países industrializados durante los últimos 25 años. La tasa de mortalidad promedio en los estudios epidemiológicos de los Estados Unidos ha sido del 32% frente al 43% a 44% en Europa y 27% en Japón. Estas cifras se basan en estudios que no siempre tienen en cuenta los casos de muerte prehospitalaria. La edad media de los pacientes con HSA aneurismática es cada vez mayor y se ha observado que tienen un impacto negativo en las tasas de supervivencia. El sexo y las variaciones raciales desempeñan un papel en las tasas de supervivencia, con algunos estudios que sugieren una mayor mortalidad en las mujeres que en los hombres y una mayor mortalidad en los negros, indios americanos, nativos de Alaska, asiáticos, isleños del Pacífico que en los blancos3.
Resultado funcional de los supervivientes: los estudios poblacionales disponibles ofrecen poca información sobre el resultado funcional de los supervivientes. Las tasas de dependencia reportados varían de 8% a 20% utilizando la escala de Rankin modificada. Sin embargo, las escalas son relativamente insensibles al deterioro cognitivo, cambios de comportamiento, readaptación social y nivel de energía, además podrían subestimar el efecto de la HSA aneurismática en la función y la calidad de vida de los pacientes que sobreviven. Múltiples estudios, usando diversos diseños, han demostrado de forma consistente que la discapacidad intelectual es muy frecuente después de la HSA aneurismática. Aunque la función cognitiva tiende a mejorar durante el primer año, el deterioro cognitivo global todavía está presente en el 20% de los pacientes con HSA aneurismática y se asocia con una recuperación funcional más pobre y menor calidad de vida. Déficits cognitivos y el declive funcional a menudo se agravan por los trastornos del estado de ánimo, fatiga y trastornos del sueño. Trastornos de conducta y psicosociales, así como una pobre resistencia física y mental, son algunos de los factores más comúnmente encontrados y explican la incapacidad de los pacientes por lo demás independientes a regresar a sus ocupaciones anteriores3.
La gravedad de la presentación clínica es el indicador pronóstico más importante. La gravedad clínica inicial se puede categorizar de forma fiable mediante el uso de escalas validadas simples, como el de Hunt y Hess y la Escala de la Federación Mundial de Neurocirujanos. El resangrado es un factor predictivo importante de mal pronóstico. Otros factores predictores de mal pronóstico incluyen la edad avanzada, enfermedad médica preexistente severa, edema cerebral global en la tomografía computarizada, hemorragia intraventricular y/o intracerebral, vasoespasmo sintomático, infarto cerebral retrasado, la hiperglucemia, fiebre, anemia y otras complicaciones sistémicas, como la neumonía y la sepsis. Ciertos factores del aneurisma, como su tamaño, la ubicación y configuración compleja, pueden aumentar el riesgo de complicaciones perioperatorias y afectar el pronóstico general. Después del alta es razonable remitir a los pacientes con HSA aneurismática de a evaluación completa, incluyendo un examen cognitivo, conductual y evaluaciones psicosociales10.
Manifestaciones clínicas: la rotura de un aneurisma arterial libera sangre directamente en el líquido cefalorraquídeo (LCR) en virtud de la presión arterial. La sangre se propaga rápidamente dentro del LCR, produciendo un aumento de la presión intracraneal. El sangrado por lo general dura sólo unos pocos segundos, pero el resangrado es común y ocurre con mayor frecuencia durante el primer día. En consonancia con la rápida propagación de la sangre, los síntomas de la HSA generalmente comienzan repentinamente, se producen por la noche en 30 por ciento de los casos. El síntoma principal es dolor de cabeza repentino e intenso en el 97 por ciento de los casos, se describe clásicamente como "el peor dolor de cabeza de mi vida". El dolor de cabeza está lateralizado en 30 por ciento de los pacientes, predominantemente hacia el lado del aneurisma. El inicio del dolor de cabeza puede o no estar asociado con una breve pérdida de la conciencia, convulsiones, náuseas o vómitos y meningismo. Los signos meníngeos y dolor de espalda a menudo pueden no desarrollarse hasta varias horas después del sangrado, ya que es causada por la descomposición de los productos sanguíneos dentro del LCR, que conducen a una meningitis aséptica11.
Aproximadamente 30 a 50% de los pacientes tienen una hemorragia menor o "fuga de advertencia", que se manifiesta sólo por un dolor de cabeza repentino y grave ("cefalea centinela") que precede a una HSA importante por 6 a 20 días, siendo su frecuencia de 10 a 43 por ciento12.
Diagnóstico
Tomografía computarizada: el estudio de elección en la actualidad para la detección de sangre en el espacio subaracnoideo es la tomografía axial computarizada (TAC) de cráneo. Su sensibilidad es del 95% en las primeras 24 horas, disminuyendo progresivamente en los días sucesivos a medida que la sangre se torna isodensa al parénquima cerebral. La densidad de la sangre en la TAC depende de la concentración de hemoglobina, por lo que en caso de anemia con concentración de hemoglobina inferior a 10 g/dL la misma será isodensa al parénquima. Una técnica adecuada es fundamental a la hora de diagnosticar una HSA mediante TAC. Es recomendable la realización de cortes finos de unos 3 mm a nivel de la base del cráneo para evitar que cortes más gruesos puedan ocultar la presencia de pequeñas colecciones. Según la distribución y la cantidad de sangre evidente en la tomografía la HSA puede clasificarse según la escala de Fisher1,11.
Punción lumbar: debe realizarse a todos los pacientes en los que se sospeche HSA y cuya TAC sea negativa o dudosa. Los errores a la hora de interpretar los hallazgos del LCR son frecuentes, dada la dificultad de diferenciar la presencia verdadera de sangre en el espacio subaracnoideo de una punción traumática, hecho que se produce en hasta el 20% de los casos. En la HSA los eritrocitos se diseminan rápidamente por el espacio subaracnoideo, donde persisten por días o semanas, lisándose de manera gradual. La hemoglobina que se libera se metaboliza a pigmentos como la oxihemoglobina (color rosado) y la bilirrubina (amarilla), resultando en xantocromía. La oxihemoglobina se puede detectar a las pocas horas, pero la bilirrubina necesita aproximadamente 12 horas para detectarse. Esta última es más fiable a la hora del diagnóstico, pero su hallazgo en el LCR depende del tiempo transcurrido entre el inicio de la sintomatología y la punción lumbar, siendo recomendable que no sea inferior a las 12 horas. La mayoría de los autores asumen que la xantocromía es el criterio diagnóstico primario en los casos de HSA con TC normal7.
Angiografía cerebral: en el momento actual la mayoría de los centros hospitalarios involucrados en esta patología disponen de equipamiento para la realización de angiografías, TAC y/o resonancia magnética (RM) (angio-TAC o angio-RM). Mediante estas exploraciones se puede determinar con suficiente fiabilidad la presencia o no de un aneurisma como causa de la HSA, sus características anatómicas, las de los vasos del polígono de Willis y datos esenciales para un correcto tratamiento. La angiografía por sustracción digital sigue siendo la prueba de referencia para el diagnóstico de aneurismas intracraneales. En un 70-80% de los casos esta prueba mostrará la presencia de un aneurisma; en caso de normalidad está indicado repetir la angiografía a los 14 días.
Escalas de evaluación clínica
Varios sistemas de clasificación se utilizan en la práctica para estandarizar la clasificación clínica de los pacientes con HSA basándose en el examen neurológico inicial y en la aparición de sangre en la TAC de cráneo simple inicial. Es importante estimar el grado clínico de cada paciente ya que existe una buena correlación entre la grado clínico inicial y la evolución final. Las escalas de evaluación clínica dan idea del efecto inicial de la hemorragia y de los efectos fisiopatológicos que suceden en el comienzo de la enfermedad. A lo largo de los años se han propuesto multitud de clasificaciones. Aunque no existe una escala perfecta, hoy día las más validadas son la de Hunt-Hess y la propuesta por la Federación Mundial de Sociedades Neuroquirúrgicas (WFNS), basada en la escala de coma de Glasgow cuya puntuación desglosada debe quedar también registrada13.
Escala de Hunt y Hess
El sistema de clasificación propuesto por William E. Hunt y Robert M. Hess en 1968 es uno de los más ampliamente utilizados. La escala fue pensada como un índice del riesgo quirúrgico. El grado clínico inicial se correlaciona con la gravedad de la hemorragia. Una modificación posterior propuesta por Hunt y Kosnik añadió un grado 0 para los aneurismas no rotos y grado 1a de déficit neurológico fijo sin otros signos de la HSA. Aunque la escala de Hunt y Hess es fácil de utilizar, las clasificaciones son arbitrarias, algunos de los términos son vagos y algunos pacientes pueden presentarse con características iniciales que desafían la colocación dentro de un mismo grado. Por ejemplo, una presentación rara de HSA puede incluir dolor de cabeza grave (grado II), nivel normal de conciencia (grado III) y hemiparesia severa (grado IV). En tales casos, el clínico debe decidir subjetivamente cuál de las características de presentación es más importante para la determinación del grado. (ver tabla 1)14.
Tabla 1: Escala de Hunt y Hess14.
La escala de Fisher
La escala de Fisher fue ideada en 1980 como un índice de riesgo de vasoespasmo basado en el patrón de la hemorragia que se vio en exploración inicial computarizada de la cabeza. (ver tabla 2)
Tabla 2: Escala de Fisher2.
Escala de coma de Glasgow
La Escala de coma de Glasgow fue ideada a principios de 1970.15 No es una verdadera escala de calificación de la HSA, pero es más bien un método estandarizado para evaluar el nivel de conciencia en un número de enfermedades neurológicas, incluyendo la HSA. (ver tabla 3)
Tabla 3: Escala de coma de Glasgow, representa la suma de tres respuestas15.
Escala de la Federación Mundial de Sociedades Neuroquirúrgicas
El sistema de clasificación de la Federación Mundial de Neurocirujanos fue propuesto en 1988. Se basa en la puntuación en la escala de coma de Glasgow (GCS) y la presencia de déficits motores.16 A diferencia de la escala de Hunt y Hess, la escala WFNS utiliza terminología objetiva para asignar calificaciones. Sin embargo, es más compleja de administrar que la escala de Hunt y Hess (ver tabla 4).
Tabla 4: Escala de la Federación Mundial de Sociedades Neuroquirúrgicas16
Complicaciones neurológicas de HSA
Resangrado: el resangrado aneurismático se asocia con una alta mortalidad y mal pronóstico para la recuperación funcional en los supervivientes. El riesgo de resangrado es máximo en los primeros 2 a 12 horas, con tasas reportadas de aparición entre el 4% y el 13,6 % en las primeras 24 horas. De hecho, más de un tercio de los resangrados ocurren dentro de las 3 primeras horas y casi la mitad dentro de las 6 horas del inicio de los síntomas, este resangrado precoz se asocia a una peor evolución17.
Los factores asociados con el resangrado del aneurisma incluyen retraso en inicio del tratamiento del aneurisma, peor estado neurológico al ingreso, pérdida de conciencia inicial, dolores de cabeza centinela anteriores (fuertes dolores de cabeza que duran 1 hora, que no conducen al diagnóstico de HSA aneurismática), gran tamaño del aneurisma y presión arterial sistólica, posiblemente, mayor a 160 mm Hg. Los factores genéticos, aunque relacionados con la aparición de aneurismas intracraneales, no parecen estar relacionados con una mayor incidencia de resangrado7.
El tratamiento precoz del aneurisma roto puede reducir el riesgo de resangrado. Entre los pacientes que se presentan de una manera retardada y durante la ventana de vasoespasmo, el retraso en la obliteración de aneurisma se asocia con un mayor riesgo de resangrado en comparación con la obliteración temprana de aneurisma. Hay acuerdo general en que la hipertensión aguda debe ser controlada después de HSA aneurismática y hasta la obliteración del aneurisma, pero los parámetros para el control de la presión arterial no se han definido. Una variedad de medicamentos valorables están disponibles. La nicardipina puede lograr un control más uniforme de la presión arterial que el labetalol y el nitroprusiato de sodio. Aunque la reducción de la presión de perfusión cerebral puede conducir a isquemia cerebral, un estudio de cohorte de pacientes neurológicamente críticos no se encontró una asociación entre el uso de la nicardipina y la reducción de la tensión de oxígeno del cerebro. Clevidipine, un bloqueador del canal de calcio de muy rápida acción, es otra opción para el control de la hipertensión aguda, pero se carecen de datos para HSA aneurismática en este momento3.
El tratamiento con antifibrinolíticos se ha demostrado que reduce la incidencia de resangrado aneurismático cuando hay un retraso en la obliteración del aneurisma. Un centro de referencia instituyó una política de uso a corto plazo de ácido aminocaproico para prevenir el resangrado durante el traslado del paciente. Hubo un aumento del riesgo de trombosis venosa profunda, pero no de embolia pulmonar. Ni el ácido aminocaproico ni el ácido tranexámico están aprobados por la Food and DrugAdministration de EE.UU. para la prevención del resangrado del aneurisma3.
Vasoespasmo: el vasoespasmo es una de las complicaciones de la HSA más frecuentes y difíciles de tratar. Puede cursar como un proceso transitorio, autolimitado y asintomático. Sin embargo, en algunos casos, evoluciona hacia un infarto cerebral. Es una causa importante de muerte y discapacidad en los pacientes con HSA aneurismática. En ocasiones el vasoespasmo coexiste con otras complicaciones, que además de comprometer el pronóstico del enfermo, pueden producir manifestaciones clínicas similares a las del vasoespasmo, siendo más difícil su reconocimiento y la adopción de medidas terapéuticas apropiadas.18,19 El vasoespasmo de las arterias cerebrales angiográficamente visibles después de HSA aneurismática ocurre con mayor frecuencia entre 7 y 10 días después de la ruptura del aneurisma y se resuelve de forma espontánea después de 21 días3.
La cascada de acontecimientos que culminan en estrechamiento arterial se inicia cuando la oxihemoglobina entra en contacto con el lado abluminal del vaso. Las vías que conducen al estrechamiento arterial han sido el foco de una extensa investigación básica, pero ninguna terapia preventiva eficaz se ha desarrollado hasta la fecha. Parte de la razón para esta falta de éxito probablemente deriva del hecho de que se produce vasoespasmo en múltiples niveles en la circulación arterial y arteriolar. El estrechamiento de grandes arterias visto en los vasos angiográficamente visibles sólo da lugar a síntomas neurológicos isquémicos en el 50% de los casos, y, aunque existe una correlación entre la gravedad del espasmo de las arterias grandes y la isquemia sintomática, hay pacientes con espasmo severo de una arteria grande que nunca se vuelve sintomático y otros, con espasmo bastante modesto, que llegan a desarrollar infarto3.
El tratamiento preventivo con calcio antagonistas es efectivo. Una revisión Cochrane, que incluyó 16 ensayos con 3.361 pacientes con HSA, encontró un riesgo relativo de 0,81 (IC95% 0,72 - 0,92) para la muerte o la dependencia en los pacientes tratados con estos fármacos, el correspondiente número de pacientes necesario a tratar fue 19 (IC95% 1-51). Para la nimodipina oral sola, el RR fue 0,67 (IC 95% 0,55-0,81); para otros antagonistas del calcio o con la administración intravenosa de nimodipino los resultados no fueron estadísticamente significativos. Los antagonistas del calcio reducen la aparición de isquemia secundaria y mostraron una tendencia hacia la reducción de la mortalidad. Aunque la reducción del riesgo de "resultado deficiente" es estadísticamente robusto, depende principalmente de un único ensayo grande, y por lo tanto, los beneficios de la nimodipina no puede considerarse como más allá de toda duda razonable. La implicación práctica es que el régimen con nimodipina, 60 mg por vía oral cada 4 h durante 3 semanas, se considera actualmente el tratamiento de elección en pacientes con HSA por aneurisma. Si el paciente es incapaz de tragar, los comprimidos de nimodipino deben ser administrados por sonda nasogástrica con solución salina normal. La administración intravenosa se aboga por el fabricante y es más caro, pero no hay evidencia para apoyar su uso por esta vía. Por otra parte, la administración intravenosa de nicardipina no mejora los resultados. Los antagonistas del calcio también se han aplicado en el espacio subaracnoideo después de la oclusión quirúrgica del aneurisma, pero esta estrategia es de beneficio no probado20.
La inflamación y la disfunción endotelial son cada vez más reconocidos componentes esenciales en la fisiopatología del vasoespasmo y posterior infarto cerebral. La ruptura aneurismática y la posterior salida de sangre al espacio subaracnoideo activan la liberación de citoquinas inflamatorias como la interleuquina 6 y el factor de necrosis tumoral alfa. Los neutrófilos son atraídos a los sitios de la inflamación cerebral, su unión al endotelio vascular es un proceso mediado por moléculas de adhesión celular tales como ICAM - 1 y las selectinas. Los leucocitos activados dentro del espacio subaracnoideo contribuyen al vasoespasmo mediante la promoción de la producción de endotelina-1, un potente vasoconstrictor, agotando el óxido nítrico, y la producción de especies reactivas del oxígeno. Los radicales libres aumentan la peroxidación de lípidos y la oxidación de la bilirrubina, los cuales pueden dañar las células del músculo liso. Este mecanismo inflamatorio para el vasoespasmo se evidencia por infiltrados de células inflamatorias visto en paredes de los vasos intracraneales afectados. Las estatinas exhiben acciones pleiotrópicas que pueden ser beneficiosas en la atenuación de algunos de los trastornos inflamatorios y vasoactivos subyacentes que llevan al vasoespasmo con posterior infarto cerebral. Aumentan los niveles de óxido nítrico y bloquean la activación y migración de los leucocitos inflamatorios. Las estatinas son capaces de estabilizar la función endotelial y de autorregulación, pueden poseer propiedades antiplaquetarias y antitrombóticas, prevenir la apoptosis neuronal y eliminar los radicales libres. La evidencia experimental ha apoyado su capacidad para atenuar el desarrollo de vasoespasmo en modelos animales y la inhibición de la infiltración inflamatoria de paredes de los vasos21. Las estatinas han sido estudiadas en varios ensayos aleatorizados pequeños con resultados variables. Recientemente, dos estudios aleatorizados controlados de fase II demostraron que la iniciación aguda del tratamiento con estatinas directamente después de la hemorragia subaracnoidea aneurismática disminuye la incidencia de vasoespasmo radiológico y signos clínicos de isquemia cerebral retardada, incluso reduce la mortalidad22. Se realizaron en un solo centro de exploración, fue prospectivo, aleatorizado, doble ciego, controlado con placebo. Los pacientes fueron asignados al azar a la simvastatina 80 mg o placebo una vez al día. Se incluyeron un total de 32 pacientes. No hubo diferencias estadísticamente significativas en las características basales clínicas. Con respecto a los resultados primarios, hubo diferencias significativas por grupo de tratamiento para el colesterol total y de lipoproteína de baja densidad (LDL) colesterol (p< 0,0001) pero no para los parámetros de la coagulación, la fibrinólisis, la función del endotelio y la inflamación. Con respecto a los resultados secundarios, no se observaron diferencias en la incidencia de vasoespasmotranscraneal por Doppler, los signos clínicos de la isquemia cerebral diferida o peor pronóstico a largo plazo. Se llegó a la conclusión de que tanto los resultados primarios y secundarios de este estudio no apoyan un efecto beneficioso de la simvastatina en pacientes con HSA. Una fase III de ensayos más grandes (simvastatina en hemorragia subaracnoidea aneurismática [STASH]) está en curso22.
Recientemente se ha indicado que la endotelina-1 juega un papel crítico en la patogénesis del vasoespasmo. El clazosentan, primer antagonista no peptídico selectivo del receptor ETA, se pensó que era una "bala mágica" para inhibir el vasoespasmo mediado por endotelina. Se han realizado algunos ensayos sobre el efecto de clazosentan en HSA aneurismática pero con conclusiones contradictorias. Por ejemplo, algunos investigadores sugirieron que clazosentan redujo la severidad y la incidencia de vasoespasmo, o la relacionada con la morbilidad / mortalidad, mientras que otros argumentaron en contra de eso. En un meta-análisis realizado recientemente se encontraron datos que soportan que el clazosentan es probablemente eficaz en la prevención de la aparición de vasoespasmoangiográfico, vasoespasmo sintomático, vasoespasmo relacionados con la morbi-mortalidad y la terapia de rescate. Sin embargo, no hay evidencia significativa que soporte los beneficios del uso de clazosentan en la disminución de la ocurrencia de vasoespasmoangiográfico y sintomático, la mortalidad o en la mejora del resultado funcional23.
Hidrocefalia: es una complicación común de la HSA. En una serie grande, la hidrocefalia fue documentada por TAC en un 15% de los pacientes, 40% de los cuales eran sintomáticos. La presentación clínica de la hidrocefalia en este contexto es el deterioro progresivo del nivel de conciencia, acompañado por la dilatación ventricular en la TAC de control. Los factores asociados con un mayor riesgo de hidrocefalia son la hemorragia intraventricular, aneurismas de la circulación posterior, tratamiento con agentes antifibrinolíticos y una baja puntuación en la Escala de Coma de Glasgow al ingreso.10La incidencia también se incrementa en pacientes con hiponatremia o antecedentes de hipertensión. La edad avanzada es un factor de riesgo adicional24.
La hidrocefalia después de la HSA se produce por la obstrucción del flujo del líquido cefalorraquídeo por productos de la sangre o adherencias, o por una reducción de la absorción de LCR en las granulaciones aracnoideas. En el primer caso se produce como una complicación aguda que tiende a ocurrir dos semanas o más tarde y es más probable que esté asociado con dependencia de derivación. Ocurre en 15% a 87%. Por otro lado, la hidrocefalia derivación dependiente crónica ocurre en 8,9 a 48%3,25.
La mejoría espontánea se produce en la mitad de los pacientes con hidrocefalia aguda y alteración de la conciencia, por lo general dentro de 24 horas. En el resto, la hidrocefalia aguda se asocia con una mayor morbilidad y mortalidad secundaria a resangrado y el infarto cerebral. Aproximadamente la mitad a dos tercios de los pacientes con hidrocefalia aguda después de la HSA desarrollarán hidrocefalia derivación dependiente crónica26.
La hidrocefalia aguda secundaria a HSA es manejada por drenaje ventricular externo o por punción lumbar evacuadora. El drenaje ventricular externo aumenta el riesgo de resangrado, en cambio, la punción lumbar evacuadora ha demostrado ser segura, sin incrementar el riesgo de resangrado. Sin embargo, cuando se sospecha una hidrocefalia de causa obstructiva, es preferible el drenaje ventricular externo. En cambio, la hidrocefalia crónica asociada a HSA es usualmente tratada con derivación ventrículo peritoneal. En un estudio se observó que en el grupo tratado con drenaje ventricular externo, el resangrado ocurrió en siete de los 34 pacientes (21%), en siete de los 34 controles (21%) con hidrocefalia no tratada, y en seis de 34 controles (18%) sin hidrocefalia. En el grupo tratado con uno o más punciones lumbares, el resangrado se observó en uno de 21 pacientes (5%), en tres de los 21 controles (14%) con hidrocefalia no tratada, y en ninguno de los 21 controles sin hidrocefalia. Las razones de riesgo de resangrado fueron 1,0 (IC95% 0,4 -2,7) para el tratamiento de drenaje ventricular externo y 0,7 (IC95% 0,1-6,4) para el tratamiento de la punción lumbar27.
Convulsiones: las convulsiones y la epilepsia son complicaciones bien conocidas de la hemorragia subaracnoidea. En un estudio prospectivo donde se analizaron 247 de 431 pacientes con HSA en un periodo de 5 años, vivos al alta, se hizo un seguimiento a lo largo de 12 meses. En este estudio las convulsiones ocurrieron en 7% de los pacientes con HSA y estuvieron relacionados con vasoespasmo, infarto cerebral, peor recuperación funcional y peor calidad de vida28.La incidencia de la epilepsia después de la cirugía de los aneurismas intracraneales rotos ha oscilado entre 1% y 27,5%, parece estar relacionada con la propia HSA, los efectos de la craneotomía o ambos. Debido a que se pueden desarrollar después de un ictus inicial o de resangrado, el uso profiláctico de fármacos antiepilépticos en los pacientes con HSA por aneurisma es una práctica neuroquirúrgica común. Pero, ambas indicaciones y duración de la profilaxis de convulsiones seguían siendo poco definidos en las últimas tres décadas. Esta receta ha sido más habitual o una moda basada en la narrativa, en lugar de un enfoque basado en la evidencia29.
Complicaciones no neurológicas
Hiponatremia: la hiponatremia después de la HSA es relativamente común con tasas de prevalencia de aproximadamente 30 a 55%. La etiología de la hiponatremia en la HSA no está claro, pero es probablemente mediada por lesión hipotalámica secundaria a vasoespasmo. Esta lesión lleva a un aumento de la secreción de la hormona antidiurética, que causa el síndrome de secreción inadecuada de hormona antidiurética. Otra causa puede ser el síndrome de cerebro perdedor de sal causado por una liberación mejorada de péptido natriuréticoauricular, el péptido natriurético cerebral, el péptido natriurético, la noradrenalina. Estos péptidos producen un exceso de natriuresis que conduce a la diuresis osmótica. Independientemente de la etiología, la hiponatremia, cuando está presente, potencialmente empeora la condición neurológica subyacente y la hiponatremia severa probablemente aumenta el riesgo de mortalidad y morbilidad30.
Un equilibrio óptimo de sodio y de volemia es de primordial importancia en los pacientes con lesiones cerebrales. En particular, los cambios en la concentración sérica de sodio influyen en el tamaño neuronal, mientras se mantiene una presión de perfusión cerebral adecuada que evita una lesión mayor31. La hiponatremia después de la HSA aumenta el riesgo de vasoespasmo cerebral sintomático. La hipovolemia y la disminución de la presión arterial pueden producir una reducción de la perfusión cerebral y aumentar el potencial vasoespasmo sintomático. La terapia hipervolémica es menos eficaz cuando hay cerebro perdedor de sal. Los mineralocorticoides como la hidrocortisona son reportados como útiles para atenuar la natriuresis32.
Los niveles bajos de sodio en suero pueden empeorar el edema cerebral o efecto de masa. Los niveles bajos de potasio en suero también son comunes entre los pacientes con HSA por aneurisma y están asociados con prolongación del intervalo QT y arritmia ventricular. Un reciente meta-análisis sugiere que la infusión de sulfato de magnesio mejora el resultado clínico en los pacientes después de la HSA por aneurisma, sin embargo, la infusión de sulfato de magnesio puede exacerbar teóricamente los trastornos electrolíticos. Se revisaron retrospectivamente los datos demográficos y de laboratorio recogidos prospectivamente de 100 pacientes después de la HSA subaracnoidea por aneurisma en un centro neuroquirúrgico en Hong Kong. Así, 51 pacientes tuvieron infusión de sulfato de magnesio durante 14 días (grupo 1) y 49 pacientes fueron tratados de manera similar pero sin sulfato de magnesio (grupo 2). Los días de hipernatremia fueron 2,0±2,7 para el grupo 1 y 2,0 ±2,5 para el grupo 2 (p 0,9); los días de hiponatremia fueron 2,7±3,1 para el grupo 1 y 2,0±2,9 para el grupo 2 (p 0,2); los días de hipopotasemia fueron 4,5±3,1 para el grupo 1 y 4,5±3,2 para el grupo 2 (p 0,8). La hiperpotasemia fue poco frecuente en ambos grupos. Tampoco hubo diferencias estadísticamente significativas entre los dos grupos cuando los datos se volvieron a analizar como hiponatremia severa, hipocalemia severa e hiperpotasemia grave. En este estudio se llegó a la conclusión que la infusión de sulfato de magnesio era seguro y no parecía agravar la duración del trastorno electrolítico asociado con hemorragia subaracnoidea por aneurisma33.
Alteraciones cardíacas: una serie de cambios cardiacos ocurren después de extravasación de sangre al espacio aneurismático, incluyendo cambios en el electrocardiograma (ECG), cambios estructurales en la ecocardiografía y elevación de enzimas cardíacas. El impacto de las complicaciones cardiacas después de la HSA sigue siendo controvertido. En el 2009 se realizó un meta-análisis para evaluar si los cambios del ECG, el daño miocárdico o alteraciones de la ecocardiografía están relacionados con la muerte, mal resultado (muerte o dependencia) o con el vasoespasmo sintomático después de la HSA. En este estudio se observó que los marcadores de lesión cardíaca y la disfunción se asociaron con un mayor riesgo de muerte, un mal resultado y en la aparición de vasoespasmo sintomático después de la HSA. Estos parecen ser más frecuentes y más graves en los pacientes con HSA más grave34.
Los pacientes con HSA exhiben una prevalencia de lesión cardiaca que va del 17% al 40%. Una hipótesis que prevalece es que durante la ruptura del aneurisma se producen elevaciones bruscas de catecolaminas en las terminaciones nerviosas simpáticas cardíacas causando necrosis en banda en el subendocardio35.
Las alteraciones del ECG más frecuentes son la depresión del segmento ST, prolongación del intervalo QT, inversión simétrica de la onda T y ondas U prominentes. Alteraciones del ritmo que amenazan la vida tales como torsades de pointes se han descrito también, así como la fibrilación auricular y el flúter. Anomalías del segmento ST y de la onda T, junto con bradicardia y taquicardia relativos se encuentran en una gran serie que se asocia de forma independiente con la mortalidad. Otro estudio informó una asociación entre la prolongación del intervalo QT y vasoespasmo angiográfico36.
OBJETIVOS
Determinar los factores de riesgo que influyen en la aparición de complicaciones neurológicas o hiponatremia.
Describir las localizaciones más frecuentes de los aneurismas según arteriografía de 4 troncos o angiotomografía.
Determinar las características demográficas de los pacientes con HSA.
Determinar las características clínicas al ingreso según las escalas de coma de Glasgow, Fischer y de Hunt-Hess.
MATERIAL Y METODOS
Diseño: de casos y controles.
Población de estudio
Casos: varones y mujeres, mayores de 16 años, portadores de HSA no traumática con complicaciones, internados en el Departamento de Medicina Interna del Hospital Nacional (Itauguá) entre los años 2010 al 2013.
Controles: varones y mujeres, mayores de 16 años, portadores de HSA no traumática sin complicaciones, internados en el Departamento de Medicina Interna del Hospital Nacional (Itauguá) entre los años 2010 al 2013.
Criterios de inclusión: pacientes diagnosticados de HSA por TAC de cráneo simple o por punción lumbar, sin antecedentes de traumatismo, que cuenten o no con arteriografía cerebral de 4 troncos y/o angio TAC cerebral. Para ser incluidos como casos se requería la aparición de resangrado, vasoespasmo, hidrocefalia, convulsiones o hiponatremia.
Muestreo: no probabilístico, de casos consecutivos.
Reclutamiento: los sujetos se seleccionarán a través de las fichas de internación obrantes en el archivo del Hospital Nacional (Itauguá).
Variables: demográficas (edad, sexo, procedencia), clínicas (motivos de consulta, comorbilidades, cifras de presión arterial sistólica, presión arterial diastólica y presión arterial media al ingreso, escala de Fisher al ingreso, escala de Hunt y Hess al ingreso, escala de coma de Glasgow al ingreso, cefalea centinela), desarrollo de complicaciones neurológicas (resangrado, vasoespasmo, hidrocefalia, convulsiones), localización del aneurisma según arteriografía cerebral de 4 troncos y/o angio TAC cerebral, intervalo de tiempo entre el inicio de los síntomas y el inicio del tratamiento médico, intervalo de tiempo entre el inicio de los síntomas el desarrollo de complicaciones.
Cálculo de tamaño de muestra: se utilizó el programa estadístico EpiInfo©. Se consideraron dos factores de riesgo como parámetros para este cálculo: la escala de Fischer y la de Hunt y Hess.
Para los casos se esperó una proporción de 90% de sujetos con escala Fischer III-IV y para los controles una proporción de 50%26. Con un error alfa 5%, error beta 20%, intervalo de confianza 95%, el número mínimo calculado fue 24 casos y 24 controles.
Para los casos se esperó una proporción de 50% de sujetos con escala Hunt y Hess III-IV y para los controles una proporción de 15%15. Con un error alfa 5%, error beta 20%, intervalo de confianza 95%, el número mínimo calculado fue 32 casos y 32 controles.
Finalmente, considerando el mayor número, se incluyeron al menos 35 casos y 35 controles.
Gestión de datos: las variables fueron registradas en planilla electrónica y sometidas a estadística descriptiva con el programa EpiInfo©. Las nominales se expresan en porcentajes y las cuantitativas en medias±DS. Para el análisis de variables cuantitativas se utilizó la prueba ANOVA. Para el análisis de variables cualitativas paramétricas se utilizó la prueba Chi2 y para datos no paramétricos la prueba Kruskall Wallis. Se consideró significativa toda p <0,05.
Definiciones operacionales
- Resangrado: deterioro del estado neurológico acompañado de la aparición de una nueva hemorragia en TAC de cráneo simple de control37 .
- Cefalea centinela: cefalea que precede a la hemorragia subaracnoidea12.
- Vasoespasmo sintomático: desarrollo de un nuevo déficit focal, no explicable por la hidrocefalia o el resangrado, como síntoma objetivo de vasoespasmo18.
- Hidrocefalia: dilatación ventricular cuantificada mediante el Índice de Evans. Este índice mide la relación entre el tamaño máximo de las astas frontales y el diámetro máximo entre ambas tablas internas, en un corte axial a la altura de ambos caudados y del tercer ventrículo. Se considera patológico y compatible con hidrocefalia cuando es igual o superior a 0,30.
- Hiponatremia: concentración plasmática de sodio inferior a 135 mEq/L en ausencia de uso de diuréticos31.
Consideraciones éticas: la confidencialidad de los pacientes se llevó a cabo mediante una codificación alfanumérica. En ningún momento se divulgó el nombre o alguna característica que podría identificar a los mismos.
RESULTADOS
Ingresaron al estudio 70 sujetos, 35 con complicaciones (casos) y 35 que no desarrollaron complicaciones (controles).
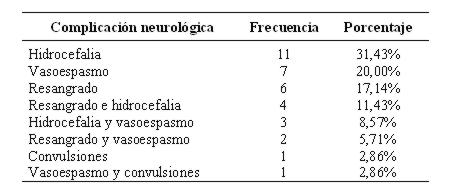
La complicación más frecuente en los casos fue la hidrocefalia (31%). No se detectó hiponatremia (ver tabla 5).
Tabla 5: Complicaciones neurológicas en hemorragia subaracnoidea (n 35)
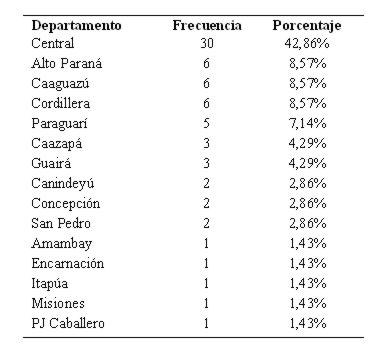
De los casos la edad media fue de 53±11 años y de los controles fue 50±13 años (p 0,6 prueba Kruskall Wallis). Con respecto al sexo se observó un predominio del sexo femenino, correspondiendo 23 mujeres (65%), tanto en los casos como en los controles, con una relación mujer:varón 1,85:1, no hallándose una diferencia significativa entre ambos grupos OR 1 (IC 95% 0,3-2,6 p=1 prueba Chi2). La mayoría (43%) procedía del Departamento Central (ver tabla 6).
Tabla 6:Procedencia de los pacientes con hemorragia subaracnoidea (n 70)
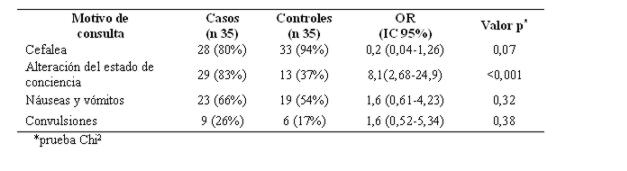
Entre los motivos de consulta predominó la presencia de cefalea en el 94% (33) de los controles y en el 80% (28) de los casos. (ver tabla 7).
Tabla 7: Motivos de consulta más frecuente en pacientes con hemorragia subaracnoidea
El retraso a la consulta desde el evento hasta su ingreso fue de 2±2 días para los casos y de 4±3 días para los controles (p 0,03). En los días de internación no hubo diferencia significativa entre los dos grupos, siendo de 29±22 días para los casos y de 25±14 días para los controles (p 0,6).
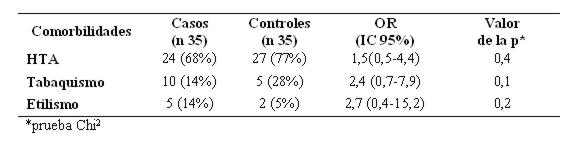
La hipertensión arterial fue el antecedente patológico más frecuente en toda la muestra (73%), distribuyéndose de manera similar en ambos grupos, resultando un factor de riesgo pero no significativo. De igual forma, el antecedente de tabaquismo y etilismo estuvieron presentes en el 21% y 10% respectivamente del total de pacientes (n=70), constituyendo un riesgo pero no significativo (ver tabla 8).
Tabla 8: Antecedentes patológicos personales en hemorragia subaracnoidea
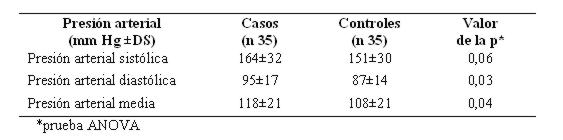
La presión arterial sistólica tuvo una tendencia superior en los casos, no siendo significativa. En cambio hubo una diferencia significativa en relación con la presión arterial diastólica (ver tabla 9).
Tabla 9: Cifras de presión arterial sistólica y diastólica en hemorragia subaracnoidea
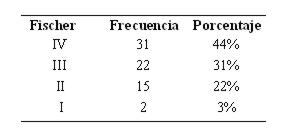
Del total de pacientes, predominó al ingreso el Fisher IV, seguido del Fisher III (ver tabla 10).
Tabla 10: Distribución según escala de Fisher (n 70)
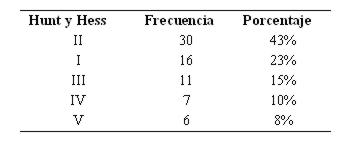
Teniendo en cuenta la escala de Hunt y Hess, predominó el grado II (ver tabla 11).
Tabla 11: Distribución según escala de Hunt y Hess (n 70)
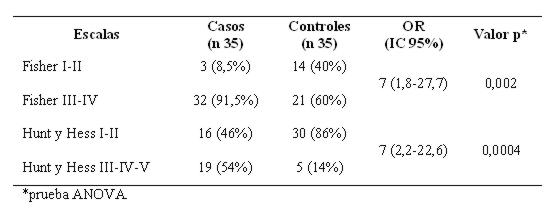
Agrupando el Fisher en bajo grado (I-II) y en alto grado (III-IV), se encontró un riesgo elevado en éste último grupo constituyendo uno de los principales factores de riesgo. De igual modo agrupando el Hunt y Hess en dos grandes grupos I-II por un lado y III-IV-V por otro, se halló también un riesgo elevado y muy significativo (ver tabla 12).
Tabla 12: Distribución según escalas de Fisher y Hunt y Hess en bajo y alto grado
Con respecto al Glasgow Coma Scale de ingreso hubo un puntaje 11±3 para los casos y de 14±1 para los controles (p 0,0003).
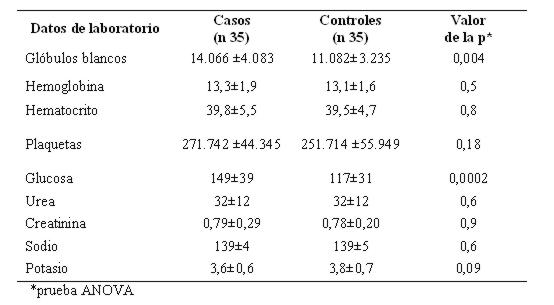
Teniendo en cuenta los datos de laboratorio de rutina realizados al ingreso, se observó en el hemograma que el número de glóbulos blancos fue superior en los casos, siendo significativo este hallazgo. No hubo diferencia significativa en los valores de hemoglobina, hematocrito, plaquetas, urea, creatinina y electrolitos. Llamó la atención la glicemia más elevada en los casos que en los controles (ver tabla 13).
Tabla 13: Valores de laboratorio al ingreso en pacientes con hemorragia subaracnoidea
En 55 pacientes (79%) se realizó arteriografía, y en un 5 (7%) se realizó angio-TAC. Se hallaron aneurismas en 32 sujetos (53%) (ver tabla 14).
Tabla 14: Hallazgos en arteriografía y angiotomografía (n 60)
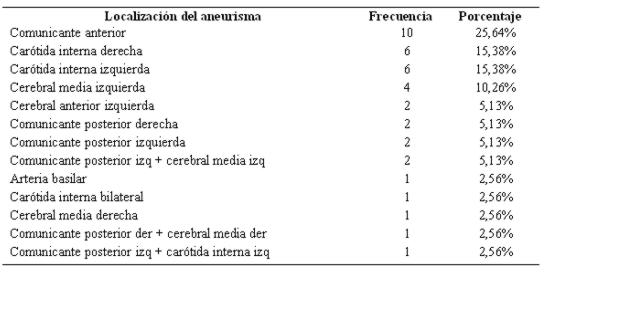
De los 39 aneurismas hallados, 29 fueron de la circulación anterior, estando en primer lugar los de la arteria comunicante anterior, seguidos de la carótida interna derecha e izquierda respectivamente. Nueve aneurismas fueron de la circulación posterior, predominando los de la arteria comunicante posterior. Cinco casos tuvieron aneurismas múltiples, de los cuales 4 pertenecían a la circulación posterior y 1 a la circulación anterior (ver tabla 15).
Tabla 15: Localización de los aneurismas en orden de frecuencia (n 39)
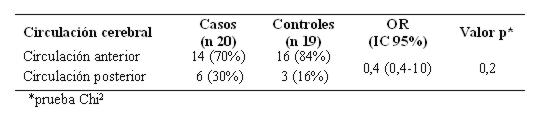
Comparando los aneurismas de la circulación anterior y de la circulación posterior hubo un riesgo relativo no significativo (ver tabla 16).
Tabla 16: Aneurismas de la circulación anterior y de la circulación posterior (n 39)
DISCUSION
La edad de presentación más frecuente en la HSA según los reportes mundiales es alrededor de los 55 años, que no difiere de la de este estudio, 53 años de los casos y 50 años de los controles13.
Se aprecia una mayor incidencia en mujeres (1,85 veces) en concordancia con 1,6 y 4,5 veces encontrados en la literatura3,7,10.
El cuadro clínico se caracterizó por un predominio de cefalea y alteración del estado de conciencia, acompañados de náuseas y/o vómitos además de convulsiones en forma variable. Entre estos síntomas, la alteración del estado de conciencia tuvo un valor muy significativo como factor de riesgo para el desarrollo de complicaciones. De hecho, el deterioro cognitivo forma parte algunas escalas de evaluación neurológica inicial aplicadas en la clínica de estos pacientes5,14.
El retraso a la consulta desde el evento hasta el ingreso fue ligeramente superior en los controles, esto pudiera deberse al peor estado general de los casos que requirió su traslado en forma más temprana. Si bien la cefalea se halló en más del 80% de estos pacientes, los vómitos sólo se presentaron en alrededor del 50%. La ausencia de vómitos como señal de alarma asociada a una cefalea podría haber retraso la consulta de muchos de ellos. Este aspecto debería investigarse pues la población podría desconocer los síntomas relacionados a los accidentes vasculares cerebrales, de modo a consultar precozmente39,40.
En los días de internación no hubo diferencia significativa entre los dos grupos (>25 días). Esta estancia prolongada se debe a problemas logísticos, sumado a problemas económicos ya que la arteriografía cerebral no se realiza actualmente en este hospital y se debe recurrir al sector privado con el coste que esto implica. Otra causa de la prolongada estancia hospitalaria es el retraso en la consulta de estos pacientes, lo que obliga a esperar que mejore el edema cerebral antes de la realización de los estudios invasivos diagnósticos41.
El antecedente de HTA es un factor de riesgo para HSA pero menos crucial que para otros tipos de accidente cerebrovascular. La prevalencia de HTA en los pacientes con HSA es superior que en la población general7. En este estudio fue el antecedente patológico más frecuente (73%), distribuyéndose de manera similar en ambos grupos, constituyendo un factor de riesgo importante pero no significativo. La presión arterial sistólica tuvo una tendencia superior en los casos, no siendo significativa. En cambio hubo una diferencia significativa en relación con la presión arterial diastólica y en la presión arterial media. Estos resultados podrían deberse a una descarga adrenérgica producida en el momento del evento y que podría ser directamente proporcional con el grado clínico según la Escala de Fisher o de Hunt y Hess14,23.
El antecedente de tabaquismo es un factor de riesgo independiente y el factor de riesgo más importante para HSA, que ha sido documentada en varios estudios de cohorte y de casos-controles.3 En contraste con otros estudios, el 21% hallado en esta investigación podría deberse al hecho que muchos sujetos minimizan este vicio o lo ocultan. El rol del alcohol es un factor de riesgo para HSA pero que no ha sido establecido tan bien como el de tabaquismo. Sólo el 10% presentaba antecedente de etilismo, resultando un factor de riesgo no significativo. Sería recomendable aumentar el tamaño de muestra para determinar el verdadero valor de estos dos factores de riesgo en nuestra población42,43.
La escala de Fisher, basada en la cantidad y distribución de la hemorragia, ayuda a predecir el riesgo de vasoespasmo18. En este análisis fue una buena herramienta para predecir el riesgo de complicaciones en general y no sólo de vasoespasmo, que fue mayor en los pacientes con Fisher III-IV. La escala de Hunt-Hess permite cuantificar la gravedad del estado clínico14, aumentando significativamente el riesgo de complicaciones en pacientes con Hunt-Hess III-IV-V en comparación con los que ingresan con Hunt-Hess I-II. Así también la escala de coma de Glasgow fue un buen indicador de riesgo muy significativo para el desarrollo de complicaciones15.
En el análisis de laboratorio de rutina que se realiza a todos los pacientes que ingresan al servicio (hemograma, glicemia, perfil renal y electrolitos) se pudo evidenciar que el número de glóbulos blancos fue superior en los casos, siendo significativo este hallazgo. Además llamó la atención la glicemia más elevada en los casos, que pudiera deberse a elevaciones transitorias de glicemia por estrés, ya que sólo 3 pacientes eran conocidos diabéticos. Debería medirse la hemoglobina HbA1c para observar si los mismos ya se hallaban con trastornos metabólicos previos al ingreso. Estos datos deberían ser estudiados en muestras más grandes, para poder determinar si pueden usarse como marcadores pronósticos o de riesgo42,43.
El diagnóstico etiológico principal por arteriografía fue el de aneurismas (64%), predominando los de la circulación anterior. No hubo datos en este estudio que indiquen que la localización del aneurisma sea un factor de riesgo10,11.
Llama la atención que esta serie no se encontró casos con hiponatremia. Las afecciones agudas del sistema nerviosos central, como los accidentes vasculares cerebrales y traumatismos de cráneo, producen alteraciones en la homeostasis del sodio. La hiponatremia se presenta en 30-40% de las HSA. Existen diversos mecanismos involucrados, pudiendo llevar a síndrome de secreción inadecuada de ADH como al cerebro perdedor de sal44. Este hallazgo debería estudiarse a más profundidad en nuestra población institucional.
CONCLUSIONES
La edad media de los casos fue de 53 ± 11 años y de los controles fue 50 ± 13 años. Predominó el sexo femenino con una relación 1,85:1. La mayoría procedía del Departamento Central.
La cefalea fue el motivo de consulta principal y la alteración del estado de conciencia fue el dato más significativo en relación al desarrollo de complicaciones.
La internación se caracterizó por una estadía prolongada principalmente a problemas logísticos en la realización de los estudios angiográficos.
La hipertensión arterial fue el antecedente patológico más frecuente. El tabaquismo y etilismo estuvieron presentes en un porcentaje bajo. Las cifras de presión arterial fueron superiores en los casos.
La hidrocefalia fue la complicación neurológica más común (31%). La localización del aneurisma no tuvo relación con el desarrollo de complicaciones, en cambio las escalas de Glasgow, Fisher, Hunt-Hess demostraron ser importantes indicadores pronósticos.
El hallazgo significativo de cifras elevadas de glóbulos blancos y de glicemia en los casos debería estudiarse en ensayos más grandes para determinar la importancia de los mismos.
REFERENCIAS
1. Murillo Cabezas F, Muñoz Sánchez MA. Protocolo diagnóstico de la hemorragia subaracnoidea. Medicine. 2007; 9(73):4705-4707. [ Links ]
2. Vivancos J, Gilo F, Frutos R, Maestre J, García-Pastor A, Quintana F et al. Clinical management guidelines for subarachnoid haemorrhage. Diagnosis and treatment. Neurologia. 2012 Oct 6. pii: S0213-4853(12)00249-6. [ Links ]
3. Connolly ES Jr, Rabinstein AA, Carhuapoma JR, Derdeyn CP, Dion J, Higashida RT et al. Guidelines for the management of aneurysmal subarachnoid hemorrhage: a guideline for healthcare professionals from the American Heart Association/american Stroke Association. Stroke. 2012 Jun; 43(6): 1711-37. [ Links ]
4. Martínez-Mañas R, Ibáñez G, Macho J, Gastón F, Ferrer E. A study of 234 patients with subarachnoid hemorrhage of aneurysmic and cryptogenic origin. Neurocirugia (Astur). 2002 Jun; 13(3): 181-93 [ Links ]
5. de Rooij NK, Linn FH, van der Plas JA, Algra A, Rinkel GJ. Incidence of subarachnoid haemorrhage: a systematic review with emphasis on region, age, gender and time trends. J NeurolNeurosurgPsychiatry. 2007 Dec; 78(12): 1365-72. [ Links ]
6. Shea AM, Reed SD, Curtis LH, Alexander MJ, Villani JJ, Schulman KA. Characteristics of nontraumatic subarachnoid hemorrhage in the United States in 2003. Neurosurgery. 2007 Dec; 61(6): 1131-7. [ Links ]
7. Steiner T, Juvela S, Unterberg A, Jung C, Forsting M, Rinkel G; European Stroke Organization. European Stroke Organization guidelines for the management of intracranial aneurysms and subarachnoid haemorrhage. CerebrovascDis. 2013; 35(2): 93-112. [ Links ]
8. Ruigrok YM, Buskens E, Rinkel GJ. Attributable risk of common and rare determinants of subarachnoid hemorrhage. Stroke. 2001 May; 32(5): 1173-5. [ Links ]
9. Aoki T, Nishimura M. Targeting chronic inflammation in cerebral aneurysms: focusing on NF-kappaB as a putative target of medical therapy. ExpertOpinTher Targets. 2010 Mar; 14(3): 265-73. [ Links ]
10. Feigin VL, Rinkel GJ, Lawes CM, Algra A, Bennett DA, van Gijn J, Anderson CS. Risk factors for subarachnoid hemorrhage: an updated systematic review of epidemiological studies. Stroke. 2005 Dec; 36(12): 2773-80. [ Links ]
11. Piñero González P, Gutiérrez Jarrí I, MayolDeyáb A, González García A. Hemorragia subaracnoidea. Otras malformaciones arteriales. Medicine. 2007; 9(73): 4656-4663. [ Links ]
12. Beck J, Raabe A, Szelenyi A, Berkefeld J, Gerlach R, Setzer M, Seifert V. Sentinel headache and the risk of rebleeding after aneurysmal subarachnoid hemorrhage. Stroke. 2006 Nov; 37(11): 2733-7. [ Links ]
13. Lagares A, Gómez PA, Alén JF, Arikan F, Sarabia R, Horcajadas A et al. Aneurysmal subarachnoid hemorrhage: group of study of cerebrovascular pathology of the Spanish society of neurosurgery management guideline. Neurocirugia (Astur). 2011 Apr; 22(2): 93-115. [ Links ]
14. Degen LA, DorhoutMees SM, Algra A, Rinkel GJ. Interobserver variability of grading scales for aneurysmal subarachnoid hemorrhage. Stroke. 2011 Jun; 42(6): 1546-9. [ Links ]
15. Rodríguez-Yáñez M, Castellanos M, Freijo MM, López Fernández JC, Martí-Fábregas J, Nombela F et al. Clinicalpracticeguidelines in intracerebralhaemorrhage. Neurologia. 2013 May; 28(4): 236-49. [ Links ]
16. vanHeuven AW, DorhoutMees SM, Algra A, Rinkel GJ. Validation of a prognostic subarachnoid hemorrhage grading scale derived directly from the Glasgow Coma Scale. Stroke. 2008 Apr; 39(4): 1347-8.
17. Ohkuma H, Tsurutani H, Suzuki S. Incidence and significance of early aneurysmal rebleeding before neurosurgical or neurological management. Stroke. 2001 May; 32(5): 1176-80. [ Links ]
18. Scherle-Matamoros CE1, Pérez-Nellar J, Fernández-Cue L. Symptomaticvasospasm. Clinicalmanifestations. Neurocirugia (Astur). 2011 Apr; 22(2): 116-22.
19. Sanelli PC, Anumula N, Gold R, Elias E, Johnson C, Comunale J, Tsiouris AJ, Segal AZ. Outcomes-based assessment of a new reference standard for delayed cerebral ischemia related to vasospasm in aneurysmal subarachnoid hemorrhage. AcadRadiol. 2012 Sep; 19(9): 1066-74. [ Links ]
20. DorhoutMees SM, Rinkel GJ, Feigin VL, Algra A, van den Bergh WM, Vermeulen M, van Gijn J. Calcium antagonists for aneurysmal subarachnoid haemorrhage. Cochrane DatabaseSyst Rev. 2007 Jul 18; (3): CD000277. [ Links ]
21. Dhar R, Diringer M. Statins and anti-inflammatory therapies for subarachnoid hemorrhage. Curr Treat Options Neurol. 2012 Apr; 14(2): 164-74. [ Links ]
22. Vergouwen MD, Meijers JC, Geskus RB, Coert BA, Horn J, Stroes ES, van der Poll T, Vermeulen M, Roos YB. Biologic effects of simvastatin in patients with aneurysmal subarachnoid hemorrhage: a double-blind, placebo-controlled randomized trial. J CerebBloodFlowMetab. 2009 Aug; 29(8): 1444-53. [ Links ]
23. Wang X, Li YM, Li WQ, Huang CG, Lu YC, Hou LJ. Effect of clazosentan in patients with aneurysmal subarachnoid hemorrhage: a meta-analysis of randomized controlled trials. PLoSOne. 2012; 7(10): e47778. [ Links ]
24. Degos V, Gourraud PA, Tursis VT, Whelan R, Colonne C, Korinek AM et al. Elderly age as a prognostic marker of 1-year poor outcome for subarachnoid hemorrhage patients through its interaction with admission hydrocephalus. Anesthesiology. 2012 Dec;117(6):1289-99. [ Links ]
25. Chwajol M, Hage ZA, Amin-Hanjani S, Charbel FT. Extracranial aneurysms of the distal posterior inferior cerebellar artery: Resection and primary reanastomosis as the preferred management approach. SurgNeurol Int. 2013 Nov 22; 4: 150. [ Links ]
26. Wunsch H, Gershengorn H, Mayer SA, Claassen J. The effect of window rooms on critically ill patients with subarachnoid hemorrhage admitted to intensive care. CritCare. 2011; 15(2): R81. [ Links ]
27. Hellingman CA, van den Bergh WM, Beijer IS, van Dijk GW, Algra A, van Gijn J, Rinkel GJ. Risk of rebleeding after treatment of acute hydrocephalus in patients with aneurysmal subarachnoid hemorrhage. Stroke. 2007 Jan; 38(1): 96-9. [ Links ]
28. Claassen J, Peery S, Kreiter KT, Hirsch LJ, Du EY, Connolly ES, Mayer SA. Predictors and clinical impact of epilepsy after subarachnoid hemorrhage. Neurology. 2003 Jan 28; 60(2): 208-14. [ Links ]
29. Choi KS, Chun HJ, Yi HJ, Ko Y, Kim YS, Kim JM. Seizures and Epilepsy following Aneurysmal Subarachnoid Hemorrhage : Incidence and Risk Factors. J KoreanNeurosurg Soc. 2009 Aug; 46(2): 93-8. [ Links ]
30. Chandy D, Sy R, Aronow WS, Lee WN, Maguire G, Murali R. Hyponatremia and cerebrovascular spasm in aneurysmal subarachnoid hemorrhage. Neurol India. 2006 Sep; 54(3): 273-5. [ Links ]
31. Corradetti V, Esposito P, Rampino T, Gregorini M, Libetta C, Bosio F et al. Multiple electrolyte disorders in a neurosurgical patient: solving the rebus. BMC Nephrol. 2013 Jul 10; 14: 140. [ Links ]
32. Katayama Y, Haraoka J, Hirabayashi H, Kawamata T, Kawamoto K, Kitahara T et al. A randomized controlled trial of hydrocortisone against hyponatremia in patients with aneurysmal subarachnoid hemorrhage. Stroke. 2007 Aug; 38(8): 2373-5. [ Links ]
33. Wong GK, Poon WS, Chan MT, Boet R, Gin T, Lam CW. The effect of intravenous magnesium sulfate infusion on serum levels of sodium and potassium in patients with aneurysmal subarachnoid hemorrhage. Magnes Res. 2007 Mar; 20(1): 37-42. [ Links ]
34. van der Bilt IA, Hasan D, Vandertop WP, Wilde AA, Algra A, Visser FC, Rinkel GJ. Impact of cardiac complications on outcome after aneurysmal subarachnoid hemorrhage: a meta-analysis. Neurology. 2009 Feb 17; 72(7): 635-42. [ Links ]
35. Hravnak M, Frangiskakis JM, Crago EA, Chang Y, Tanabe M, Gorcsan J 3rd, Horowitz MB. Elevated cardiac troponin I and relationship to persistence of electrocardiographic and echocardiographic abnormalities after aneurysmal subarachnoid hemorrhage. Stroke. 2009 Nov; 40(11): 3478-84. [ Links ]
36. Junttila E1, Vaara M, Koskenkari J, Ohtonen P, Karttunen A, Raatikainen P, Ala-Kokko T. Repolarization abnormalities in patients with subarachnoid and intracerebral hemorrhage: predisposing factors and association with outcome. AnesthAnalg. 2013 Jan; 116(1): 190-7.
37. Lord AS, Fernandez L, Schmidt JM, Mayer SA, Claassen J, Lee K, Connolly ES, Badjatia N. Effect of rebleeding on the course and incidence of vasospasm after subarachnoid hemorrhage. Neurology. 2012 Jan 3;v78(1):v31-7. [ Links ]
38. Larsen CC, Eskesen V, Hauerberg J, Olesen C, Romner B, Astrup J. Considerable delay in diagnosis and acute management of subarachnoid haemorrhage. Dan Med Bull. 2010 Apr; 57(4): A4139. [ Links ]
39. Tedim Cruz V, Araújo I, Alves I, Magano A, Coutinho P. Freeze the stroke: public awareness program for immediate detection of first symptoms. Stroke. 2012 Sep; 43(9): 2510-2. [ Links ]
40. Das K1, Mondal GP, Dutta AK, Mukherjee B, Mukherjee BB. Awareness of warning symptoms and risk factors of stroke in the general population and in survivors stroke. J ClinNeurosci. 2007 Jan; 14(1): 12-6.
41. R Germans M, Hoogmoed J, van Straaten HA, Coert BA, Peter Vandertop W, Verbaan D. Time intervals from aneurysmal subarachnoid hemorrhage to treatment and factors contributing to delay. J Neurol. 2014 Mar; 261(3): 473-9. [ Links ]
42. Slark J, Sharma P. Risk awareness in secondary stroke prevention: a review of the literature. JRSM CardiovascDis. 2014 Feb 4;3:2048004013514737. [ Links ]
43. Etminan N, Beseoglu K, Barrow DL, Bederson J, Brown RD Jr, Connolly ES Jr et al. Multidisciplinary Consensus on Assessment of Unruptured Intracranial Aneurysms: Proposal of an International Research Group. Stroke. 2014 Mar 25. [ Links ]
44. Tellería-Díaz A. Hiponatremia en hemorragia subaracnoidea. RevNeurol 2001; 35(8): 800 [ Links ]
1. Departamento de Medicina Interna. Hospital Nacional. Ministerio de Salud Pública y Bienestar Social (Itauguá, Paraguay)
Correo electrónico: ealn006@gmail.com
Artículo recibido: 25 febrero 2014. Artículo aceptado: 24 de abril de 2014