Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista del Instituto de Medicina Tropical
versión impresa ISSN 1996-3696
Rev. Inst. Med. Trop. v.5 n.2 Asunción dic. 2010
CASO CLINICO
Coccidioidomicosis diseminada como primera manifestación de SIDA en un paciente que reside en un área no endémica.
Disseminated Coccidioidomycosis as the First Manifestation of AIDS in a Patient who Resides in a Non-Endemic Area
*Dra. Cristina Alarcón, Dr. Miguel Ángel Cardozo.
Servicio de Infectología de Adultos. Instituto de Medicina Tropical
Background: From 1987, disseminated coccidioidomycosis is one of the AIDS-defining illnesses. Since then, the reported prevalence has ranged from 0.2 to 0.3% in AIDS patients from endemic areas, a proportion similar to that seen in people without HIV infection,however, in patients with impaired immune function, the infection presented in a more severe, with mortality exceeding 60% despite the diagnosis and treatment. A report of a patient with coccidioidomycosis and infection by human immunodeficiency virus (HIV), residing in a non-endemic area, in which disseminated coccidioidomycosis presented reactivation of the infection and was the initial manifestation of AIDS.
Key words: immune function, diagnosis, treatment
Resumen
A partir de 1987 la Coccidioidomicosis diseminada es una de las enfermedades definitorias de SIDA. Desde entonces la prevalencia informada ha oscilado entre 0.2 a 0.3 % en pacientes con SIDA provenientes de áreas endémicas, proporción similar a la observada en personas sin infección por el Virus de la Inmunodeficiencia Humana (VIH); sin embargo, en los pacientes con alteración de la función inmune la infección se presenta en una forma más severa, con mortalidad mayor a 60% a pesar del diagnóstico y tratamiento oportunos.
Se informa de un paciente con Coccidioidomicosis e infección por VIH residente en un área no endémica, en el cual la Coccidioidomicosis diseminada se presentó como reactivación de la infección y constituyó la manifestación inicial de SIDA.
Palabras claves: funcion inmune, diagnóstico, tratamiento.
Introducción
La infección fúngica sistémica sigue siendo, la enfermedad infecciosa que produce mayor tasa de mortalidad, su incidencia se ha incrementado en los últimos años debido básicamente al incremento del uso de fármacos inmunosupresores, al incremento del número de trasplante de órganos sólidos, a la epidemia del SIDA, al tratamiento agresivo de la enfermedad hematológica maligna. La Coccidioidomicosis frecuentemente resultan en enfermedad crónica recidivante, lo que representa un reto terapéutico a los medicamentos disponibles actualmente, en los pacientes con infección de VIH-SIDA se presenta la forma grave, tiene una a alta mortalidad a pesar del diagnostico y tratamiento oportunos (1).
Presentación del caso clínico
Paciente masculino de 41 años de edad, de ocupación policía, heterosexual residente en Asunción, no conocido portador de VIH, ingresó al hospital de infectología IMT, acude por un cuadro clínico de 2 meses de evolución de sensación febril precedida de escalofríos con sudoración profusa de predominio nocturno, intermitente, más disnea progresiva, tos seca esporádica y cefalea ocasional. Un mes antes: hiperoxia, astenia marcada, disnea en reposo, pérdida de peso de 7kg.Cuatro días antes consultó por epigastralgia, se solicitó ELISA p/VIH y trae 3 esputos para BAAR (-).
Como antecedentes patológicos: Diabético postpancreatitis desde hace 3 años en tratamiento con insulina Mixtard ® En el 2008 estuvo trabajando en el chaco: Neuland y Filadelfia (Mcal. Estigarribia), donde habría ingerido talcal, por las tormentas de arena.
En la exploración física. PA: 110-70 FC: 100x´ FR: 40x´ Tax: 39ºC.
Aspecto general: Paciente adulto normosómico, normolineo, eutrófico, polipneico, facies pálida y ansiosa, impresiona portador de patología crónica agudizada. Tórax: con formación normal, tiraje supraesternal. Vibraciones vocales conservadas. Ap. Respiratorio: Murmullo ventricular conservado, no rales, ni ruidos agregados. Ap. Cardiovascular: Ruidos cardiacostaquicárdicos, normofonéticos, no soplos ni galope. Abdomen: ligeramente globuloso, blando, depreciable, no doloroso, hígado a 2 cm RCD, RHA (+).
SNC: Glasgow: 15/15, no se registraron signos de focalización neurológica, ni signos meníngeos, ROT presentes, pupilas ICRS, pares craneales conservados.
Piel y faneras: palidez (++), pápulas en rostro. Ganglios: no se palpa Diagnóstico de ingreso:
1. SIDA a confirmar.
2. Sindrome febril Prolongado.
3. Neumopatía de etiología a determinar.
4. Sindrome. Anémico.
5. Deshidratación al 5%
6. Diabetes mellitus post pancreatitis.
7. Mollusco contagioso.
Estudios realizados:
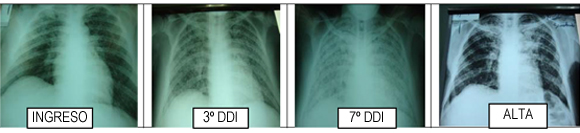
ELISA para VIH positivo; HBVags (-); HCV (-); IFI para Chagas y leishmania: negativos; Toxoplasma IgG: (+) y 3 Esputos para BAAR: negativos. La radiografía de tórax mostró opacidad con patrón retículo nodulillar difuso bilateral.
Evolución en Sala: El paciente se encontró febril los dos primeros días de internación por lo que se inició TMP/SMX (160-800), a dosis plena para cubrir neumocistosis, se agregó prednisona por insuficiencia respiratoria PO2 38, en el 2º DDI: Se inició tratamiento para antibacilares y Anfotericina B por el empeoramiento clínico y radiológico, se recibió antigenemia para CMV (+), y se indicóGanciclovir pero por falta de medicación no se inició, recibimos CD4:49 células, CV: 529.080 copias del 3/02/10. Se inició D4T+3TC + NVP.
En el 7º DDI se recibió dos esputos para hongos en donde se observaron esférulas compatibles con Coccidiodes immitis. Se decidió continuar con el tratamiento con Anfotericina B; HMC para hongos, serología para Paracoccidiodomicosis y látex para antígenos capsulares negativos, 4 esputos para BAAR (-).
Se suspendió la medicación anti bacilar, y se continuó con el tratamiento para neumocistosis hasta el día 21, se suspendió NVP y se rotó a indinavir-ritonavir, por rash en tronco y extremidades.
Del día 22 al 40 de internación (DDI) el paciente continuópresentando fiebre de 38ºC matutinos, persistió la disnea, con tos productiva, expectoración mucosa. Se inició ganciclovir indicado la semana previa. Se tomó 2 Hemocultivos (HMC), debido a los picos febriles de38º - 39ºC con escalofríos, persistieron la disnea y la tos, se retiróla vía venosa central (VVC) por halo eritematoso alrededor del catéter, se cultivó la misma y se inició Vancomicina. De las muestras de HMC y punta de catéter se aisló Bacilos Gram (-), por lo que se agregó ceftazidima más amikacina al tratamiento.
El resultado final del cultivo de punta de cateter fue el aislamiento de E. coli sensible a ceftazidima, ciprofloxacina y en retrocultivo Staphylococcus coagulasa negativa, se suspendió tratamiento con vancomicina y se continuó con ceftazidima, amikacina y Anfotericina B (1.500mg), sin mejoría clínica ni radiológica, se agregó fluconazol 800mg. Se planteó Equinocandina, en asociación al triazol. Se realizó PAMO, en el contexto de cuadro infeccioso no resuelto (Síndrome Febril Prolongado), por sospecha de funguemia, anemia persistente, cuyo resultado informó: normocelular, no se observan parásitos ni hongos. Se indicó fibrobroncoscopia con BAL y biopsia contraindicado por el neumólogo.
En su 41º DDI a pesar de recibir 1.850 mg de Anfotericina B, 7 días de fluconazol 800mg/día, 12 días de ganciclovir, siguió febril, disneico, se reinició nuevamente HRZE más claritromicina por sospecha de TBC vs. MAC, se rotó I\R a EFV por inicio de antibacilares, Rx. de tórax sin cambios, patrón reticulonodulillar.
Se realizó eco cardiograma trans toráxico que informó fracción de eyección 70%, válvulas cardiacas sin alteraciones no se observaron vegetaciones.
Se reinició tratamiento con corticoides (por sospecha de SIRI) y TMP/SMX (sospecha de Coccidioides) y se suspendió Anfotericina B por completar 2.500mg. Se recibió resultados de 3 esputos para hongos y 12 esputos para BAAR negativos. El paciente presentó con mejoría del cuadro clínico y radiológico sin episodios de fiebre.
Se planteó el cultivo del Coccidiodes, para fungograma y ver la sensibilidad al fluconazol, Anfotericina B y TMP/SMX, no realizado en el laboratorio central por bioseguridad. Se completó 21 días de tratamiento con ganciclovir.
Al 61 DDI: presenta nuevamente picos febriles cuando se suspendió el tratamiento con corticoides, siguió con TMP/SMX.
Los resultados de perfil colagénico fueron, C3: 163 C4: 168. ANA anti-DNA negativos, CD4: 20 CV: 40 copias del (20/03/10).TAC tórax con patrón retículo-nodulillar, fibrosis pulmonar, no se evidenció adenopatías en tórax ni abdomen. Luego de 71 DDI fue dado de alta con corticoides, en el contexto de SIRI y con Fluconazol 400mg/día. Al momento del control ambulatorio se recibió resultado de esputo (+) compatibles con esférulas de Coccidiodes sp.
En el hospital día de nuestra institución se reinició tratamiento con Anfotericina B 100 mg tres veces por semana. El día 17 de mayo: Se recibió resultado de análisis de esputo con esférulas compatibles con Coccidiodes sp. Y 1.200 mg de Anfotericina B. Se suspendió fluconazol y rotó a Itraconazol 400mg/día. Al día siguiente refirió sentirse mejor, afebril, sin tos. Acudió para profilaxis con Anfotericina B 50mg semanal recibió además corticoides e ibuprofeno.
Diagnósticos finales
1. SIDA C3
2. Coccidioides pulmonar y diseminada
3. TB pulmonar cs. MAC probable en 2do mes de tratamiento antibacilar
4. Neumocistis por CMV probable
5. Pneumocystocis pulmonar probable
6. Sepsis a punto de partida del cateter a E. coli.
7. Anemia normocítica normocrómica
8. Mollusco contagioso
9. Diabetes mellitus post pancreatitis
10. Desnutrición calórica proteica severa
11. Sindrome de Recosntitución inmune temprano a Coccidioides sp.
Rx. de torax
Marco teórico
La coccidioidomicosis es una micosis sistémica endémica exclusiva del continente americano, producida por dos hongos dimorfos Coccidioides immitis y Coccidioides posadasii (2).
La fase saprobia de estos microorganismos se desarrolla en la tiera de las áreas endémicas y la infección de los seres humanos, así como de varias especies de animales, se produce por vía inhalatoria (3).
La evolución clínica de estas infecciones es sumamente variable y depende de la carga infectante (cantidad de esporos inhalados) y de la capacidad de la respuesta inmune mediada por células T CD4 + del huésped para generar una respuesta de citoquinas de tipo Th1 que controle la infección.
La mayor parte de las infecciones son asintomáticas o sub-clínicas, pero los casos clínicos progresivos, que representan el 1 a 2/1.000 de las infecciones, pueden llegar a originar procesos graves de evolución fatal.
Mientras que en el hospedero inmunocompetente la mayoría de las veces la Coccidioidomicosis cursa en forma sub-clínica, en el inmunocomprometido como es el caso de los pacientes con SIDA puede cursar con lesiones extensas que involucren riñones, bazo, ganglios linfáticos, cerebro, tiroides, a diferencia de lo que habitualmente ocurre en pacientes sanos o con inmunocompromiso de otro origen.
En los primeros años de la epidemia de SIDA se informó que la incidencia de Coccidioidomicosis en esos pacientes era mucho mayor que en la población general; no obstante, estudios más recientes indican que como enfermedad definitoria de SIDA se observa solo en 0,3%. Para los pacientes con SIDA el riesgo de adquirir la infeccion coccidioidal en el área endémica es de 2,7%, similar a la tasa anual de adquisición de esta infección. La diferencia es en la mayor mortalidad, que continúa siendo elevada aún con tratamiento adecuado y en numerosas ocasiones la Coccidioidomicosis en pacientes con SIDA es el resultado de la reactivación del hongo. La infección puede acompañarse de fiebre y disnea, en forma similar a la neumonía por Pneumocistis jirovesi, una de las infecciones más comunes en los pacientes con SIDA; ambas se presentan con mayor frecuencia cuando el número de linfocitos CD4+ es menor de 200/mm3. Por ello, es necesario considerar las dos enfermedades en el diagnóstico diferencial de pacientes que residen en áreas endémicas o bien, con antecedentes de residencia en dichos lugares.
Hasta en 40% de los casos el infiltrado reticulonodular difuso es visible en la radiografía de tórax, pero también puede observarse como imágenes nodulares con infiltrados en placas o incluso como cavidades.
En el paciente referido el diagnóstico inicial se llevó a cabo a partir del análisis de la muestra obtenida por esputo. El diagnóstico de certeza no se estableció, no se pudo cultivar.
Dado que el SIDA produce deterioro importante de la inmunidad celular más evidente en estadios avanzados de la enfermedad podría esperarse que los pacientes que radican en zonas endémicas tengan una alta incidencia de Coccidioidomicosis diseminada, sin embargo, existe escaso número de informes en los que se describa dicha entidad en individuos con SIDA, menor aún tratándose de pacientes que radican fuera de un área endémica.
Manifestaciones clínicas
Neumonía persistente: evolución crónica por años, produce cavidades y fibrosis, similar a la tuberculosis fibrocavitaria que se puede reactivar en el contexto de la inmunosupresión. Intersticiopatía reticulonoludillar, con fiebre, eosinofilia, elevación de la fosfatasa alcalina. Forma de mal pronóstico, se presenta en pacientes inmunodeficientes y tiene alta tasa de mortalidad.
Los casos diseminados representan alrededor del 1%, se encuentran con mayor frecuencia en pacientes africanos, norteamericanos, mexicanos y filipinos.
Predominan en el género masculino usualmente, en un contexto de inmunosupresión. Afectan comunmente la piel, las meninges y huesos, así como sitios menos comunes como la glándula tiroides, la conjuntiva y el pericardio. Se han informado lesiones osteolíticas con reacción perióstica, abscesos fríos, empiemas, fistulas toracostales, neumonías y formas miliares.
Diagnóstico
El diagnóstico de laboratorio consiste en la observación microscópica del hongo de esférulas, endosporas y/o macroscópicamente, la obtención de cultivo en medio de Saboreau dextrosa agar a partir de los productos patológicos. La utilidad de los hemocultivos mediante técnica de centrifugación lisis ha sido comprobada para las formas graves. La serología es una herramienta de gran utilidad para el diagnóstico. Los estudios anatomopatológi-cos, la observación de esférulas y endosporas también es diagnóstica.
Tratamiento
A) Primo-infección sintomática: habitual-mente no requiere tratamiento.
Se tratan:
Pacientes infectados con gran inóculo, inmunocomprometidos en general. Embarazo, neumonía muy extensa. La droga de elección es el Fluconazol o Itraconazol 400mg/día durante 3 meses.
En embarazadas el tratamiento consiste en Anfotericina B 0,7mg/kg/día hasta 600 u 800 mg. Las reacciones de hipersensibilidad (eritema nodoso o multiforme, artritis o pleuresía) usar AINES más triazoles. Coccidiodoma sólo extirpar en caso de duda no requiere tratamiento post-quirúrgico.
B) Cavidad de aspecto quístico:
No se trata salvo
1. Cuando persiste más de dos años.
2. Produce hemoptisis o aumenta de diámetro
o presenta un nivel líquido o está muy vecina a la pleura. El tratamiento de elección es la resección quirúrgica, precedida y seguida de fluconazol 400mg/día, por un lapso total de 10 a 12 meses.
C) Neumonía persistente o forma fibrocavitaria similar a TBC excavada, tratamiento con Itraconazol 400mg/día durante 12 meses, fluconazol en igual dosis y lapso (algo menos eficaz).
Anfotericina B: sólo en caso de fracaso o intolerancia a azoles, o por posibles interacciones medicamentosas, hasta completar 40mg/kg peso.
D) Forma diseminada crónica sin compromiso del SNC, estudios realizados demostraron que el tratamiento con Itraconazol fue superior al fluconazol en las lesiones óseas, produjo menos recidivas y mejorías más rápidas.
Eficacia 65% dosis diaria y lapso de aplicación igual a la forma pulmonar crónica excavada.
E) Compromiso Meningoencefálico: Alta tasa de mortalidad 90% en un año y 100% en dos años, sin tratamiento.
El tratamiento de elección es Fluconazol 800mg/día hasta la remisión de la sintomatología + Anfotericina B intratecal con una duración de 6 meses, frecuencia 1-2 veces/sem. Para evitar recidivas mantener fluconazol 400mg/día durante toda la vida y aplicar AMB 1 vez cada 15 días.
Alternativas al tratamiento: AMB-L 3-4 mg/kg/día o Voriconazol 400mg/día (este tratamiento tiene escasa experiencia y alto costo)
F) Forma diseminada Aguda: Iniciar siempre Anfotericina B, hasta completar 2-3 g, como dosis total. En PVVS hacer profilaxis secundaria con Itraconazol 400mg/día, hasta comprobar 2 recuentos de CD4 mayor a 200 cel./ml. En caso de intolerancia al Itraconazol o fluconazol indicar Anfotericina B 50mg 2 veces/sem en hospital día.
Otras drogas útiles son el Voriconazol y Posaconazol, existen casos aislados tratados con éxito y Caspofungina. En un ensayo clínico abierto con itraconazol en pacientes con Coccidioidomicosis progresiva no meníngea, se obtuvo remisión en el 57% de los casos; el 16% de éstos presentó recaída (4). En un estudio similar con fluconazol, se reportó una respuesta satisfactoria en el 67% de los casos; sin embargo, el 37% de los pacientes sometidos a seguimiento después de suspender el tratamiento presentó recaída (5).
Un ensayo clínico aleatorizado, doble ciego, se comparó la eficacia del Itraconazol vs. fluconazol en pacientes con Coccidioidomicosis progresiva no meníngea (6).
Se logró obtener una respuesta favorable en el 57% de los pacientes tratados con fluconazol vs. 72% de los pacientes con itraconazol (p = 0,05).
La tasa de recaída después de suspender el tratamiento fue de 28% en el grupo de fluconazol vs 18% en el grupo de itraconazol p=NS) (7).
Profilaxis en pacientes trasplantados el riesgo de desarrollar Coccidioidomicosis en pacientes trasplantados en áreas endémicas es entre 4 y 9%, dentro del primer año después del trasplante suele ser diseminada y con alto riesgo de mortalidad.
Se ha propuesto profilaxis selectiva con fluconazol en sujetos con serología positiva antes del trasplante o historia de Coccidioidomicosis.
Manejo de los pacientes con infección por VIH1.
Antes de la introducción de la TARGA la citomegalovirus (CM) era la infección oportunista más importante en el área endémica de Estados Unidos. La incidencia de la CM clínicamente aparente a raíz del TARGA ha disminuido.
Se recomienda tratamiento para todos los pacientes infectados por VIH con CM clínicamente activa. Parece razonable suspender la terapia en aquellos pacientes con linfocitos CD4+ mayores de 250 células/μL en quienes exista evidencia clínica de que la infección se ha controlado (excepto en pacientes con meningitis que requerirán tratamiento de por vida) (8).
La prevención de la CM en pacientes infectados con VIH–1 que residen en una región endémica con un régimen a base de antimicóticos, no suele ser efectiva. A pesar de que se ha investigado al respecto durante años, aún no se cuenta con una vacuna clínicamente útil para prevenir esta enfermedad.
Conclusión
Se debe considerar el diagnóstico de Coccidiodes sp. en aquellos pacientes con malestar general, fiebre, síntomas respiratorios y que vivan o que hayan viajado a áreas endémicas. El diagnóstico se puede establecer mediante estudios serológicos, histopatológico, microbiológico.
El tratamiento con los nuevos anti fúngicos debe considerarse y sigue siendo un reto terapéutico sobre todo en el paciente con infección VIH-SIDA.
Bibliografía.
1. Laniado-Laborin, R. Coccidioidomicosis. Más que una enfermedad regional. Revinstnalenfrespmex volumen 19 - número 4 octubre-diciembre 2006 páginas: 301-308. [ Links ]
2. Moroyoqui Navarro, L.A. Figueroa Sauceda, S.R. MedIntMex 2008; 24(2):125-41 [ Links ]
3. Avilés-Salas, A. Quintero-Cuadra, Y. Cornejo, P. Coccidioidomicosis extrapulmonar. Presentación de un caso y revisión de la literatura Rev Chil Infect 2007; 24 (5): 398-401 [ Links ]
4. Laniado-Laborin, R. Coccidioidomicosis. Más que una enfermedad regional. Rev instnalen fresp mex volumen 19 - número 4 octubre-diciembre 2006 páginas: 301-308Mandell 5º edición. [ Links ]
5. Enfermedades infecciosas VIH-SIDA de Benetucci.
6. Mateos Garcia, E. Gaytan Martínez, J.E. Casanova, L.J. Fuentes Allen, J.L. Coccidioidomicosis diseminada: manifestación inicial de SIDA en residente de área no endémica. Rev Med IMSS (Mex) 2000; Volumen 38(6): 433-436 [ Links ]
7. Negroni, R. Revista Argentina de Microbiología (2008) 40: [ Links ] _____________________
*Solicitud de Sobretiros:
Dr. Gustavo Benítez
Servicio de Infectología Adultos
Instituto de Medicina Tropical
Asunción, Paraguay
gbenite@yahoo.com.ar














