INTRODUCCION
El examen bioquímico de orina es un recurso invaluable y olvidado dentro de la práctica clínica rutinaria, incluso para los nefrólogos 1. Por décadas los clínicos han empleado el estudio del sedimento urinario para caracterizar manifestaciones renales de enfermedades sistémicas, así como las enfermedades primarias del riñón; la longevidad y rutinario de este examen ha generado fallas en la estandarización del mismo 2. En los últimos años se ha presentado un crecimiento en la compresión y desarrollo del análisis de orina como elemento de seguimiento de respuesta terapéutica y factor pronostico.
El análisis del sedimento urinario es una de las pruebas más solicitadas en la práctica médica y se ha comprobado su valor clínico para detectar daño o alteraciones en la función renal 3-5. No obstante, en pacientes ingresados en la unidad de cuidados intensivo (UCI) este estudio no se realiza de manera frecuente dado que algunos de sus valores dependen del balance entre factores como: estado hemodinámico, filtración glomerular, excreción tubular, reabsorción de agua y solutos además del equilibrio acido-base, los cuales pueden variar significativamente en pacientes en estado crítico con diferentes condiciones fisiopatológicas 6. Nos proponemos analizar aspectos relevantes del urianálisis a emplear en la práctica clínica rutinaria del intensivista.
Aspectos técnicos básicos y utilidad clínica
El análisis microscópico de la orina parte de una muestra adecuada, que debe estar acompañada por una recolección, transporte y preparación estandarizada 7. Dentro de los problemas a considerar en esta fase inicial de evaluación del examen de orina se incluyen un almacenamiento incorrecto, tiempo inadecuado para procesamiento de las muestras, volumen de orina centrifugada, fuerza de centrifugación y volumen de sedimento que pueden afectar la precisión de los resultados 7. Los modernos equipos de análisis de orina automatizados, eliminan los pasos de preparación manual e integran tiras reactivas con recuento celular automatizado 7.
En esta prueba se realiza el análisis químico (pH, glucosa, urobilinógeno entre otros), análisis físico (color, aspecto) además del análisis microscópico del sedimento urinario (SU) en busca de elementos formes (eritrocitos, leucocitos, bacterias, cilindros) 6. Si bien es una prueba considerada de rutina es de suma importancia su adecuada interpretación en la toma de decisiones en la práctica clínica rutinaria. El urianálisis es un método accesible y económico, dada la facilidad de obtener muestras y en la rápida determinación de componentes químicos con el empleo de tiras reactivas. Proveen a menudo una rápida información diagnóstica sobre hematuria, proteinuria o cilindros patológicos que pueden confirmar o excluir un diagnóstico de enfermedad renal o del tracto urinario inferior. Es utilizado para predecir, diagnosticar o evaluar la respuesta al tratamiento en pacientes con algún grado de nefropatía 8.
Por otro lado, el urianalisis es comúnmente evaluado en pacientes hospitalizados sin un diagnóstico apropiado. En pacientes en UCI, un registro de más de 99 millones de muestras urinarias, condujo a evaluaciones de microhematuria asintomática, con incrementos en costos y morbilidad asociada a estudios inadecuados (4). Es necesario evaluar indicaciones más precisas para el estudio del citoquímico urinario en cuidados intensivos 4.
Es necesario hacer una aproximación a los distintos aspectos analizados e informados en el citoquimico urinario, estos incluyen el pH urinario, densidad urinaria, proteinuria, albuminuria, glucosa, urobilinógeno, bilirrubinas, marcadores infecciosos, leucocitos, hematíes entre otros. Se ofrece una descripción más detallada en los siguientes apartados, Tabla 1. Dentro de estos, elementos como la hematuria son de interés en el abordaje de condiciones como las enfermedades glomerulares con un espectro amplio de presentaciones. Un grupo importante de ellas son aquellas que se caracterizan por la presencia de hematuria. La hematuria definida como la presencia de glóbulos rojos en la orina, habitualmente cuantificados como > 3 glóbulos rojos por campo de alta potencia 7. Las lesiones patológicas renales o en el tracto urinario pueden generar la presencia de hematuria intermitente o permanente 7. Los orígenes descritos de la hematuria, generalmente permiten clasificarla en aquella de origen glomerular versus urológica, estando presentes unas amplias condiciones en el paciente en estado crítico 7. Por lo tanto, resulta de interés para el intensivista conocer los diferentes elementos y oportunidades diagnósticas derivadas de un adecuado análisis del citoquímico urinario.
Tabla 1. El uroanálisis en el paciente críticamente enfermo. >: mayor; <: menor: (+): positivo; (-) negativo
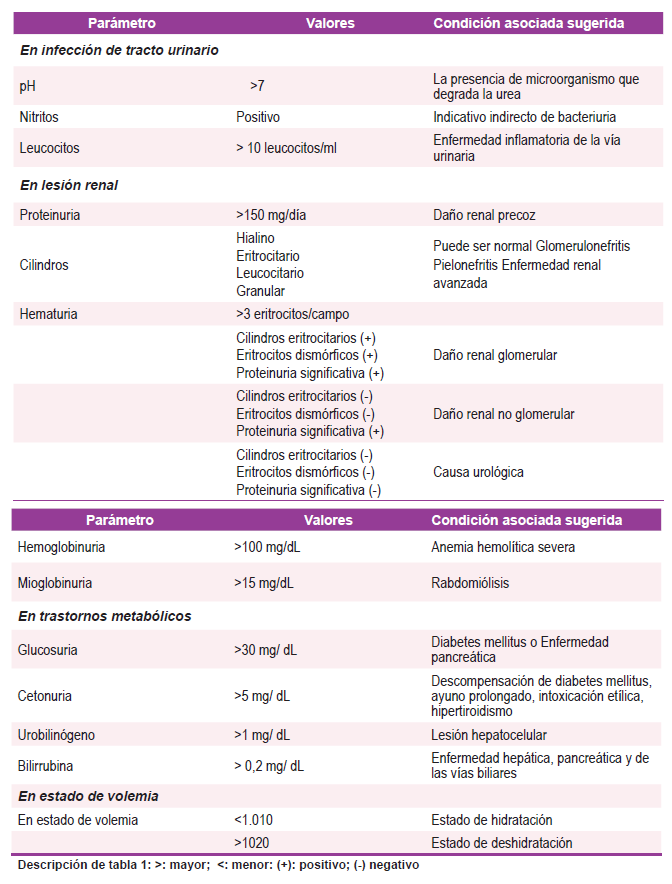
Infección del tracto urinario
Las infecciones del tracto urinario, están entre las causas más comunes de infecciones asociadas a la atención en salud, 70-80% están asociadas a la utilización de catéter urinario 9. En escenario del paciente críticamente enfermo es habitual el empleo de catéter urinario, especialmente aquellos con requerimiento de asistencia ventilatoria invasiva, con el objetivo de vigilar balances de líquidos y aliviar la congestión vesical 9.
Estos pacientes por sus condiciones no presentan las manifestaciones clásicas, por lo que se espera el reporte de urocultivo para inicio de terapia antibiótica, lo que expone al paciente a inicio tardío de tratamiento, por lo que con frecuencia se confía en el análisis de orina para predecir el crecimiento del urocultivo y para el inicio temprano de antibióticos 10.
Se ha investigado la utilidad del análisis del citoquímico urinario para predecir un urocultivo positivo y en efecto en el contexto clínico adecuado la necesidad de manejo antibiótico. Esta evidencia deriva principalmente de estudios por fuera de cuidados intensivos mostrando una sensibilidad para la esterasa leucocitaria del 50 al 97% y especificidad del 41 al 86%. Los nitritos ofrecen una especificidad del 92 al 100% con pobre sensibilidad del 19 al 48%. Adicionalmente, la piuria (>5 células blancas por campo de alta potencia) cuenta con una alta sensibilidad 94 al 100% y pobre especificidad 47% al 50%. Estudios limitados han abordado la utilidad de este examen para orientar el uso de antibióticos y predecir la posibilidad de un urocultivo positivo 10.
En un estudio de cohorte retrospectivo se analizaron los datos de análisis de orina y cultivos de 169 pacientes consecutivos admitidos a UCI, todos los pacientes tenían colocado un catéter urinario en el momento del ingreso, obteniendo como resultado que La esterasa leucocitaria y la piuria fueron los indicadores más sensibles de un urocultivo positivo con un 87,5 % (IC 95 %: 71,3-100 %) y un 73,3 % (IC 95 %: 51,0-95,7 %), respectivamente; el nitrito en orina fue específico al 100%. por ende, La combinación de esterasa leucocitaria y nitrito de orina proporciona el mejor indicador para el inicio de la cobertura antibiótica para la infección del tracto urinario antes de la disponibilidad del cultivo 10. Por ello, el estudio adecuado del citoquímico de orina podría ser un recurso valioso para orientar el tratamiento antimicrobiano en pacientes en cuidados intensivos.
Sepsis y choque séptico
La sepsis es una condición frecuente en cuidados intensivos, se asocia a incremento de mortalidad y se han desarrollado diferentes estrategias para orientar su tratamiento 11,12. Una condición asociada con frecuencia al desarrollo de sepsis es la presencia de lesión renal aguda, por ello su detección e intervención temprana resulta relevante 13. Existen diferentes pruebas bioquímicas urinarias que se han descrito como subrogados de LRA en la práctica clínica incluyen sodio urinario (UNa), fracción excretada de sodio (FENa) y excreción fraccionada de urea (FeU) 14. No obstante, estos marcadores han demostrado limitaciones y rendimiento diagnóstico para entender la etiología y gravedad de la LRA en pacientes en cuidados intensivos 14.
En este sentido, un estudio de cohorte prospectivo, evaluó 83 pacientes admitidos a UCI, de los cuales 43 tenían diagnóstico de sepsis (51.8%). Los perfiles bioquímicos urinarios no lograron discriminar entre lesión renal aguda asociada o no a sepsis, tanto el sodio en orina, la fracción excretada de sodio o fracción excretada de urea no permitieron establecer pronóstico, empeoramiento de la lesión renal aguda, requerimiento de terapia de reemplazo renal o mortalidad, sugiriendo limitaciones para su uso rutinario en UCI 15.
La fisiopatología de la LRA en sepsis es compleja, un estudio orientado a evaluar los parámetros involucrados en la caída del filtrado glomerular y su valor predictivo para discriminar entre LRA transitoria e intrínseca. Incluyó 107 pacientes con sepsis, evaluó el rendimiento de la FENa, FeU y la proteína asociada a la gelatinasa de neutrófilos (NGAL) en la admisión, 4 y 24 horas. Encontrando que una baja FENa (<1%) y FeU (<35) son altamente prevalentes (77.3% y 63.2% respectivamente) en la primera hora de sepsis. La oliguria se comportó como un marcador más temprano de desarrollo de LRA por encima del incremento de la creatinina. De este estudio se logra extraer que un FENa alto y FeU alto acompañan a una LRA intrínseca, mientras una FENa y FeU bajos son fuertes predictores de LRA transitoria jugando un papel pronóstico en pacientes con sepsis que desarrollan disfunción renal aguda 16.
No obstante, la evidencia es controversial. Un estudio multicéntrico, que incluyó pacientes de 3 unidades de cuidados intensivos, con una población total de 203 pacientes, divididos en tres grupos pacientes sin LRA (67 pacientes), LRA transitoria (54 pacientes) y LRA persistente (82 pacientes), siendo la mayoría pacientes con diagnóstico de sepsis (62.2%, 61.1% y 74.4% respectivamente). En este trabajo la FeU mostro poca utilidad para distinguir entre LRA transitoria de la persistente (AUC 0.59, IC95% 0.49-0.70; p=0.06), incluyendo pacientes que recibían diuréticos 17.
Un metaanálisis, que incluyo 19 estudios con una población total de 1287 pacientes con LRA buscó evaluar la utilidad del FENa para orientar diagnósticos diferenciales de lesión renal aguda. Presentando una limitada utilidad en pacientes con enfermedad renal crónica previa o utilización de terapia con diuréticos, por ello este parece un recurso que amerita estudios adicionales que nos permitan discernir su lugar en la toma decisiones en el paciente en estado crítico 18.
Hay interés en otros biomarcadores en orina que permitan hacer seguimiento y detección temprana de la evolución de la LRA en pacientes con condiciones patológicas diversas, como la sepsis 19,20. En este sentido, y considerando la importancia de las vías del complemento en el curso de la respuesta inmune en pacientes con sepsis, los niveles de C3 urinario parecen tener un comportamiento de reactante de fase aguda inversa, que podría jugar un rol pronóstico y de seguimiento en pacientes con sepsis 20. No obstante, se requieren estudios que permitan identificar un rol preciso del citoquímico urinario en pacientes con sepsis, más allá de su relevancia en predecir y hacer seguimiento de pacientes con LRA, como se comenta en el siguiente apartado.
Lesión Renal Aguda (LRA)
La aproximación diagnóstica de los pacientes con lesión renal aguda (LRA), depende de una serie de elementos que incluyen una historia clínica precisa, cambios hemodinámicos, exposición a fármacos o tóxicos, registro de diuresis, balance de líquidos, comportamiento y tendencia en la evolución de los valores de creatinina y el análisis de la orina, este ultimo de nuestro interés 1,21.
La LRA, se asocia a un incremento de la mortalidad y peor pronóstico, el sedimento urinario puede ser útil en pacientes hospitalizados y en UCI para detectarla de forma precoz 2,13,22,23.
Se han desarrollado una serie de biomarcadores diagnósticos que permiten una detección temprana de pacientes con LRA; sin embargo, su utilidad está limitada por los costos y disponibilidad asociados a los mismos, es en este escenario que el análisis del citoquímico urinario podría significar una alternativa válida 24. En este sentido, la observación precisa de la morfología de las células urinarias, la identificación de cilindros celulares y no celulares y el reconocimiento de varios cristales endógenos y relacionados con fármacos pueden permitir un diagnóstico rápido de la enfermedad renal aguda o crónica, por lo que este estudio se ha visto como la "biopsia líquida" no invasiva 1.
La etiología de la LRA es variable en pacientes en estado crítico, desde el punto de vista fisiopatológico predomina la necrosis tubular aguda (NTA), asociándose en menor proporción otras condiciones como enfermedades glomerulares, vasculares e intersticiales agudas y obstrucción urinaria 25. Diferentes elementos del sedimento urinario han sido evaluados en el estudio de pacientes con LRA incluyendo sodio urinario, fracción excretada de sodio, cilindros urinarios entre otros.
Un estudio transversal que incluyó muestras de orina fresca de 231 pacientes quienes fueron sometidos a un sistema de puntuación basado en el número de cilindros granulares y RTEC (renal tubular epitelial cells) vistos por campo de alta potencia para diferenciar NTA de LRA prerrenal (1 punto : Células RTE 0 y moldes granulares 0; 2 puntos: Células RTE 0 y coladas granulares 1 a 5 o células RTE 1 a 5 y coladas granulares 0; 3 puntos: Células RTE 1 a 5 y coladas granulares 1 a 5 o células RTE 0 y coladas granulares 6 a 10 o células RTE 6 a 20 y coladas granulares 0), determinaron que una puntuación ≥ 2 junto con un diagnóstico previo a la microscopía de necrosis tubular tuvo un valor predictivo positivo del 100 % para el diagnóstico final de necrosis tubular. Por el contrario, un diagnóstico previo a la microscopía de LRA prerrenal con una puntuación de 1 (ausencia de RTEC o cilindros granulares en la microscopía) tuvo un valor predictivo negativo del 91 %. Con el uso de microscopía manual, el 23 % de los pacientes con diagnóstico premicroscópico de LRA prerrenal cambiaron posteriormente a un diagnóstico de NTA, y el 14 %, de NTA a LRA prerrenal. Esto nos muestra que el examen del sedimento urinario es una valiosa herramienta diagnóstica para confirmar el diagnóstico de NTA. Una puntuación de ≥2 en un sistema de puntuación de sedimento urinario es un predictor extremadamente fuerte de NTA 5.
En ese mismo año se realizó la publicación de un estudio piloto, el cual contó con 30 pacientes, en el que se utilizó un índice de puntuación de cilindro granular simplificado para evaluar los resultados renales en pacientes con un diagnóstico clínico de NTA ( Grado 1: Sin cilindros o RTE; Grado 2: Al menos un cilindro o RTE pero <10 % de LPF (campo de baja potencia (x10), por sus siglas en ingles); Grado 3: Muchos cilindros o RTE (entre 10 % y 90 % de LPF); Grado 4: Hoja de cilindros marrón fangoso y RTE en >90 % de LPF). De los 18 pacientes con NTA en los que se evaluaron los resultados del sedimento urinario, el 61,1 % no recuperó la función renal y el índice de puntuación promedio fue de 2,2. Los pacientes sin recuperación renal tuvieron un índice de puntuación de cilindros más alto en comparación con los pacientes que recuperaron la función renal (2,55 ± 0,93 frente a 1,57 ± 0,79; P = 0,04) 23.
En el año 2010 se realizó un estudio prospectivo con 197 pacientes con Acute Kindey Injury o LRA (AKI) que fueron estratificados por AKI Network (AKIN), 80 pacientes (40%) tenían estadio 1, 53 (27%) estadio 2 y 66 (33%) estadio 3 de LRA. Las puntuaciones combinadas del sedimento urinario fueron más bajas en aquellos con LRA en etapa 1 y más altas en la etapa 3 de LRA. Setenta y nueve pacientes (40%) experimentaron un empeoramiento del AKI desde el momento de la consulta. El sistema de puntuación urinaria se asoció significativamente con un mayor riesgo de empeoramiento de la LRA 26.
Por lo cual, el sistema de puntuación de microscopía de orina no solo tiene utilidad diagnóstica, sino que también mantiene el valor pronóstico para resultados clínicos relevantes (necesidad de diálisis intrahospitalaria o muerte intrahospitalaria), para predecir el empeoramiento de la LRA debido a necrosis tubular aguda o LRA prerrenal durante la hospitalización 26, sin embargo, estas escalas pronosticas no han sido ampliamente validadas y la evidencia es limitada con respecto a la utilidad en pacientes críticamente enfermos con LRA 8.
Una de las principales limitaciones del uso del sedimento urinario en LRA es que generalmente se realiza tardíamente cuando la LRA ya está establecida, lo cual reduce su utilidad para la identificación y prevención de la LRA 2. Por otro lado, estudios han indicado que la presencia de un uroanálisis no alterado en un paciente con LRA no descarta complicaciones o pobre pronóstico a largo plazo 27. Algunos autores han sugerido que esta limitación se debe a la variabilidad inter observador para identificar sedimentos urinarios 28.
Por otro lado, dentro de la aproximación y prevención temprana de la aparición de LRA, el uso de biomarcadores ha sido un recurso en crecimiento. No obstante, limitado por su disponibilidad y costos; en este sentido, un estudio que incluyó una población de 125 voluntarios sanos y 363 pacientes admitidos por urgencias, el análisis de la muestra de orina por microscopia mostró una especificidad del 90% y sensibilidad del 22%, con un área under the curve o área bajo la curva (AUC) de 0.57 para predecir la aparición de LRA, esto podría complementarse con la eventual medición de biomarcadores en muestra de orina al azar 29.
Más recientemente, evidencia derivada de la pandemia por SARS COV-2, sugiere la utilidad del urianálisis como marcador diagnóstico y progresión a LRA, hallazgos como la presencia de proteinuria, hematuria y leucocituria por encima de los marcadores séricos habituales. Dentro de los pacientes con LRA, el 54.2% presentaron las alteraciones descritas en el citoquímico urinario, por ello se sugiere que su uso rutinario tendría un impacto pronóstico en el seguimiento de estos pacientes 30. En consecuencia, el citoquímico urinario en pacientes con LRA ofrece elementos diagnósticos temprano de bajo costo, disponibilidad, seguimiento y pronóstico en pacientes hospitalizados y en cuidados intensivos.
Trastornos hidroelectrolíticos y electrolitos en orina
La evaluación y seguimiento de electrolitos en orina, generalmente se refiere al monitoreo del sodio, potasio y cloro 6. No es una medición rutinaria en cuidados intensivos, debido a que sus valores pueden ser influenciados por el balance entre el filtrado glomerular, secreción tubular y reabsorción de agua y solutos, condiciones que varían ampliamente en distintos estados fisiopatológicos presentes en UCI 6. El seguimiento de estos marcadores en orina puede ser especialmente útil en condiciones en las cuales se altera el equilibrio acido-básico, balance de fluidos o de los electrolitos séricos 6.
La concentración urinaria de sodio (UNa, urinary sodium concentration) es un buen marcador del sodio corporal total, en el contexto de un riñón normal y sin drogas que alteren su absorción. La hiponatremia solo puede ocurrir si hay anormalidades en la dilución urinaria normal, si la retención de sodio está comprometida o si el ingreso de fluidos sobrepasa la capacidad renal de excretar agua libre de electrolitos. La hiponatremia se clasifica con base en la osmolaridad plasmática y el estado de volemia; es aquí donde la osmolaridad urinaria y la UNa juegan un papel importante para facilitar dicho proceso, dado que ayudan a calcular el aclaramiento de agua libre (FWC) y el aclaramiento libre de electrolitos (EFWC). Estos últimos se han propuestos como predictores del efecto de la alteración de la excreción de agua libre en la concentración sérica de sodio. Por otro lado, la fracción excretada de sodio) FENa juega un rol fundamental en la hiponatremia hipovolémica, ya que generalmente se encuentra <1% y es >1% cuando hay perdidas renales de sodio 6,31.
En este sentido un UNa bajo puede comportarse como un elemento pronóstico en pacientes en estado crítico, siendo un signo de alerta temprana para el deterioro de la función renal, incluso en pacientes con creatinina normal 32,33. Un estudio con 113 pacientes, de los cuales 67.3% presentaba LRA, esta condición se asoció a incremento en los valores de fosfato, aniones no medidos-Strong Ion Gap (SIG), disminución de albumina, y en la orina disminución en los valores de sodio (UNa), cloro (CIU) al igual que una diferencia de iones fuertes alta en orina (SIDu). Estos hallazgos pueden preceder el desarrollado de LRA, siendo de interés, su seguimiento incluso desde la admisión a UCI 34. En general, en pacientes en UCI reciben grandes aportes de sodio de diferentes fuentes, estrategias actuales están orientadas a reducir esta carga hidrosalina en el paciente crítico 35. Por lo tanto, lo esperado es encontrar niveles altos de UNa durante la estancia en cuidados intensivos. El seguimiento del sodio urinario ha sido evaluado demostrando utilidad en escenarios como falla cardiaca, síndrome hepatorrenal y condiciones frecuentes como la LRA, por ello es fundamental considerarlo dentro de la revisión de las muestras de orina obtenidas de pacientes en UCI 34,36,37.
En cuanto al potasio urinario, el gradiente transtubular de potasio (TTKG) refleja la cantidad de potasio excretado en orina, lo cual es importante en el estudio de la hipokalemia. Valores >4 reflejarían perdida renal de potasio, mientras que, valores <3 sugieren causas extrarenales de hipokalemia. Sin embargo, puede tener limitaciones cuando el sodio urinario es bajo (UNa <25 meq/L), dado que disminuye la excreción de potasio y debido a la cantidad de urea reabsorbida a diario. El índice potasio urinario/creatinina (UK) podría ser útil en pacientes con hipovolemia, siendo valores >13 mEq/g sugerentes de perdidas renales y valores <13 mEq/g probablemente por pérdidas extrarenales.
En el paciente con hiperkalemia, el índice UK/creatinina es útil para determinar si la causa es debida a movimientos intracelulares del potasio, siendo que valores >200 mEq/g sugerirían una respuesta renal adecuada y valores <200 mEq/g indicarían que la causa se debe a movimientos intracelulares del potasio 6,31.
En pacientes en estado crítico, el seguimiento del potasio urinario es una herramienta que se ha evaluado como factor pronóstico, terapéutico y abordaje de la LRA. Un estudio de cohorte prospectivo, que incluyo 61 pacientes en UCI, evaluó el potasio excretado en orina y su correlación con el aclaramiento de creatinina. Encontrando, que la excreción urinaria de potasio se correlacionó linealmente con el aclaramiento de creatinina (Coeficiente de correlación: 0.58, IC95% 0.38-0.72, p=0.001), con una capacidad moderada para predecir la aparición de LRA (AUC 0.747, IC95% 0.62-0.85, p=0.001), especialmente en pacientes que no reciben furosemida. En consecuencia, la medición de la excreción de potasio en orina podría ser una alternativa de duración reducida y menos costos para hacer seguimiento de la función renal en el paciente en UCI, ameritando estudios adicionales en este sentido 38. Un estudio de cohorte prospectivo, más reciente, que evaluó excreción urinaria de potasio (UrK) (AUC 0.809, IC95% 0.719-0.899, p <0.05) y su asociación con LRA y con el aclaramiento de creatinina en comparación con métodos tradicionales, ha mostrado resultados prometedores 39.
Por otro lado, las concentraciones de cloro urinario han ganado interés dada la asociación de la hipercloremia con incremento de mortalidad y aumento de la incidencia de LRA en UCI, y por lo tanto desarrollar estrategias orientadas a la vigilancia del mismo son relevantes 40,41. Un estudio observacional retrospectivo, con 116 pacientes consecutivos en UCI, la medición en el primer día de sodio y potasio tanto en orina como sérico no mostraron diferencias entre supervivientes y no supervivientes (p= 0.25 y 0.45 respectivamente) 42. En cuanto al cloro urinario las concentraciones al primer día fueron significativamente más bajos en los no supervivientes con respecto a los supervivientes (36 [20 - 48] vs 65 [24 - 110] mEq/L, p = 0.039). Encontrándose que un cloro urinario de 53 mEq/L, evidencio una AUC 0.67; 95%CI [0.53, 0.78] para predecir mortalidad en cuidados intensivos 42. En consecuencia, la medición y seguimiento de electrolitos en orina resulta de interés como valor pronóstico y futuras indicaciones terapéuticas en el paciente en estado crítico.
Trastornos acido base
El estudio bioquímico urinario puede ser útil en la evaluación de la acidosis metabólica hiperclorémica (HCMA, hyperchloremic metabolic acidosis). La HCMA ocurre por pérdidas directas de NaHCO3, a través del tracto gastrointestinal en pacientes con diarrea, pérdidas urinarias en fases agudas de patologías que causen acidosis tubular renal proximal (pRTA, proximal renal tubular acidosis) o por pérdidas indirectas de NaHCO3, ya sea por sobreproducción de un ácido y excreción aumentada de aniones en la orina o por baja excreción urinaria de NH4+ 31. Para hacer el diagnóstico diferencial de la HCMA, se evalúa la velocidad de excreción del NH4+, la cual se encuentra elevada en los pacientes con pérdidas gastrointestinales y sobreproducción de ácido, por otro lado, se espera que esté disminuida en pacientes con RTA distal. Dado que este último biomarcador no está ampliamente disponible, se han propuesto otros marcadores indirectos para estimar la excreción de NH4+, dentro de los cuales destaca el pH urinario, el cual tiende a ser bajo (acido) por la excreción distal de hidrogeniones (H+), un pH urinario de aproximadamente 5 sugiere una baja producción de NH4+ y un pH > 6 sugiere un defecto en la absorción de HCO3- o un defecto en la excreción de H+; No obstante, algunos autores consideran que no es un marcador confiable dado que puede haber un retraso antes de que la producción de NH4+ aumente 31. Otros métodos han sido estudiados para estimar la velocidad de excreción del NH4+ como la brecha aniónica urinaria (U Anión gap) y la brecha de osmolalidad urinaria (U osmolal gap), siendo la última la más precisa 6,31.
Volemia efectiva circulante
El volumen efectivo de sangre circulante (ECV, effective circulating volumen) se ha usado para describir la parte del volumen intravascular que afecta la perfusión orgánica. En caso de que el ECV disminuya, la respuesta fisiológica del cuerpo es aumentar la resistencia vascular periférica, lo cual se traduce a nivel renal en disminución del UNa y aumento de la excreción urinaria de potasio. Por otro lado, cuando hay expansión del ECV, ocurre lo contrario. Por todo lo anterior, se ha propuesto que el UNa y el índice sodio/potasio urinario podrían considerarse marcadores indirectos del estado de volemia, de hecho, estudios sugieren que un UK > UNa es un indicador preciso de hipovolemia; no obstante, en diferentes estados como la vasodilatación, pro-inflamación, diuresis osmótica y necrosis tubular aguda, podría alterar los valores de estos marcadores independientemente de la volemia, es por esto que toma utilidad la fracción excretada de sodio (FENa), esta es cercana al 1% en paciente euvolémicos con función renal conservada y en caso de que haya hipoperfusión tisular, esta caería a <1%. Un UNa bajo (<40 mEq/L o menor que el UK) indica que ambos riñones se encuentran bajo un estímulo de retención de sodio, lo cual indica hipovolemia. No obstante, el uso de la FENa podría verse limitado en casos de falla renal (sepsis, nefritis intersticial, nefropatía de contraste, hemolisis y rabdomiólisis) 6,31.
Falla cardiaca aguda
La insuficiencia cardiaca (IC) es una condición frecuente que puede motivar el ingreso a cuidados intensivos, predominando los síntomas de bajo gasto o congestión sistémica, en este último, los diuréticos y la respuesta a los mismos son la piedra angular del tratamiento. Por ello, el monitoreo de la diuresis y el sodio urinario resultan de interés para guiar la terapia diurética y la evaluar la resistencia a los mismos. Algunas propuestas terapéuticas han planteado que el hallazgo de un sodio urinario <50 mmol/l o una diuresis <150 ml/hora a las 2 horas de administrado el diurético de asa puede indicar una respuesta inadecuada y la posibilidad de evaluar una dosis adicional del fármaco. Estos ajustes se pueden realizar de manera seriada hasta corregir los signos congestivos y obtener una respuesta natriurética adecuada 43.
Otros aportes del citoquímico urinario en IC, incluye la evaluación de cilindros urinarios lo cual ha demostrado utilidad para el diagnóstico e identificación de lesión renal aguda en escenario de insuficiencia cardiaca aguda (ICA), siendo una alternativa de bajo costo a los denominados nuevos biomarcadores de LRA 44. Un estudio que incluyó 114 pacientes con falla cardiaca aguda, de los cuales 40(35%) desarrollaron LRA durante su estancia hospitalaria, logrando identificar cilindros urinarios en 30 pacientes (26%) dentro del grupo que presento LRA (OR 2.80, IC95% 1.04-7.49; p=0.041), apareciendo hasta 5 días antes de cumplir criterios para LRA 44. Estos hallazgos soportan la creciente utilidad que podría aportar un examen rutinario y de fácil acceso como lo es un adecuado citoquímico urinario.
En general, la mayoría de cilindros celulares generalmente se asocian o presentan en pacientes con necrosis tubular aguda (NTA), en menor medida en aquellos con lesiones intersticiales 5. Trabajos de seguimiento de la presencia de cilindros urinarios en pacientes con ICA han demostrado que estos pacientes pueden presentar lesiones que afectan el parénquima renal e incluyen compromiso tubular, glomerular y vascular. No obstante, la LRA en pacientes con ICA es multifactorial y por ello la ausencia de cilindros urinarios en el citoquímico no descarta el diagnóstico, pero su presencia en falla cardiaca podría estar relacionado además con congestión venosa y activación del sistema renina angiotensina aldosterona 44.
CONCLUSION
El examen bioquímico de orina es un recurso útil, incluso para los nefrólogos. Es utilizado con más frecuencia en pacientes no críticos ya sea en la sospecha u estudio inicial y el enfoque de las enfermedades renales, se otorga importancia al sedimento urinario y/o a la presencia de proteínas en orina.
Actualmente hay una mejor compresión y un mejor procesamiento del análisis de orina, y se puede utilizar como elemento de seguimiento, de respuesta terapéutica y de factor pronóstico.
En el paciente crítico está infrautilizado, y no se realiza de manera frecuente dado que algunos de sus valores dependen del balance entre varios factores. En esta revisión, exploramos los aspectos relevantes del urianálisis en la práctica clínica rutinaria del intensivista y la forma en que puede orientar para el enfoque diagnóstico, tratamiento y pronóstico de un paciente críticamente enfermo.
Contribución de los autores:
Jorge Rico-Fontalvo, Rodrigo Daza-Arnedo y Tomas Rodriguez-Yanez: concepción, escritura del artículo, análisis de conclusiones.
Juan Gutiérrez Ariza, Oscar Soto Guerrero, Beatriz Suarez Romero, Ángel Vásquez Jiménez, Dairo Rodelo y Esteban Díaz Suarez: búsqueda bibliográfica y revisión de gráficas.
Lourdes Carolina Vázquez Jiménez: revisión del artículo, análisis de conclusiones.
Conflicto de intereses: Los autores para este artículo no reportan conflicto de interés.
Financiación: Los autores reportan que la financiación para este artículo fue con recursos propios.