INTRODUCCION
La enfermedad renal diabética (ERD) es una comorbilidad con alta prevalencia a nivel mundial, siendo una de las complicaciones más frecuentes de la diabetes mellitus (DM) y la principal causa de enfermedad renal terminal 1,2. La ERD se relaciona con complicaciones cardiovasculares, progresión de la enfermedad renal crónica (ERC) y requerimiento de terapia de reemplazo renal, por ello la identificación de factores modificables e intervenciones orientadas a reducir la carga de morbilidad en estos pacientes es fundamental 3. Dentro de estos debemos considerar la hipertensión arterial como un factor de riesgo modificable para complicaciones cardiovasculares y para la progresión de la ERC, siendo deseable desarrollar estrategias para la prevención y tratamiento de la misma 4,5. Evaluaremos el rol de la hipertensión y del bloqueo del eje renina angiotensina aldosterona (RAAS) en el curso de la ERD y las estrategias terapéuticas orientadas a la optimización de la presión arterial (PA), el bloqueo RAAS y el impacto a nivel cardiovascular.
Dentro de la estrategia de tratamiento y gestión de riesgo en pacientes con enfermedad renal diabética, la identificación de factores de riesgo modificables y potencialmente modificables es fundamental para guiar estrategias de tratamiento 6. En este sentido los factores de riesgo para progresión de la ERD incluyen hiperglicemia, hipertensión arterial, albuminuria, dislipidemia, tabaquismo, obesidad, dieta inadecuada y estilos de vida sedentarios 6,7. Por ello, además de plantearnos una meta de presión arterial se buscará impactar sobre componentes adicionales del riesgo cardiovascular y progresión de la ERD 6,7.
Tratamiento de la hipertensión en pacientes con ERD
El tratamiento intensivo de la PA en pacientes con ERD es parte del cuidado usual recomendado actualmente por las diferentes guías de manejo dado su beneficio en retrasar la progresión de la ERD y reducción de eventos cardiovasculares adversos 6. Tempranamente en la historia del control de la PA en pacientes con ERD se ha demostrado los beneficios de su reducción, el primer bloqueador del sistema RAAS utilizado en pacientes con HTA y DM fue el captopril el cual logró demostrar que el control de la presión arterial (PA) tendría beneficios en la reducción de albuminuria 8.
Una revisión sistemática de la literatura y metaanálisis evaluó el impacto de la reducción de la PA en pacientes con DM tipo 2, incluyo 100.354 pacientes en 40 estudios, se observó que la reducción de 10 mm de Hg de la PA sistólica se asoció con un riesgo significativamente menor en mortalidad (riesgo relativo (RR) 0.87; IC95% 0.78-0.96), eventos cardiovasculares (RR 0.89, IC95% 0.83-0.95), cardiopatía isquémica (RR 0.88, IC95% 0.80-0.98), accidente cerebrovascular (RR 0.73, IC95% 0.64-0.83), albuminuria (RR 0.83, IC95% 0.79-0.87) y retinopatía (RR 0.87, IC95% 0.76-0.99). No obstante, al evaluar el componente de progresión de la ERD a enfermedad renal terminal y requerimiento de diálisis, los resultados no fueron concluyentes 9.
Al evaluar el curso de la ERD la albuminuria es un elemento fundamental, su incremento es un marcador distintivo del daño renal en estos pacientes, siendo empleado como método diagnóstico y clasificatorio de la enfermedad. Se ha observado una evolución en el conocimiento de la fisiopatología y curso de la ERD lo que ha permitido identificar fenotipos de la enfermedad, los fenotipos albuminúrico y no albuminúrico 10. Lo anterior constituye un factor a considerar dentro de la medicación y los objetivos de PA a plantearse en estos pacientes 10.
Dentro de los primeros estudios en pacientes con ERD fenotipo albuminúrico e hipertensión arterial se tuvo el estudio RENAAL con el medicamento losartán (Reduction of End Points in NIDDM with the Angiotensin II Receptor Antagonist Losartan), el cual mostró que una reducción de la presión arterial sistólica (PAS) <130 mm de Hg disminuía la progresión de la ERD y la necesidad de diálisis 11. Otra investigación realizada en una población similar empleo el Irbesartán (Irbesartan Diabetic Nephropathy Trial) en la que una PA con valores de < 120/80 mm de Hg, se asoció a un incremento en el riesgo de eventos cardiovasculares, esta última investigación establece así un límite para la reducción de la PA en este grupo de pacientes 12.
Un metaanálisis más recientemente publicado evaluó la reducción farmacológica de la PA en la prevención primaria y secundaria de enfermedad cardiovascular, incluyo 48 ensayos clínicos aleatorizados, con una población de 344 716 pacientes. Este trabajo logró demostrar que una reducción en 5 mm de Hg en la PAS redujo el riesgo de evento cardiovascular mayor en un 10%, esta reducción se dio independiente del diagnóstico de enfermedad cardiovascular y nivel de PA previo, mostrando los beneficios de reducción aislada de PA, incluso en pacientes con niveles basales normales de PA 13. Por lo tanto, el control y reducción de la PA serán un objetivo fundamental de las intervenciones farmacológicas y no farmacológicas en paciente con ERD 13.
Intervenciones farmacológicas en la construcción de metas de control de PA
La presión arterial (PA) en el capilar glomerular es un factor que contribuye a la incidencia y progresión de la ERD. Dentro de los efectos de un control estricto de la PA encontramos la disminución de albuminuria, retardo en la progresión de la ERC y disminución en la incidencia de eventos cardiovasculares. En la fisiopatología de la ERD se ha documentado el papel protagónico del sistema RAAS, de allí que el uso de los inhibidores de la enzima convertidora de angiotensina (iECAs) o los bloqueadores del receptor de angiotensina (BRAs) se hayan convertido desde finales del siglo XX en una piedra angular del tratamiento de pacientes con ERD, especialmente del fenotipo albuminúrico 2,15.
Los iECAs y BRAs se han establecido como un tratamiento efectivo en la reducción de la progresión de la ERD y reducción de eventos cardiovasculares asociados 4. Los primeros medicamentos en demostrar efectos benéficos del control de la PA en DM fueron los iECAs, los cuales disminuyen la presión hidrostática intraglomerular al vasodilatar la arteriola eferente, reducen la albuminuria y actúan sobre el endotelio disminuyendo el crecimiento del musculo liso vascular y la liberación de endotelina. Esta acción renoprotectora de los iECAs es explicado por varios mecanismos, siendo importante mencionar que actúan principalmente bloqueando el eje RAAS 2,15.
La capacidad que tienen los iECAS y los BRAs para inhibir el eje RAAS llevan a prevenir o retardar la progresión de la nefropatía incipiente a manifiesta, y enlentecen la progresión de ERC manifiesta a enfermedad renal terminal, efectos protectores que van más allá de sus efectos sobre el control de la PA. Los IECAs y los BRAs son medicamentos que actúan favorablemente en todo el continuum de la ERD fenotipo albuminúrico 15.
Se han evaluado diferentes metas de control de presión arterial, con resultados cardiovasculares favorables alcanzando metas de PAS inferiores a 140 mm de Hg. No obstantes, la evidencia derivada de estos ensayos clínicos aleatorizados controlados ha excluido pacientes con ERC avanzada o terminal 2,14,15.
Dos de los primeros estudios que evaluaron pacientes con DM tipo 2 y enfermedad renal crónica establecida son el RENAAL e IDNT, estudios con resultados que orientan a las metas y utilidad del bloqueo RAAS en pacientes con ERD. El estudio RENAAL (Reduction in End-Points in Non-Insulin Dependent Diabetes Mellitus With the Angiotensin II Antagonist Losartan), empleando losartan en comparación con placebo logro reducir la incidencia de la duplicación de la creatinina, redujo la probabilidad de progresión a enfermedad renal avanzada y redujo la proteinuria en un 35% 16. El estudio IDNT (Irbesartan Diabetic Nephropathy Trial), realizado con irbesartan, mostró reducción del riesgo de duplicar la creatinina, requerir diálisis o trasplante en el grupo de intervención (17). En los análisis Post-hoc de estos estudios, se comprobó que el control de PAS (PAS <130 mm de Hg), fue asociado con una disminución del riesgo cardiovascular y de los eventos renales. Sin embargo, cuando las cifras de PAS son <120 mm de Hg, se incrementa la mortalidad y el riesgo cardiovascular 17.
Otros estudios clásicos como el UKPDS (United Kingdom Prospective Diabetes Study, mostraron que por cada 10 mm de Hg de reducción en las cifras de PAS hubo una reducción del 12% del riesgo de complicaciones diabéticas, sin embargo, si la PAS baja a cifras menores de 120 mm de Hg, este beneficio es modesto 18. Por otro lado, el estudio ABCD (Appropriate Blood Pressure in Diabetes), con la participación de 480 pacientes con DM tipo 2 y seguimiento a 5 años, con un grupo con control estricto de PA (PA lograda de 128/75 mm de Hg) versus un grupo de cuidado usual, control menos estricto (PA lograda de 137/81mmHg), encontró una disminución en la aparición de microalbuminuria y disminución en la proteinuria en el grupo de control más estricto de PA 19. Otro estudio realizado con un BRA (Candesartan), demostró preservación de la autorregulación renal y la TFG en pacientes diabéticos tipo 2, a pesar del descenso marcado de la PA y la excreción urinaria de albumina. El estudio ACCORD (Action to Control Cardiovascular Risk in Diabetes), no encontró mejoría en los resultados de desenlaces cardiovasculares con el control estricto de la PA, sin embargo, el control óptimo de la PA se asoció con reducción en la albuminuria 20.
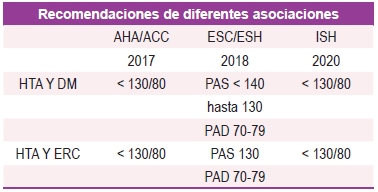
Teniendo en cuenta la evidencia revisada, es claro que la reducción de la PA es importante para el manejo de los pacientes con ERD. La aparición de eventos cardiovasculares y renales es más alta en los pacientes diabéticos que están con PA no controladas y estos eventos se reducen de manera importante con el control de las cifras de PA. Las actuales guías KDOQI y el JNC 8 (Eighth Joint National Committee) coinciden en recomendar para estos pacientes, una meta valor de 130/80 mmHg o menos, según tolerancia o riesgo/beneficio. The High Blood Pressure Clinical Practice Guideline también sugiere un valor menor a 130/80 mm de Hg independientemente de la proteinuria, y sugiere monitorizar la función renal ante el riesgo de deterioro, sobre todo cuando se utilizan iECAs o BRAs 21,22. La American Diabetes Association recomienda una reducción por debajo de 130/80 mm de Hg para reducir la mortalidad por enfermedad cardiovascular y reducir la progresión de la ERC en personas con DM 23. La evidencia en metas de control de PA se ha construido con el empleo de iECA y BRAs por ello se constituyen como medicación de primera línea para tratamiento de la PA en pacientes con DM 15.
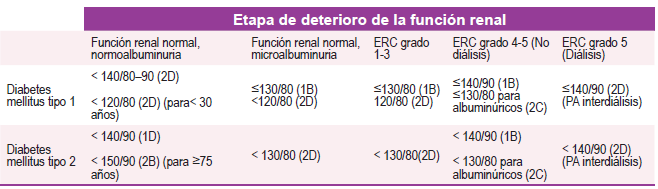
En general, se recomiendan metas de presión arterial de 130/80 mmHg para pacientes con HTA y DM, al igual que para pacientes con HTA y ERC. (Ver Tabla 1), también existen propuestas como las del grupo de la Association of British Clinical Diabetologists y the Renal Association UK que recomiendan unos umbrales de PA de acuerdo al estadio de ERD y la presencia o no de albuminuria (Ver Tabla 2) 24.
Bloqueo del eje renina angiotensina aldosterona (Eje RAAS)
La inhibición del eje RAAS con distintos tipos de medicamentos (iECAs, BRAs, inhibidores directos de la renina, antagonistas mineralocorticoides entre otros, han mostrado eficacia en cuanto a la reducción de la progresión de la ERD en modelos animales. En estudios en humanos, esta intervención es una terapia que ha demostrado retardar la progresión de la ERD, constituyéndose hoy en día una de las intervenciones más costo-efectiva existentes. La inhibición del eje RAAS ha sido estudiada en los diferentes estadios clínicos de la ERD y estas intervenciones, han sido probadas con diferentes medicamentos con evidencia en los diferentes fenotipos de pacientes con DM 21. El beneficio de los bloqueadores del RAAS es independiente de su potencial antihipertensivo, sin embargo, siempre se debe intentar utilizar la máxima dosis tolerada por el paciente y se debe evitar el uso combinado de iECAS y BRAs ya que este doble bloqueo ha mostrado un incremento en la incidencia de hiperkalemia, hipotensión y lesión renal aguda 25-28. La meta de presión arterial puede ser menor a 140/90, sin embargo, se sugiere lograr una meta menor a 130/80 mm de Hg en los pacientes con albuminuria, enfermedad cardiovascular establecida o muy alto riesgo cardiovascular como se ha discutido previamente 3,23 (Ver Tabla 1 y Tabla 2)
En pacientes macroalbuminúricos (estadios A3: mayor o igual a 300 mgs/gr) en el estudio IDNT (Irbesartan Diabetic Nephropathy Trial) la nefropatía se presentó un 20% menos en el grupo de Irbesartan comparado con el amlodipino (p= 0.006; NNT 12) y el placebo (p=0.02; NNT 16) 17. De la misma forma la posibilidad de duplicar la creatinina fue 33% menor con Irbesartan que con placebo (p=0.003; NNT 15) y 37% menor que con amlodipino (p=<0.001; NNT 12) 29. Hallazgos similares fueron reportados por el RENAAL (Reduction of End Points in NIDDM with the Angiotensin II Receptor Antagonist Losartan) en el cual se redujo la posibilidad de progresar en la nefropatía (RRR 16%; NNT 28), doblar la creatinina (RRR 25%; NNT 23) o alcanzar un estado de ERC terminal (RRR 28%; NNT 17) en un seguimiento a 3.4 años 16. Análisis posteriores del estudio RENAAL han encontrado que el factor de riesgo más importante para la progresión de la ND es la magnitud de la proteinuria tanto al inicio del estudio como luego de 6 meses de tratamiento, observándose una reducción del 18% en el riesgo de un evento cardiovascular por cada 50% de reducción en la excreción de proteínas 16. Así, la reducción de la proteinuria se convierte en un objetivo terapéutico adicional a las metas tensionales tradicionales.
Posteriormente, hay estudios de intervención en ERD en estadios más tempranos. Estos estudios sustentan los beneficios de la inhibición del eje RAAS en pacientes con microalbuminuria (estadios A2: entre 30 y 299 mgs/gr). En el estudio IRMA2 el irbesartan tanto a la dosis de 150 como de 300 mg redujo de manera significativa el riesgo de progresión a macroalbuminuria comparado con placebo (44% y 78% de reducción de riesgo respectivamente) pero solo la dosis de 300 mg mostró una regresión estadísticamente significativa al estadio de normoalbuminuria (34% vs 21% con placebo; p = 0.006) 30. En el estudio DETAIL no se encuentran diferencias significativas en la TFG a los 5 años en el grupo tratado con Enalapril vs el tratado con Telmisartan 31. El estudio MARVAL muestra mayor reducción de la microalbuminuria (MA) y mayor regresión a normoalbuminuria con el valsartan en comparación a amlodipino a las 24 semanas (-29.6% vs. +17.2% y +29.9% vs. +14.5% respectivamente) 32. El estudio CALM (Candesartan and Lisinopril Microalbuminuria Study) que explora la monoterapia con un iECA y con un ARA II frente al bloqueo dual demuestra igual efectividad con el uso de las monoterapias, pero la terapia dual logra mayor control de las cifras tensionales y una mayor reducción en la proteinuria 33.
En pacientes normoalbuminúricos en el estudio BENEDICT (Bergamo Nephrologic Diabetes Complications Trial) el porcentaje de pacientes que progresó a microalbuminuria (MA) en el grupo placebo, verapamilo, trandolapril y en la combinación (Trandolapril + Verapamilo) fue de 10%, 11.9%, 6% y 5.7% respectivamente 34. Diferencia significativa para el trandolapril y la combinación de los 2 vs. Placebo y verapamilo como monoterapia 34. En los grupos que recibieron el iECA (solo o en combinación) el 5.8% de los pacientes progresan a MA en comparación con el 10.9% de los pacientes que no recibieron iECA (NNT = 20 pacientes por 3 años) 34.
El estudio ROADMAP (Randomized Olmesartan and Diabetes Microalbuminuria Prevention) también muestra a niveles similares de control de presión arterial una menor aparición de MA en DM 2 con Olmesartan que con Placebo (8,2% vs 9,8%; NNT 60 por 3 años) retrasando la aparición de esta, sin embargo, contrario a lo esperado, se reportó una mayor frecuencia de mortalidad cardiovascular en el grupo que recibió Olmesartán 35.
Otras intervenciones farmacológicas en el bloqueo RAAS y el control de la PA
Buscando optimizar aún más el bloqueo del eje RAAS, se llevaron a cabo varios estudios que combinaban uso de iECAs y BRAs o uno de estos dos medicamentos con Aliskireno, que es un inhibidor selectivo de la renina (lo que llamamos bloqueo dual). Hay tres estudios relevantes, que son el estudio ONTARGET (Ongoing Telmisartan Alone and in Combination With Ramipril Global Endpoint), un estudio clínico aleatorizado, con la participación de 25.620 pacientes con riesgo de enfermedad cardiovascular, en donde se usó ramipril, telmisartan o ambos 27. Con la publicación del ONTARGET (Ongoing Telmisartan Alone and in Combination with Ramipril Global EndpointTrial) se ha cuestionado el uso del bloqueo dual en el manejo de los pacientes diabéticos con riesgo cardiovascular ya que en este estudio se encontró una mayor frecuencia de eventos adversos renales (duplicación de creatinina, diálisis aguda, hiperpotasemia, discontinuación del tratamiento) con la combinación ramipril + telmisartan vs el uso de cualquiera de ellos como monoterapia 27. En el ONTARGET la terapia dual mostraba una tendencia no significativa hacia la mejoría de la sobrevida, pero sin beneficio sobre los desenlaces renales e incluso con tendencia a peores desenlaces en los pacientes de bajo riesgo renal 27. El estudio VA NEPHRON-D (Veterans Affairs Nephropathy in Diabetes), con 1448 pacientes con DM tipo 2 y con proteinuria, en donde se intervinieron con losartan (100 mg día) en combinación con lisinopril 40 mg o losartan 100 mg día más placebo 36. Este estudio fue suspendido por incremento de eventos adversos graves en el grupo de tratamiento combinado 27,36. El tercer estudio en mención, el ALTITUDE (Aliskiren Trial in T2DM Using Cardio-Renal Endpoints), en donde se usó como bloqueo dual del eje RAAS, aliskireno con otro IECA o BRAs. Este estudio también se terminó temprano por incremento en eventos adversos sin aparente beneficio de la terapia dual 37. En resumen, la evidencia actual soporta de manera contundente el uso de agentes que bloquen el eje RAAS para el tratamiento de pacientes con ERD, sin embargo, cuando se hace bloqueo con más de un agente (uso de iECAS con BRAs), puede ser efectivo en reducir la proteinuria, pero aumentan los efectos adversos (hiperpotasemia o falla renal aguda) y además incrementan los eventos cardiovasculares, por lo que, en la actualidad, su uso no está recomendado 21.
Otros agentes antihipertensivos evaluados en el control de PA en pacientes con ERD con mecanismos de acción directos independientes del eje RAAS son los agentes betabloqueantes. En estudios preliminares tempranos mostraron una potencia similar a los iECA en pacientes con diabetes mellitus tipo 1 y nefropatía diabética 38. Por otro lado, el uso de bloqueadores de los canales de calcio no dihidropiridínicos puede tener algunos de los beneficios en el tratamiento de la ERD y coadyuvantes en el manejo de la proteinuria 39. Por último, agentes con evidencia creciente son los antagonistas del receptor mineralocorticoide, intervienen en el bloqueo RAAS, los cuales describimos en el siguiente apartado 40,41.
Papel de los Antagonistas del receptor mineralocorticoide (ARM).
Un grupo de fármacos con evidencia creciente son los antagonistas del receptor mineralocorticoide (ARM) tienen efectos antihipertensivos suprimiendo la actividad de la aldosterona, producto final de la activación del eje RAAS, situación que se ha relacionado con reducción de la proteinuria 40. Actualmente tenemos disponible tres medicamentos: ARM esteroideos (espironolactona y eplerenone) y un ARM no esteroideo selectivo (finerenona) 41. Los ARM bloquean directamente el receptor inactivando la acción de la aldosterona y otros ligandos (cortisol, estrés oxidativo, RAC 1, hiperglucemia) impidiendo la respuesta genómica y no genómica de la interacción con el receptor, disminuyendo así el grado de inflamación y remodelación en el corazón y riñón 41. El metaanálisis de Hou y colaboradores, encontró que la espironolactona se asoció a reducción de albuminuria, inflamación y fibrosis en pacientes con ERC 42. También, existen datos favorables con el uso de eplerenona en reducción de albuminuria en pacientes con hipertensión arterial crónica 43.
Un metaanálisis evaluó el efecto de los antagonistas del receptor mineralocorticoide, incluyo 31 estudios controlados aleatorizados (ECA), con una población de 2767 participantes (44). El uso de agentes ARM (Solos o en combinación con bloqueo RAAS con iECAs o BRAs) comparado con placebo disminuyó la rata de excreción albumina/creatinina en orina en un rango de -24.55% (IC95% -29.57% a -19.53%), reducciones que se mantuvieron al compararse con otros medicamentos como calcio antagonista, también redujeron discretamente la progresión en la caída del filtrado glomerular 44. Concluyéndose que el empleo de ARM se asocia a importante reducción de proteinuria en pacientes con ERD 44.
No obstante, existen restricciones con el uso de estos medicamentos especialmente en pacientes con ERC avanzada y sus potenciales eventos adversos como la hiperpotasemia, lo cual limitaría el empleo de esta medicación 40. Por ello el desarrollo de nuevos ARM no esteroideos, más selectivos para el receptor mineralocorticoide como finerenona, con potentes efectos antiinflamatorios y antifibróticos, son prometedores. En los estudios Effect of Finerenone on Chronic Kidney Disease Outcomes in Type 2 Diabetes (FIDELIO DKD) y Cardiovascular Events with Finerenone in Kidney Disease and Type 2 Diabetes (FIGARO DKD), han demostrado reducción en la progresión de ERC y eventos cardiovasculares incluyendo hospitalización por falla cardiaca 45,46.
En primera instancia, en el ECA FIDELIO DKD, incluyo una población de 5734 pacientes con diabetes mellitus tipo 2 y TFG estimada entre 25 - 75 mL/min/1.73 m2 en tratamiento con iECA o BRAs, fueron aleatorizados a recibir tratamiento con finerenona o placebo, demostrando que el bloqueo del receptor mineralocorticoide se asoció con una reducción del resultado compuesto final del estudio que incluía caída sostenida de la TFG >40%, progresión a diálisis o muerte. Se estimó un HR 0.82 (IC 95% 0.73 - 0.93), p=0.001, y un NNT de 29 pacientes 45. Los beneficios se trasladaron además a reducción de resultados cardiovasculares secundarios como muerte de origen cardiovascular, IAM, ACV no fatal u hospitalización por falla cardiaca, con un HR 0,86 (IC95% 0.75-0.99, p=0.03 y un NNT de 42 45. En general la medicación fue bien tolerada con una tendencia a la hiperkalemia en el grupo de intervención, haciéndose necesario un monitoreo de los electrolitos durante el curso terapéutico.
Posteriormente, el ECA FIGARO DKD, conto con una población de 7.437 pacientes con DM tipo 2 y ERC, en este trabajo los pacientes tratados con finerenona tuvieron una reducción significativa del resultado compuesto cardiovascular que incluía infarto de miocardio, accidente cerebrovascular, hospitalización por falla cardiaca o muerte, con HR de 0.87 (IC95% 0.76 - 0.98); P = 0,03 comparado con placebo 46. Este trabajo en una base poblacional mayor demuestra los beneficios en prevención de eventos cardiovasculares del tratamiento con ARM más allá de la reducción en el rango de proteinuria, como se había demostrado en estudios previos 46.
Por último, el estudio FIDELITY fue un análisis preespecificado que recopilaba los dos estudios, FIDELIO y FIGARO 47. Con una población combinada de 13.171 pacientes con un seguimiento promedio de 3 años evaluó el resultado cardiovascular compuesto, previamente descrito, presentándose el 12.7% de los pacientes en tratamiento con finerenona vs 14.4% en el grupo placebo, para un HR estimado de 0.86 (IC95% 0.78 - 0.95), p=0,0018 47. Los análisis complementarios del registro FIDELITY sugieren que finerenona se asoció con una reducción significativa del 20% en la incidencia de enfermedad renal terminal, así como con una reducción en todos los resultados renales compuestos no fatales, constituyendo un nuevo actor clave en el manejo de la ERD 47,48.
En consecuencia, derivada de la evidencia disponible finerenona estaría indicado en pacientes adultos mayores de 18 años con diagnóstico de DM tipo 2 y ERD fenotipo albuminúrico clasificados de alto o muy alto riesgo cardiovascular en quienes, a pesar del uso a dosis máxima tolerable del IECA/ARAII no se logra controlar la albuminuria 41. Para el uso de finerenona hay que tener en cuenta la TFG y los niveles de potasio sérico. Se recomienda su uso con TFG mayores de 25 cc /min y con niveles de K sérico menores de 5 meq/l 6,41,49.
CONCLUSION
La ERD es una de las complicaciones más frecuentes de la diabetes mellitus (DM), siendo la enfermedad cardiovascular la principal causa de mortalidad en este grupo de pacientes. Dentro de los objetivos en el manejo del paciente con ERD, además de retardar la progresión de la enfermedad renal, está el disminuir los desenlaces cardiovasculares. El control de la PA sigue siendo un pilar fundamental para lograr estos objetivos. Los bloqueadores del RAAS (iECAS y BRAs) son los antihipertensivos de elección y en general las metas de PA deben estar alrededor de 130/80 mmHg o menos, según tolerancia. Estos medicamentos tienen su efecto terapéutico por el bloqueo RAAS y esto les permite tener además del control de la PA, efectos nefroprotectores y cardioprotectores importantes en pacientes con ERD, sobre todo cuando hay la presencia de albuminuria. Los ARM selectivos y no esteroideos como finerenona también comienzan a tener un rol importante, mas como medicamento cardio y nefroprotector en los pacientes con ERD con albuminuria. El futuro es promisorio.
Contribución de los autores:
Jorge Rico Fontalvo, Rodrigo Daza Arnedo y Tomas Rodriguez Yanez: elaboración del protocolo, reclutamiento de datos, análisis de resultados, escritura del artículo.
Juan Montejo Hernández: concepción y diseño de la investigación, análisis de resultados, escritura del artículo, análisis de conclusiones.
María Cardona Blanco, Jhon López Lozano, Mayerlys Plaza Rivero: búsqueda bibliográfica, reclutamiento de datos, análisis de resultados, revisión del artículo.
Lourdes Carolina Vázquez Jiménez: revisión del artículo, análisis de conclusiones.
Conflicto de intereses: Los autores para este artículo no reportan conflicto de interés.
Fuente de Financiación: Los autores reportan que la financiación para este artículo fue con recursos propios.