INTRODUCCION
El desbridamiento temprano y cobertura con injertos de piel autóloga constituye uno de los pilares fundamentales en el manejo de las quemaduras. Sin embargo, a pesar de ser el tratamiento estándar, el proceso puede verse dificultado debido a la falta de zonas de piel donante sana que presentan algunos de estos pacientes 1.
El uso de la membrana amniótica humana (MAH), fue puesto en práctica por el Dr. Davis en 1910, como trasplante de piel 2. En 1913, Stern y Sabella al aplicar membrana amniótica sobre ulceraciones y quemaduras de la superficie cutánea observaron que no se producía infección de las heridas, había reducción del dolor y aumentó la velocidad de reepitelización 3,4.
El uso de membrana amniótica constituye una excelente alternativa en el tratamiento de quemaduras, en las que se necesita reconstruir superficies cruentas. Debido a sus propiedades permite su uso en diversas patologías. En la capa estromal existen factores liberadores, de proliferación y angiogénicos, que reducen la inflamación y modulan la cicatrización 5. Esta MAH, asimismo, expresa el factor de crecimiento epidérmico (EGF), factor de crecimiento del hepatocito y factor de crecimiento del queratinocito 6. La capa epitelial compuesta por un epitelio cúbico simple se asienta sobre una gruesa membrana basal rica en colágenos III y IV y laminina favorece la adhesión y migración celular, y por tal motivo estimula la re-epitelización propiedad muy valorada. Otra propiedad de gran importancia es la ausencia de reacción inmune ante este tejido, evitando de esta manera una reacción inflamatoria 7.
La técnica Meek fue descrita por primera vez en 1958; utilizaba un mallador personalizado para lograr la expansión del injerto de piel requerida para lograr la cobertura. En 1964, Tanner introdujo la técnica de mallado de piel que todavía se utiliza de forma generalizada a día de hoy. Es una técnica más sencilla que la descrita por Meek y en consecuencia se popularizó rápidamente mientras que la otra quedó relegada. Sin embargo, la técnica de Tanner se asocia con una menor relación de expansión de la piel y persiste el problema de la escasez de zonas donantes en ciertos pacientes con una disponibilidad limitada de dichas zonas 8.
En 1993, Kras et al. modificaron la técnica de Meek incorporando una malla de aluminio plegada que facilitaba la expansión de pequeños fragmentos de piel obtenidos con un dermatomo distinto a los utilizados previamente. En los últimos años hemos presenciado un resurgimiento de esta técnica 9.
Caso clínico
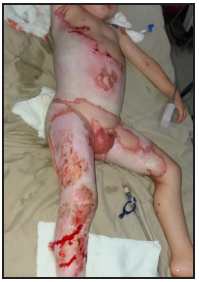
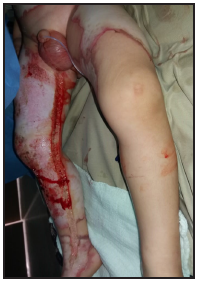
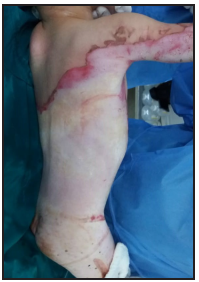
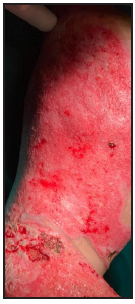
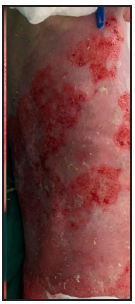
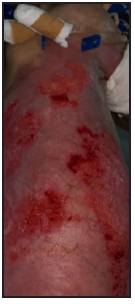
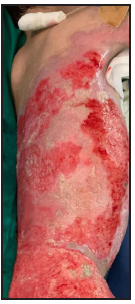
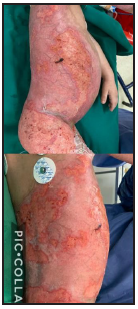
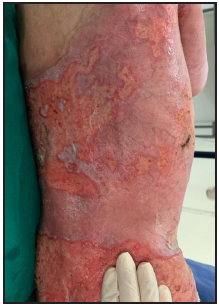
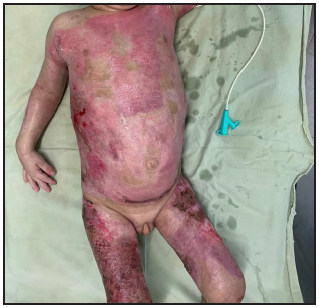
Se presenta el caso clínico de un paciente preescolar de 2 años y 11 meses de edad, masculino, procedente de María Auxiliadora, departamento de Itapúa, que ingresó al servicio de Urgencias del CENQUER (Centro Nacional de Quemaduras y Cirugías Reconstructivas) en abril de este año, con historia de quemadura por escaldadura con líquido caliente, accidente doméstico, la lesión abarcaba región posterior y anterior del abdomen y tórax, región glútea y perineal, pene y testículos, miembros inferiores y miembro superior derecho, con un total de 35% de SCT (superficie corporal total) de 2° grado superficial y profundo. Fue ingresado en la Unidad de Cuidados Intensivos Pediátricos (UCIP), en el 1° DDI fue intervenido quirúrgicamente con escarotomía y escarectomía tangencial hasta objetivar un lecho viable con sangrado puntiforme en el plano dérmico, se colocó membrana amniótica como cobertura temporal y al 7° DDI se realizó injerto de piel parcial con la técnica MEEK, durante los 7 días siguientes se mantuvo al paciente en decúbito prono. Se verificó buena adherencia de las islas de piel en las curaciones siguientes por lo que se decide una segunda intervención al 20° DDI con injerto MEEK y se mantiene al paciente en decúbito dorsal, con buena integración de las islas de piel. Actualmente, los injertos mallados se han adherido correctamente con buenos resultados estéticos y funcionales.
DISCUSION
El uso de membrana amniótica ha sido reportado en varias patologías relacionadas a diversos campos: en lesiones de la superficie del globo ocular en oftalmología, en ginecología para reconstrucciones vaginales, en neonatología para reparaciones de onfalocele y en cirugía plástica, especialmente en pacientes quemados, para cobertura transitoria de grandes áreas cruentas 10. Las características histológicas y biofísicas del amnios permiten ser aplicado a los defectos ya mencionados, favoreciendo la epitelización.
Al inhibir las proteasas brinda un efecto antiinflamatorio directo sobre las heridas mejorando su aspecto y evolución. Además, evita la pérdida de líquidos, electrolitos y proteínas en las áreas cruentas, siendo de gran ayuda en pacientes quemados; a modo de barrera artificial ayuda a prevenir las infecciones como una membrana basal sustituta, y tiene un importante efecto analgésico sobre las lesiones. Procede confirmar que todas estas propiedades han sido observadas en este niño.
La constitución del epitelio de la MAH permite múltiples funciones especializadas, su membrana basal, contiene colágeno tipo IV y V, laminina e integrina, las cuales actúan en procesos ligados a la cicatrización e inflamatorios. La matriz estromal está conformada en su mayoría por fibroblastos, agentes celulares involucrados directamente en procesos de reparación y cicatrización de heridas. Inmediato a su uso como cobertura en heridas, facilita la migración epitelial, refuerza su adherencia, promueve la diferenciación celular y previene la apoptosis.
Un mecanismo de relevancia es la protección física que adquiere el tejido cruento con el uso de la MAH, proporcionando cobertura ante cualquier acción física de barrido en contra de la piel lesionada 11. Este método funciona como una barrera entre la herida y el medio externo siendo una de sus causas de fracaso: su uso sobre tejido desvitalizado o necrótico. Se recomienda que las superficies contaminadas e infectadas deben ser desinfectadas previo a su colocación 12.
La técnica de microinjerto, desarrollada por Meek et al. y modificada por Kreis et al. se ha convertido en una herramienta de gran valor en la cirugía de los grandes quemados, ya que precisa de áreas donantes de extensión muy reducida y se consiguen unas elevadas relaciones de expansión. Se ha comprobado que la técnica usada tradicionalmente para lograr la expansión de los injertos presenta una disparidad importante entre los resultados esperados y los logrados. Así, la relación de expansión 1:1,5 realmente es de 1:1,23, mientras que la relación 1:3 es realmente de 1:1,5. La técnica Meek permite obtener una relación de 1:3, 1:4, 1:6 y hasta de 1:9, obteniendo superficies de 49,2 - 147,6 cm2 de cada bloque de 4,2x4,2 cm2. Permite así mismo utilizar fragmentos de piel de poco tamaño, aprovechando al máximo las zonas donantes a pesar de que éstas escaseen, evitando desperdiciar cualquier fragmento. Se diferencia de la técnica en spray en que esta última no garantiza una orientación correcta de las células (algunas pueden quedar con la cara dérmica hacia arriba), mientras que la Meek garantiza una orientación adecuada de los parches, logrando una epitelización rápida y uniforme y se diferencia del injerto a partir de cultivo de células epiteliales en que éste ni se expande ni presenta componente dérmico 13.
El proceso suele completarse sobre las tres semanas dependiendo de la relación de expansión, la presencia de infección y la preparación del lecho. La literatura describe excelentes tasas de éxito, prendiendo el 70-95% de los injertos según las distintas series. La causa más frecuente de pérdida del injerto es la infección.
La técnica de microinjertos debería reservarse para casos en los que existe una correcta indicación, principalmente como técnica de rescate en quemaduras extensas en las que no se dispone de otras alternativas 14.
En algunos casos los microinjertos mediante el sistema Meek se emplearon como opción inicial, pero en la mayoría de casos publicados se comenzó con injertos mallados 3:1 y se recurrió al Meek como rescate cuando las zonas donantes se fueron agotando. Por ejemplo, Zermani utilizó injertos mallados para lograr la cobertura del 20-35% (media 22%) de la superficie cutánea total (SCT) y los microinjertos para el 8-10% restante, mientras que Lumenta et al. optaron por emplearlo de forma más extensa, cubriendo un 61,7% (36-80%) de SCT con microinjertos. Munasinghe publicó una media de 16% de SCT injertada mediante microinjertos utilizando una relación de expansión 1:9, prendiendo el 87% de éstos. Medina et al. publicaron su experiencia con 10 pacientes con una media de 43% de SCT injertada mediante técnica Meek. Todos presentaron como principal complicación la infección, pero solo una media de 15% de SCT requirió nuevo injerto 15.
Las distintas publicaciones coinciden en la necesidad de cubrir los microinjertos a partir del día 7 una vez se retira la gasa de poliamida, ya sea con aloinjerto, apósitos o autoinjertos de células cultivadas, tal y como demuestran Menon et al. y Raff et al. en sus trabajos. La epitelización conseguida fue claramente superior en estos casos, ya que se proporciona una protección física a los injertos que descansan debajo y se previene la desecación. De lo contrario, aparece un tejido de sobre-granulación que inhibe el avance desde los bordes necesario para conseguir una completa epitelización 16.
Es conveniente vigilar la posible aparición de infección, ya que supone una causa frecuente de pérdida del injerto. No se ha demostrado que el grosor del injerto afecte la incidencia de infección; sin embargo, los resultados hasta el momento apuntan a que los injertos en isla ofrecen una mayor resistencia a la invasión por microorganismos ya que no presentan puentes de piel entre ellas como los injertos mallados, y dado el caso la pérdida de injerto es localizada y se limita únicamente a esa zona. Esto supone una gran ventaja ya que la no su-pervivencia de un número bajo de parches no afecta a la integración total del injerto. A pesar de esto, ante la sospecha de infección se debe recoger y mandar una muestra a microbiología para su estudio 17.
CONCLUSION
La técnica de microinjerto está especialmente indicada en el contexto de pacientes que pre-sentan quemaduras extensas profundas con escasez de zonas donantes de injerto. Es posible conseguir relaciones de expansión amplias, la tasa de injertos prendidos y de epitelización es satisfactoria, y el resultado estético es comparable al de los injertos mallados los cuales constituyen a día de hoy el tratamiento estándar. Para obtener un resultado satisfactorio es preciso realizar un desbridamiento meticuloso del área quemada con una correcta preparación del lecho receptor, así como una adecuada prevención y manejo de la infección.
Los resultados del uso del amnios fueron marcadamente favorables para los pacientes de este estudio; por lo tanto, podemos concluir que este método de cobertura temporal de heridas, es eficaz y se sugiere su aplicación en casos necesarios como una alternativa para tratamiento de superficies cruentas las causadas por quemaduras.
Conflicto de intereses y financiación.
No hay conflicto de intereses, ni financiación para este trabajo.