INTRODUCCION
Luego de la notificación a la Organización Mundial de la Salud (OMS) de un conglomerado de casos de neumonía en Wuhan (provincia de Hubei, China) a finales del año 2019 y la identificación del agente causante de la misma, un nuevo coronavirus, el cual fue designado SARS-CoV-2, la OMS Organización Mundial de la Salud (OMS) declara a la pandemia, el 11 de marzo, teniendo en cuenta la rápida expansión de la enfermedad y su impacto en la salud humana tanto en China como en otros países y continentes 1,2. A finales de mayo, la enfermedad ya había afectado a más de 6 millones de personas, de las cuales más de 370.000 han fallecido 3.
El agente causal SARS-CoV-2 es un nuevo virus, ARN monocatenario (+ ssRNA) con envoltura. Es miembro de la familia Coronaviridae, subfamilia Coronavirinae, género Betacoronavirus 4,5. Se ha demostrado que el SARS-CoV-2 utiliza la enzima convertidora de angiotensina 2 del receptor del huésped (ACE2) para ingresar a las células 6, el mismo receptor facilita el SARS-CoV para infectar el epitelio de las vías respiratorias y a los neumocitos tipo II, células pulmonares que sintetizan surfactante pulmonar 7.
La enfermedad, presenta una amplia gama de manifestaciones clínicas que varían de leves a severas, y en algunos casos incluso resultan en la muerte 8-10. En el adulto, los síntomas más comúnmente reportados son fiebre, tos, mialgia o fatiga, neumonía y dificultad respiratoria, mientras que los síntomas menos comunes incluyen cefalea, diarrea, hemoptisis, rinorrea y tos húmeda 10. En los casos leves, la recuperación se produce en aproximadamente una semana, mientras que en los casos graves se produce daño alveolar, el cual se manifiesta con dificultad respiratoria progresiva, que puede conducir a la muerte 10.
La enfermedad producida por este nuevo virus es más frecuente en ≥ 15 años, la proporción de casos confirmados entre niños es relativamente pequeña 11. La mayoría de los niños infectados tienen manifestaciones clínicas leves y el pronóstico es bueno, con recuperación en 1 a 2 semanas luego del inicio de los síntomas. Las infecciones del tracto respiratorio inferior son poco frecuentes en la edad pediátrica. Es así que teniendo en cuenta las características clínicas identificadas en los casos pediátricos reportados, la enfermedad se puede dividir en cinco tipos clínicos: i) infección asintomática, ii) enfermedad leve, iii) cuadro clínico característico; iv) cuadro clínico grave y v) paciente críticamente grave 12.
En niños la fiebre y la tos son las manifestaciones clínicas más comunes, otras manifestaciones clínicas son decaimiento, mialgia, congestión nasal, rinorrea, estornudos, dolor de garganta, cefalea, mareos, vómitos y dolor abdominal 12,13. Algunos niños no presentan fiebre, pero manifiestan tos o diarrea, y un menor número pueden ser portadores asintomáticos. Aunque los casos severos son raros en los niños, en ocasiones pueden progresar a un síndrome de distrés respiratorio agudo, choque séptico, acidosis metabólica refractaria y alteración de la coagulación. Por otro lado, algunos niños y recién nacidos presentan síntomas atípicos, que se manifiestan como vómitos, diarrea y otros síntomas gastrointestinales, o solo sibilancias y dificultad respiratoria. Los niños con patologías de base (cardiopatías congénitas, enfermedades pulmonares crónicas, desnutrición y tumores, etc.) son más vulnerables a presentar una infección severa 14. Como se mencionó previamente, la infección por COVID-19 en niños es menos grave y tiene menor mortalidad, en comparación con los adultos. Sin embargo, el Sistema Nacional de Salud del Reino Unido y la Sociedad de Cuidados Intensivos Pediátricos emitieron recientemente una alerta sobre la aparición de casos severos, el síndrome inflamatorio multisistémico. Este síndrome presenta características similares con el síndrome de Kawasaki y el síndrome de choque tóxico 15.
Diagnóstico
El método de referencia para establecer el diagnóstico de infección por SARS-CoV-2 es a través de la técnica de Biología Molecular, RT-PCR (de las siglas en inglés: reacción en cadena de la polimerasa con transcriptasa inversa) 16.
La infección induce la generación de anticuerpos que en su mayoría se dirigen a la proteína N de la nucleocápside viral y pueden ser detectados en suero tan pronto como el día 4 después de la aparición de la enfermedad y la mayoría de pacientes presentan seroconversión hacia el día 14. Sin embargo, con respecto a los anticuerpos, debe tenerse en cuenta que pueden dar resultados negativos las muestras tomadas en fases muy tempranas, antes de la seroconversión. Un resultado negativo no descarta la posibilidad de infección. Pueden darse resultados falsos positivos por reacciones cruzadas con otros virus. Pacientes inmunodeprimidos pueden producir anticuerpos en cantidades no detectables o tener una mayor demora en su producción 17-18.
La toma de muestra para análisis se debe realizar preferentemente entre los días 3 y 5 de la fecha de inicio de los signos/síntomas en pacientes sintomáticos 19. Para el estudio de anticuerpos en pacientes sintomáticos es de 14 días posteriores a los síntomas, y de pacientes con PCR Positivo es de 14 días posteriores a la PCR; en cambio en pacientes asintomáticos, de acuerdo a su condición epidemiológica.
La interpretación debe realizarse en base al estudio y el momento clínico del paciente (Tabla 1 y Gráfico 1) 20.
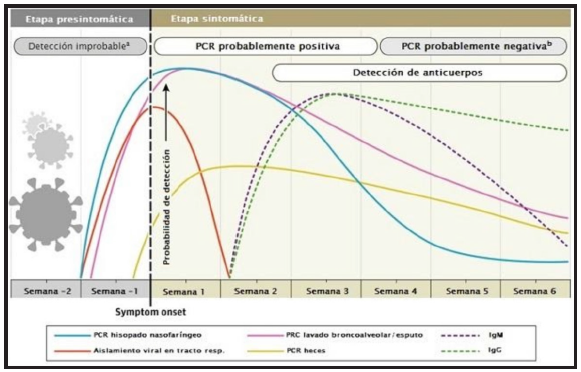
Gráfico 1. Relación temporal entre la infección por SARS-Cov 2 y su detección por molecular o por anticuerpos. *Imagen modificada de: Sethuraman N, Jeremiah SS, Ryo A. Interpreting Diagnostic Tests for SARS-CoV-2. JAMA. 2020;323(22):2249-2251. doi:10.1001/jama.2020.8259. 20
Manifestaciones Gastrointestinales
La información sobre las formas clínicas de presentación de la enfermedad por coronavirus en niños es aún escasa. Aunque éstos son susceptibles a la infección, la mayoría son asintomáticos o tienen formas leves de presentación, de características variables; convirtiéndose en una fuente imperceptible de contagio 21-23.
Los síntomas respiratorios son los más frecuentes en todas las series, tanto en adultos como en niños. Es importante no obstante recordar la existencia de síntomas “no clásicos”, como los gastrointestinales (GI), dado que no hacerlo así pudiera constituir un riesgo para la población La real incidencia de los síntomas GI, incluyendo náuseas y diarrea, es desconocida ya que los diferentes reportes arrojan cifras que varían entre 5% y 50% o más. En un estudio realizado en 204 adultos con COVID-19, 48,5% tuvo uno o más síntomas digestivos, incluyendo falta de apetito (40,1%), diarrea (14%), vómitos (4%) y dolor abdominal (2%) 21-26.
Aunque los síntomas GI son considerados raros en la infección por coronavirus, estudios anteriores de otros coronavirus, así como la experiencia con el SARS-CoV-2 sugieren que los vómitos y la diarrea pueden ser los síntomas de presentación en adultos y en hasta el 10% de los niños; los que son seguidos luego de los clásicos síntomas respiratorios. Wang et al., reportaron que 10.1% de los pacientes adultos con COVID-19 se presentó inicialmente con diarrea y vómitos 1 a 2 días antes del desarrollo de fiebre y disnea 21,24.
Llamativamente, porcentajes variables de pacientes con COVID-19 presentan solo síntomas GI. En una de las series 3,4% de los pacientes con COVID-19 no presentó síntomas respiratorios, pero si manifestaciones GI. Por otro lado, Luo S y col. reportaron que el 16% de 1141 casos confirmados de COVID-19 se presentó solo con síntomas gastrointestinales. De estas manifestaciones la pérdida del apetito fue el síntoma más frecuente (98%); seguida de las náuseas (73%); los vómitos (65%), la diarrea (37%) y el dolor abdominal (25%). La combinación de náuseas y vómitos se vio en 20% de los casos; dolor abdominal y diarrea en 9%; y la combinación de todos los síntomas gastrointestinales en 7% de los pacientes 21-22,24,27.
Se ha sugerido que el SARS-CoV-2 podría infectar no solo por vía respiratoria, sino también a través del tracto gastrointestinal. Esto no es de extrañar, considerando que el virus es capaz de infectar las células mediante la unión de su proteína espícula al receptor enzima convertidora de angiotensina 2 (ACE2), que no se expresa exclusivamente en el tracto respiratorio, sino también en el epitelio gastrointestinal y otros tejidos 21,24. El ARN de SARS-CoV-2 se ha detectado en material de biopsia del tubo digestivo, en muestras de hisopos anales/rectales y en muestras de heces de pacientes con COVID-19, aún después de la eliminación del virus del tracto respiratorio superior e incluso después del alta. Todo lo anterior sugiere que SARS-CoV-2 puede adquirirse por vía fecal-oral y replicarse activamente en las células gastrointestinales. Los niños no son muy proclives a prestar atención a la higiene de manos, por lo cual la posibilidad de infección a través del tracto digestivo, por transmisión fecal-oral, podría ser mayor en ellos y los síntomas gastrointestinales, como primera manifestación, pudiera ser más frecuente que en los adultos; e incluso el diagnóstico ser pasado por alto cuando la enfermedad cursa solo con síntomas gastrointestinales. Un estudio realizado por Santana Santos, en niños, sobre la duración de eliminación de virus en las heces concluye que el SARS-CoV-2 parece estar presente en ellas por más tiempo que en tracto respiratorio Más aún, la diseminación del virus puede darse en la fase prodrómica, con eliminación del virus en su punto más alto al inicio de los síntomas 21-25.
Existe evidencia que indica que es posible la transmisión de la infección, a pesar de la ausencia de síntomas o la presencia de síntomas gastrointestinales leves. Los profesionales al cuidado de la salud de niños deberían identificar prontamente a los pacientes con síntomas gastrointestinales en el contexto de esta pandemia y explorar la duración de la infectividad 21-22,24-25.
El hígado también se ve afectado en el curso de la enfermedad, de modo leve a severo, que en ocasiones es el reflejo de la severidad de la enfermedad. No obstante, en general la lesión hepática es leve y transitoria. El daño hepático se expresa con elevación de aminotransferasas, hipoproteinemia y prolongación del tiempo de protrombina. La incidencia de la afectación hepática es variable (14,8% a 78%). Ésta, en pacientes con COVID 19, puede ser debida a infección viral de las células hepáticas; inflamación sistémica inducida por la tormenta de citoquinas; por la hipoxia inducida por la neumonía o por hepatotoxicidad de la medicación utilizada, incluyendo Remdesivir e hidroxicloroquina. Datos recientes sobre la secuenciación de RNA en células individuales, de dos cohortes diferentes, revelaron un enriquecimiento significativo de la expresión de ACE2 en los colangiocitos (59.7% de las células) en lugar de los hepatocitos (2.6% de las células), sugiriendo que el COVID -19 podría orientarse a causar daño directo a los ductos biliares intrahepáticos. Se ha reportado además afectación pancreática, manifestada por niveles anormales de Lipasa y amilasa, sin presentar síntomas de pancreatitis severa 21,28-30.
Manifestaciones cutáneas
La piel es el primer contacto con el medio externo y la barrera más grande del sistema inmune innato. Es capaz de mostrar signos de enfermedades locales y sistémicas. Numerosos virus expresan síntomas cutáneos, que pueden ser específicos o inespecíficos. Existe evidencia previa de dermatosis asociadas a otros sub-tipos de coronavirus. Una primera descripción de lesiones dermatológicas en COVID-19 hace referencia a un 20% de manifestaciones cutáneas 31.
Así mismo, al COVID-19 ya se han relacionado 32-33:
• Dermatosis observadas comúnmente con otros virus como los exantemas, la urticaria y la pitiriasis rosada.
• Exacerbación de dermatosis previas como la dermatitis atópica y la psoriasis.
• Dermatosis relacionadas a la medicación, conocidas como farmacodermias.
• Dermatosis relacionadas a las medidas higiénicas como las dermatitis de contacto.
• Dermatosis relacionadas a los equipos de protección (barbijos) como las dermatitis de contacto, el acné, la rosácea.
• Dermatosis relacionadas a estrés como la alopecia areata y psicodermatosis.
Actualmente han sido descriptos 5 patrones dermatológicos asociados a COVID-19 34:
1-Exantemático: En un 47%, del tipo Polimorfo, aunque en su mayoría maculo-papular, localizado generalmente en tronco, asintomático o levemente pruriginoso. En algunos casos puede ser del tipo purpúrico semejante al observado en fiebre-dengue. Suelen presentarse junto con los síntomas respiratorios. Duran aproximadamente 10 a 14 días y se resuelven en forma espontánea 31,34-37.
2-Urticariforme: En un 19%, con habones asociados o no a angioedema, de predominio en tronco y palmas, muy pruriginoso. Suelen presentarse junto con los síntomas respiratorios. Duran aproximadamente 7 días 31,34,36,38.
3-Pseudoperniosis o Perniosis-like: En un 19%, con máculas eritematosas, vesículas o pústulas, localizadas en pies, manos y orejas, en ocasiones dolorosas. Se presentan generalmente en fases tardías de la enfermedad en niños jóvenes asintomáticos o paucisintomáticos. Duran aproximadamente 14 días. Se relaciona a buen pronóstico 34,39.
4-Vesiculoso: En un 9%, con vesículas monomorfas tipo varicela-like, localizados en tronco y extremidades. Suelen presentarse previo a los demás síntomas o en fases tempranas de la enfermedad. Duran aproximadamente 10 días 33-34.
5-Livedoide: En un 6%, con máculas eritematosas retiformes (aspecto de red) y/o Necrosis, localizados preferentemente en miembros y de manera unilateral. Descrito en su mayoría en adultos mayores. Si es persistente o necrótico se relaciona a mal pronóstico, asociándose a mortalidad en 10% de los casos 34,40.
De estos patrones, los más observados en niños son el Exantemático, el Urticariforme y la Pseudoperniosis 34.
Los dos primeros son inespecíficos, ya que pueden relacionarse a otras causas como las infecciosas distintas al COVID-19, las farmacológicas y/o las alérgicas.
La Pseudoperniosis o Perniosis-like parecería ser la más específica de todas, aunque suele presentarse en etapas tardías de la enfermedad 34.
Además de estas manifestaciones, actualmente se ha descrito la relación entre COVID-19 y Enfermedad de Kawasaki, ya descrita anteriormente con otros tipos de Coronavirus en 2005 y 2015 41-42.
Entre los criterios establecidos para enfermedad de Kawasaki, 4 corresponden a manifestaciones cutáneo-mucosas: inyección conjuntival, alteraciones en la mucosa oral, exantema y alteración de extremidades. La Inyección conjuntival suele presentarse hasta en 85% de los casos y suele ser bilateral y no supurativa. La mucosa oral se altera hasta en un 90% de los casos, observándose labios secos, enrojecidos y fisurados, lengua aframbuesada y eritema orofaríngeo difuso. El exantema se presenta hasta en un 80% de los casos y es del tipo polimorfo, iniciándose frecuentemente en el área perineal. Las extremidades muestran cambios hasta en 70% de los casos, evidenciándose eritema y edema palmo-plantar en estadios iniciales, que posteriormente se descaman en la fase de convalecencia. Otras de las manifestaciones cutáneas observadas en la enfermedad de Kawasaki, aunque no forma parte de los criterios diagnósticos, es la inflamación e induración en el sitio de la BCG 43-44.
Generalmente la enfermedad de Kawasaki se presenta en etapas tardías de la infección por SARS-CoV2 y se asocia a Síndrome Inflamatorio Multisistémico 45-46.
Diagnóstico en Lesiones cutáneas
Según el tipo de lesión y el tiempo de aparición de las mismas con el resto de las manifestaciones presentes en la infección por SARS-CoV2, podemos inferir la utilidad de los diferentes métodos diagnósticos disponibles (34). Así, el RT-PCR sería útil en lesiones vesiculosas. La serología tendría su mayor valor en las Perniosis-like y la Enfermedad de Kawasaki (34,45-46). Tanto la RT-PCR y la Serología podrían ser útiles en los Exantemas, las lesiones Urticariformes y las Lívedo reticularis 34-36,38,40. La Histopatología no muestra características específicas para COVID-19 en ninguna de éstas lesiones, aunque puede ser de utilidad a la hora de evaluar diagnósticos diferenciales, principalmente las farmacodermias.
Tratamiento de Lesiones Cutáneas
El tratamiento de las lesiones cutáneas observadas en pacientes con SARS-CoV-2 es aún desconocido, aunque actualmente se centra en el manejo de la infección, medidas generales y alivio de los síntomas 34.
En los Exantemas, Urticarias y Lesiones vesiculosas se prescriben: Antihistamínicos, emolientes y en ocasiones corticoides tópicos 34,36,38.
En las lesiones acro-isquémicas: Evitar el frío, emolientes y en casos graves heparina de bajo peso molecular 34,39-40.
En enfermedad de Kawasaki (ver sección de Kawasaki y Síndrome Inflamatorio Multisistémico).
Manifestaciones neurológicas
Existe un conjunto creciente de observaciones que sugieren una amplia gama de manifestaciones neurológicas en pacientes con COVID-19, entre los que se mencionan dolor de cabeza, anosmia, ageusia, convulsiones, coma, encefalitis, miopatías, síndrome de Guillain-Barré (SGB) y eventos cerebrovasculares agudos que incluyen accidente cerebrovascular isquémico, hemorragia intracerebral y trombosis del seno venoso cerebral 47-59.
Hasta el 20% de los pacientes con COVID-19 que requieren ingreso en la unidad de cuidados intensivos (UCI), son debidos a problemas neurológicos, y los pacientes con COVID-19 en la UCI que desarrollan déficits neurológicos, tienen un mayor riesgo de mortalidad 60.
El SARS-Cov2, que posee una alta homología con el SARS-Cov1 y el MERS, parece tener la capacidad de dañar los sistemas nerviosos central y periférico a través de formas directas e indirectas (Gráfico 2) 50,61-62.
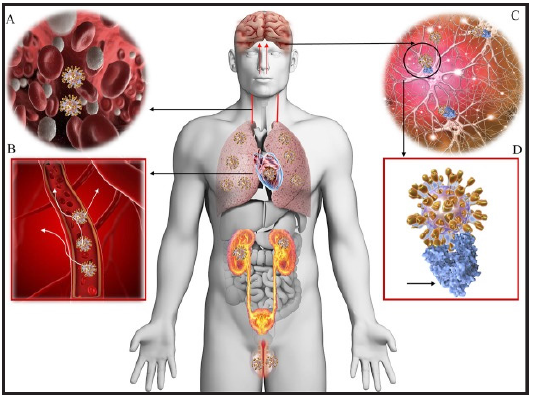
Gráfico 2. Fisiopatología de las anormalidades neurológicas en covid-19: Distribución tisular de receptores ACE2 en humanos. La viremia (A) disemina el virus COVID-19 en todo el cuerpo a través del torrente sanguíneo (B). El neurotropismo puede ocurrir a través de la circulación y / o una ruta transcripcional nasal superior que permite que el COVID-19 llegue al cerebro (C) y se una a los receptores ACE2 (D, azul). COVID-19 atraca en el ACE2 a través de la proteína espiga (D, espigas doradas). Se muestran los pulmones, el corazón, los riñones, los intestinos, el cerebro y los testículos que son bien conocidos por expresar receptores ACE2 y son posibles objetivos de COVID-19. Modificada de: Baig AM, Khaleeq A, Ali U, Syeda H. Evidence of the COVID-19 Virus Targeting the CNS: Tissue Distribution, Host-Virus Interaction, and Proposed Neurotropic Mechanisms. ACS Chem Neurosci. 2020;11(7):995-998 62
Se ha descrito una entrada directa de SARS-Cov2 en el cerebro para otros coronavirus y puede desempeñar un papel en la posible contribución del SARS-Cov2 en la desmielinización o la neuro-degeneración 47,61-63 La diseminación de COVID-19 en la circulación sistémica o a través de la placa cribiforme del hueso etmoides durante una fase temprana o posterior de la infección puede provocar afectación cerebral, como se informó anteriormente en pacientes afectados por el SARS-CoV. La presencia del virus COVID-19 en la circulación general, comprensiblemente, le permite pasar a la circulación cerebral, donde el movimiento lento de la sangre dentro de la microcirculación podría ser uno de los factores que pueden facilitar la interacción de la proteína de la punta del virus COVID-19 con ACE2 expresada en el endotelio capilar. La gemación posterior de las partículas virales del endotelio capilar y el daño al revestimiento endotelial pueden favorecer el acceso viral al cerebro. Una vez dentro, su interacción con los receptores ACE2, expresada en las neuronas, puede iniciar un ciclo de gemación viral acompañado de daño neuronal sin inflamación sustancial como se ha visto con casos de SARS-CoV en el pasado. Es importante mencionar aquí que, mucho antes de que ocurran los daños neuronales anticipados propuestos, las rupturas endoteliales en los capilares cerebrales acompañadas de sangrado dentro del tejido cerebral, pueden tener consecuencias fatales en pacientes con infecciones por COVID-19. El movimiento del virus COVID-19 al cerebro a través de la placa cribiforme cerca del bulbo olfatorio puede ser una vía adicional que podría permitir que el virus llegue y afecte al cerebro. Además, los hallazgos como una alteración del sentido del olfato o la hiposmia en un paciente COVID-19 en etapa temprana sin complicaciones deben investigarse a fondo para detectar la participación del sistema nervioso central (SNC) 62-65.
Las capacidades neurotrópicas y neuroinvasivas de los coronavirus se han descrito en humanos. Los mecanismos de las infecciones por COVID-19 en el daño del sistema nervioso incluirían así infección directa, vía a través de la circulación sanguínea, vía neuronal, lesión por hipoxia, lesión inmune, y además a través del receptor de la enzima convertidora de angiotensina-2 (ACE2) en células neuronales y de la glía y otros posibles mecanismos (Gráfico 3). Actualmente se cree que COVID-19, en conjunto con los mecanismos inmunes del huésped, puede convertir la infección aguda en un proceso persistente que puede conducir a enfermedades neurológicas 47,63,66.

Gráfico 3 Patogenia de la lesión del sistema nervioso causada por coronavirus. ACE2: enzima convertidora de angiotensina 2; BHE: barrera hematoencefálica; IL: interleucina; CMH: Complejo mayor de histocompatibilidad; SIRS: síndrome de respuesta inflamatoria sistémica. Modificada de: Wu Y, Xu X, Chen Z, Duan J, Hashimoto K, Yang L, et al. Nervous system involvement after infection with COVID-19 and other coronaviruses. Brain Behav Immun. 2020;87:18-22 66
Para un mejor abordaje clínico, es posible dividir las manifestaciones neurológicas en 3 categorías 67:
- SNC: cefalea, mareo, alteración de la conciencia, ataxia, ictus, epilepsia.
- Sistemia Nervioso Periférico (SNP): hiposmia, hipogeusia, síntomas visuales, neuralgias, SGB.
- Músculo: mialgias, aumento de creatinkinasa (CK) en sangre.
La disfunción del olfato y el gusto se ha informado ampliamente en pacientes con COVID-19 en las comunidades europeas 51,68. Estas deficiencias fueron más frecuentes entre los pacientes con COVID-19 leve que entre aquellos con COVID-19 grave 67.
Varios estudios han demostrado que la disfunción del gusto en pacientes con COVID-19 parece ser más común que la disfunción olfativa y que 10.2-22.5% de los pacientes con COVID-19 tienen disfunción del gusto sin disfunción olfatoria. Por lo tanto, la ageusia puede ser un síntoma específico en pacientes con COVID-19, que es diferente a la observada por congestión respiratoria superior en la gripe o la mala interpretación de la percepción del gusto debido a la pérdida de la función olfatoria. El deterioro de las funciones olfativas y gustativas en pacientes con COVID-19 probablemente se deba a la infección por SARS-Cov2 de las células epiteliales de la mucosa nasal y oral. Altas densidades de ACE2 están presentes en las células epiteliales olfativas, de la nasofaringe y la mucosa oral. Al unirse al ACE2 en la mucosa nasal y oral, el SARS-Cov2 puede inhibir la función de las células receptoras sensoriales que median el olfato y el gusto 51,61,63-65.
Estudios sobre el sistema nervioso periférico
Gutiérrez-Ortiz y cols. 52 informaron haber tratado a dos pacientes que presentaban anomalías en el movimiento ocular compatibles con un diagnóstico de síndrome de Miller-Fisher y polineuritis craneal. Sus síntomas incluyen anosmia, ageusia, arreflexia, ataxia, oftalmoplejía inter nuclear y parálisis oculomotora fascicular.
El síndrome de Guillain-Barré, asociado con parálisis ascendente y cierto grado de pérdida sensorial o lesión del nervio craneal, ocurre comúnmente después de ciertas infecciones bacterianas o virales. Se ha informado de SGB en pacientes que desarrollaron la infección por SARS-Cov en 2002-2003. Ahora, varios informes han esbozado la neuropatía axonal, desmielinización o parálisis craneal típica del SGB en pacientes con COVID-19. Se cree que el SGB ocurre como resultado del "mimetismo molecular", que se refiere a la reactividad cruzada de las inmunoglobulinas naturales, formadas en respuesta a un antígeno bacteriano o viral, con proteínas específicas en la mielina, el axón o la unión neuromuscular. Las citocinas activadas por SARS-Cov2 también pueden desencadenar vasculitis en y alrededor de nervios y músculos, con o sin mimetismo molecular 53,63. Potencialmente, puede ocurrir una invasión directa del virus a los nervios periféricos, pero la falta de cualquier hallazgo de SARS-Cov2 en el LCR hasta la fecha hace que esto sea poco probable 62. Por ahora, el patrón de presentaciones clínicas y la respuesta rápida a la Ig IV favorece una etiología inmunomediada para la neuropatía periférica y craneal en pacientes con COVID-19 53,59,69-71.
Accidentes cerebrovasculares
Se ha informado de la formación de coágulos sanguíneos pequeños o grandes, tanto en el cerebro como en muchos otros órganos, en un número significativo de pacientes con Sars-Cov2 47,54,56,58,63. En el estudio de Li et al. 56, 13 de los 221 pacientes con COVID-19 tenían evidencia confirmada por imágenes de enfermedad cerebrovascular. Oxley y cols. 54 también destacaron que las personas jóvenes y sanas pueden presentar accidentes cerebrovasculares grandes, con o sin síntomas aparentes de COVID-19, como tos o fiebre.
Convulsiones, Encefalopatía tóxico-metabólica, Encefalitis, Meningitis
Hay varios informes de casos de pacientes con COVID-19 que se presentan en hospitales con fiebre, rigidez de nuca, confusión, cambios en el estado mental y / o convulsiones. En estudios de pacientes graves y síndrome de dificultad respiratoria aguda (SDRA) (N = 58), el 65% tenía confusión y el 69% tenía agitación. Entre los 13 pacientes en este estudio que se sometieron a resonancia magnética debido a características encefalopáticas inexplicables, el 62% (8/13) tuvo un aumento leptomeníngeo, el 23% (3/13) tuvo accidente cerebrovascular isquémico, y los 11 pacientes que se sometieron a imágenes de perfusión tuvieron hipoperfusión frontotemporal bilateral 72.
El análisis de la literatura, aún limitada de COVID-19, favorece que el SARS-Cov2 desencadene una encefalopatía inmunomediada más que una encefalopatía viral directa. La activación del SARS-Cov2 de las citocinas como la interleucina-1, la interleucina-16 y el TNF-alfa causa lesiones en la barrera hematoencefálica (BHE). Con el aumento del daño a la BHE, las citocinas penetran el parénquima cerebral, especialmente en los lóbulos temporales donde la BHE es más débil. La fuerte respuesta inflamatoria y la entrada de material sanguíneo en el cerebro producen convulsiones y encefalopatía 66. Una infección viral directa de las neuronas para causar convulsiones también es posible. Con la penetración del contenido sanguíneo en el cerebro, las partículas virales pueden ingresar y dañar las neuronas directamente. Las neuronas tienen ACE2, y los estudios patológicos post mortem han detectado SARS-Cov1 (por microscopía electrónica) en algunas neuronas 65. Sin embargo, con la excepción de informes de casos con PCR positiva en LCR para SARS-Cov2 en dos pacientes con meningitis / encefalitis y uno con enfermedad desmielinizante 56-57,59, los demás estudios en los que se realizó una prueba de LCR no encontraron SARS-Cov2 por PCR 72. Esta falla en la búsqueda de rastros de SARS-Cov2 en la mayoría de los estudios reportados de pacientes con encefalopatía por COVID-19 podría deberse a la falta de técnicas de prueba óptimas en el LCR para este virus, o quizá a la carga viral en el LCR / cerebro. Los pacientes con COVID-19 que presentan dolor de cabeza agudo, rigidez de nuca, convulsiones y confusión pueden experimentar meningitis 59. Las meninges son ricas en vasos sanguíneos y también contienen altos niveles de ACE2. El daño a estos vasos sanguíneos y la inflamación de las meninges a su vez pueden provocar síntomas de meningitis 66.
Compromiso Muscular
En el estudio observacional de Mao et al., Los pacientes con COVID-19 en la UCI tenían múltiples etiologías de letargo, atrofia muscular y debilidad. Sin embargo, sus síntomas musculares fueron más allá de lo que se esperaría en un entorno de cuidados críticos. Informaron que el 19.3% de sus pacientes con COVID-19 grave tenían evidencia de lesión muscular marcada 67.
La lesión muscular y los altos niveles de CK en pacientes con COVID-19 en la UCI pueden atribuirse a la neuropatía y / o miopatía de cuidados críticos. Los medicamentos sedantes y paralizantes administrados a los pacientes para los protocolos de la UCI también pueden debilitar a estos pacientes haciéndolos incapaces de pararse o caminar. Sin embargo, el curso temporal de la debilidad muscular severa en pacientes con COVID-19 sugiere que puede estar involucrada una etiología de vasculitis o miositis. Con respecto al músculo cardíaco, existe evidencia de que tanto la miocarditis debida al SARS-Cov2 como el infarto de miocardio debido a la tormenta de citocinas, la hipercoagulabilidad y la isquemia pueden ocurrir al mismo tiempo 63.
Existe una propuesta de agrupar las manifestaciones neurológicas del Sars- Cov 2 (NeuroCovid) en 3 etapas, con objetivos terapéuticos 63:
- En NeuroCovid Etapa I, el daño del virus se limita a las células epiteliales de la nariz y la boca.
- En NeuroCovid Etapa II, los pacientes pueden experimentar coágulos sanguíneos en su cerebro o tener autoanticuerpos que dañan sus nervios y músculos periféricos.
- En NeuroCovid Etapa III, la tormenta de citoquinas daña la barrera hematoencefálica y los pacientes pueden desarrollar convulsiones, coma o encefalopatía.
Los efectos del coronavirus en los niños parecen menos graves y, a menudo, el virus está presente, pero los niños son asintomáticos.
Dong et al 73, informaron una serie de más de 2000 niños con sospecha o confirmación de COVID-19. Los autores encontraron que el 4% de los casos confirmados virológicamente tenían infección asintomática, y esta tasa casi con certeza subestima la tasa real de infección asintomática porque es improbable que muchos niños asintomáticos sean examinados. Entre los niños sintomáticos, el 5% tenía disnea o hipoxemia (un porcentaje sustancialmente más bajo que lo que se informó en adultos), y el 0.6% progresó a síndrome de dificultad respiratoria aguda o disfunción del sistema multiorgánico (una tasa que también es más baja que la observada en adultos). Los niños asintomáticos aún pueden albergar el virus, con efectos hasta ahora desconocidos sobre su estado de salud más adelante en la vida, incluido el desarrollo cerebral. Los informes de Sars-Cov2 en niños publicados hasta ahora, en su mayoría carecen de información detallada sobre la frecuencia y resultados de los hallazgos neurológicos en la presentación clínica y motivos de ingreso hospitalario.
Se han reportado series de casos de accidente cerebro vascular embólico-trombótico, encefalitis, afectación neurológica en el contexto del síndrome inflamatorio multisistémico asociado al COVID 74-75, entre otros. Schupper et al 74 informan haber encontrado varios niños con esta afección y destacando dos con complicaciones neurológicas importantes.
En un estudio de serie de casos, 75 de pacientes menores de 18 años que presentaron infección por SARS-CoV-2 y síntomas neurológicos en el Hospital Great Ormond Street para Niños, Londres, Reino Unido, de los 27 niños con síndrome inflamatorio multisistémico pediátrico asociado a COVID-19, 4 pacientes (14.8%) que previamente estaban sanos tenían síntomas neurológicos de nueva aparición. Los síntomas incluyeron encefalopatía, cefalea, signos del tronco encefálico y cerebeloso, debilidad muscular y reflejos reducidos. Los 4 pacientes requirieron ingreso en la unidad de cuidados intensivos para el tratamiento del síndrome inflamatorio multisistémico pediátrico COVID-19. Se observaron cambios en la RMN cerebral de los 4 pacientes. En los 2 pacientes cuyo líquido cefalorraquídeo se analizó, las muestras fueron acelulares, sin evidencia de infección en la reacción en cadena de la polimerasa o el cultivo (incluidos los resultados negativos de la reacción en cadena de la polimerasa SARS-CoV-2) y los resultados negativos de la prueba de bandas oligoclonales. En los 3 pacientes que se sometieron a electroencefalografía, se encontró un ligero exceso de actividad lenta. El receptor de N- metil- D- aspartato, la glucoproteína oligodendrocítica de mielina y los autoanticuerpos con acuaporina-4 tuvieron resultados negativos en todos los pacientes. En los 3 pacientes que se sometieron a estudios de conducción nerviosa y electromiografía, se observaron cambios miopáticos y neuropáticos leves. Se observó una mejoría neurológica en todos los pacientes, y 2 se recuperaron por completo al final del estudio.
Manifestaciones Cardiovasculares
Las manifestaciones cardiológicas encontradas en esta nueva forma de presentación donde el SARS-CoV-2 induce a un síndrome de Kawasaki hiperinflamatorio muchas veces asociado con un síndrome de activación de macrófagos (SAM) hasta ahora no están bien definidos; no así como los están en la enfermedad de Kawasaki (EK) en sus varias presentaciones tanto la típica, como la incompleta, la atípica y el síndrome de shock Kawasaki (SSK) 43.
Según lo reportado en la literatura acerca de pacientes con EK no tratados, los mismos presentan un riesgo de 25% de padecer aneurisma de la arteria coronaria. La clasificación actual de afectación coronaria utilizando el Z-score: Sin afectación: siempre <2; dilatación: 2 a <2.5 o si inicialmente <2 con una disminución de la puntuación Z durante el seguimiento ≥1; aneurisma pequeño: ≥2.5 a <5; aneurisma medio: ≥5 a <10 y dimensión <8 mm; aneurisma grande o gigante: ≥10 y dimensión ≥8 mm. La prevalencia de anomalías en las arterias coronarias dentro de un ensayo clínico de tratamiento inicial fue del 23% a las 4 semanas del ingreso hospitalario, reducida a 8% con 4 infusiones de dosis bajas de IG, y en un subsiguiente ensayo de IG de dosis alta única, esto se redujo al ≈4%. Además de la afectación coronaria, el compromiso miocárdico con disfunción de ventrículo izquierdo (VI) está presente en el 20% de los pacientes en el momento del diagnóstico y se asocia con dilatación de la arteria coronaria; aproximadamente el 5% de los niños con EK presentarán colapso cardiovascular; aparte de estas manifestaciones también encontraremos disfunción miocárdica, pericarditis, derrame pericárdico, miocarditis, afectación de válvulas cardiacas con insuficiencia y más raramente taponamiento cardiaco 43.
En la primera serie de casos descritos en 4 centros de nivel terciario en Paris, refirieron 20 pacientes ingresados a UCIP, todos en shock, vasoplejía, disfunción miocárdica con una fracción de eyección (FE) de media 35%, afectación de enzima cardiaca troponina media 269 (rango de resultados: 31-4607 ng/mL); todos estos pacientes padecieron miocarditis aguda y 4 de ellos presentaron derrame pericárdico. En diecinueve de los veinte pacientes se identificó SARS-CoV-2 por PCR y/o por serología, y un paciente por tomografía computarizada de tórax con hallazgo típico de Infección por SARS-CoV-2. Todos fueron diagnosticados como EK atípico, todos los pacientes sobrevivieron y salieron de UCIP con FE conservada y no requirieron oxigenación de membrana extracorpórea veno-arterial (76). A diferencia de esta serie de casos se observó un reporte de caso con infección por SARS-CoV-2 cumpliendo los criterios de EK incompleto, donde en el ecocardiograma se evidenció hallazgo sugestivo de miocarditis, función del VI levemente disminuida, insuficiencia leve de la válvula mitral, sin derrame pericardio y coronarias normales; pero a pesar del tratamiento la paciente requirió en el séptimo día de enfermedad oxigenación de membrana extracorpórea utilizado por 6 días, luego se observó mejoría, y destete de la misma 77.
En otro estudio retrospectivo en Paris, Francia 21 pacientes fueron ingresados con diagnóstico de EK e identificados con SARS-CoV-2 por PCR y/o por serología; el hallazgo ecocardiográfico demostró anormalidades en la arteria coronaria en ocho pacientes (38%), después de una mediana de 7,5 días de fiebre (rango 5-11), que consistió en dilataciones (puntaje z-score entre 2.0 y 2.5) en cinco pacientes (24%) e hiper-refringencia de la arteria coronaria en tres pacientes (14%). No se identificaron aneurismas coronarios. Además, se detectó derrame pericárdico en 10 pacientes (48%), miocarditis en 16 pacientes (76%) con FE entre 10% y 57%. En esta serie consideraron que doce pacientes (57%) tenían SSK, catorce (67%) pacientes recibieron agentes inotrópicos por miocarditis con disfunción cardíaca. Todos los pacientes fueron dados de alta. No se registraron muertes 78.
En la serie descripta en Bergamo, Italia dividieron en 2 grupos, demostrando mayores casos de EK tras el brote de SARS-CoV-2. Siendo el grupo 1 (enero 2015 a 17 de febrero de 2020) 19 casos de EK y grupo 2 (Periodo desde 18 de febrero a abril 2020) 10 casos de EK. Concentrándonos en el grupo 2 en donde se identificaron 8 pacientes con SARS-CoV-2 por PCR y/o por serología, se observó que cinco (50%) de ellos fueron EK incompletos. En dos pacientes (20%) la ecocardiografía detectó un aneurisma coronario izquierdo (> 4), 4 pacientes presentaron disfunción con FE disminuida, 2 pacientes presentaron derrame pericárdico y 4 pacientes presentaron afectación de válvula mitral con insuficiencia. Cinco (50%) de diez pacientes en el grupo 2 cumplieron los criterios para SSK debido a hipotensión y signos clínicos de hipoperfusión. Todos los pacientes del grupo 1 no presentaron afectación coronaria. Los del grupo 2 fueron dados de alta y están en control 46. Igualmente, en Turín, Italia, se obtuvo un reporte de 2 casos; identificando SARS-CoV-2 por serología IgM e IgG, con compromiso cardíaco por ecocardiograma (función sistólica reducida y derrame pericárdico), troponina T elevada con CK-MB normal y signos electrocardiográficos de lesión miocárdica 79.
La EK es una causa común de enfermedad cardiaca adquirida en niños en los Estados Unidos y países desarrollados, por todo lo antes visto no está claro si el COVID-19 causa EK o es un síndrome que imita a EK, presentando un riesgo significativo de trombosis e infarto de miocardio en la edad adulta 80.
Síndrome inflamatorio multisistémico pediátrico asociado a infección por SARS-COV-2
Los niños tienen que soportar una carga médica mínima en la pandemia del COVID-19. Los datos epidemiológicos de muchos países muestran que los niños corresponden a una minoría importante 81.
Las publicaciones de varios países han confirmado que las enfermedades graves y la muerte por COVID-19 entre los niños son raras, con estimaciones precisas no disponibles debido a la ausencia de verdaderos denominadores de población 73.
La mayoría de los niños son asintomáticos o presentan síntomas leves de la infección por SARS-CoV-2. Sin embargo, informes recientes de Europa y Estados Unidos respaldan la aparición de un nuevo fenómeno con una respuesta hiperinflamatoria significativa en niños previamente sanos, relacionados con este virus. Los niños afectados pueden requerir cuidados intensivos pediátricos y la evaluación multidisciplinaria, de emergentólogos, infectólogos, intensivistas, cardiólogos, hematólogos, nefrólogos, neurólogos, cirujanos, inmunólogos y reumatólogos 82.
Este síndrome raro comparte características comunes con otras afecciones inflamatorias pediátricas que incluyen: enfermedad de Kawasaki, miocarditis con shock cardiogénico, síndromes de shock tóxico por estafilococos y estreptococos, sepsis bacteriana y síndromes de activación de macrófagos (SAM). También puede presentarse con síntomas abdominales inusuales con marcadores inflamatorios excesivos 84-86. Luego de las publicaciones de diferentes países, el Centro para el Control de Enfermedades (CDC) ha emitido una alerta de emergencia 84.
La presentación clínica es variable, y la mayoría de los centros informan síntomas gastrointestinales (GI) significativos, enfermedad cardíaca, síntomas respiratorios leves o ausentes y una incidencia variable de erupción cutánea, ojos rojos y cambios en la mucosa oral. Como se trata de una afección emergente, se han utilizado varios nombres: "Kawashocky", "Coronasacki", shock hiperinflamatorio en niños con COVID-19, trastorno inflamatorio asociado a COVID-19 pediátrico (PCAID), síndrome inflamatorio multisistémico pediátrico (PMIS) y síndrome inflamatorio multisistémico en niños (SIM-Pediátrico) 76,82-84.
El SIM-Pediátrico puede presentarse en cualquier momento, aunque según informes recientes (principalmente anecdóticos), a menudo ocurre entre 1 y 6 semanas después de la infección, y puede superponerse con una presentación respiratoria aguda de COVID-19. Se puede presentar como una EK clásica con aneurismas de la arteria coronaria y manifestaciones extracardiacas. No está claro si este síndrome es exclusivo de los niños o si ocurre en adultos con COVID-19. Además de presentar potencialmente algunos o la mayoría de los síntomas asociados con EK (inflamación / hinchazón de manos y pies, cambios en las membranas mucosas / lengua de fresa, conjuntivitis no exudativa, erupción cutánea y linfadenopatía significativa unilateral), el SIM-Pediátrico puede presentarse con evidencia de falla multiorgánica incluyendo afectación neurológica, hiperferritinemia y shock cardiogénico o vasopléjico. La mayoría de los informes describen manifestaciones gastrointestinales significativas en la presentación, como vómitos, diarrea y dolor abdominal intenso 81-82,84-86.
Diferentes trabajos en Europa y EEUU describen casos de Sars-Cov 2 simulando Kawasaki y SIM-Pediátrico, tratados en su mayoría con IGIV, corticoides y en algunos casos con biológicos (anti-IL6R y/o anti-TNF). 87-91.
A continuación, se presenta un algoritmo modificado de Hennon TR, et al 82 y Kavirayani A, et al 85 (Gráfico 4). Las mismas originalmente fueron creadas por un equipo multidisciplinario conformado por especialistas en emergencia pediátrica, intensivistas y especialistas en las áreas de enfermedades infecciosas, cardiología, reumatología y hematología. Las pautas se basan, en parte, en casos reportados (no publicados y publicados), recomendaciones de los CDC, el Departamento de Salud del Estado de Nueva York y el Royal College of Pediatrics and Child Health.
CONCLUSION
La proporción de casos confirmados en niños es relativamente pequeña.
La mayoría son asintomáticos o paucisintomáticos, con afecciones gastrointestinales, dermatológicas o neurológicas.
Un pequeño número de niños desarrolla respuesta inflamatoria sistémica.
Se puede presentar como una Enfermedad de Kawasaki (EK) clásica o incompleta con aneurismas de la arteria coronaria y manifestaciones extracardíacas.
La identificación del síndrome inflamatorio multisistémico asociado a Sars-Cov 2 redundará en el mejor manejo de estos pacientes.
Sería recomendable introducir en los protocolos diagnósticos de casos nuevos, los síntomas cutáneos, gastrointestinales, neurológicos y cardiovasculares asociados a la infección por SARS-CoV-2.

















