INTRODUCCION
La reducción o pérdida del efecto antibacteriano de un fármaco constituye lo que se denomina resistencia a los antibióticos y las propiedades o alteraciones de la bacteria que provocan actividad antimicrobiana reducida se lo denominan mecanismos de resistencia 1.
Los organismos multiresistentes a los antibióticos han sido reportados en todo el mundo en los últimos decenios 2. Si bien la mayoría de los pacientes con infecciones urinarias concurren a consultas ambulatorias y pueden presentar gérmenes resistentes en los urocultivos, cuando las infecciones por gérmenes Gram negativos son adquiridas en el hospital constituyen un desafío importante para la seguridad del paciente.
En un estudio preliminar sobre infección de la vía urinaria (IVU) intrahospitalaria, del tipo casos y controles, retrospectivo, encontramos que el uso previo de antibiótico fue el factor riesgo principal asociado a la presentación de IVU, en las que se aislaron bacterias Gram negativas productoras de Beta Lactamasa de Espectro Extendido (BLEE) 3.
En el año 1940 Abraham EP. y Chain E. en una breve carta al editor de la revista Nature, describieron por primera vez la enzima producida por la bacteria capaz de destruir la penicilina. La primera Betalactamasa fue identificada y aislada de Escherichia coli4. La penicilina había sido descrita en el año 1929 5.
Si bien el presente artículo se refiere a las IVU adquiridas en la comunidad, sin embargo, para comprender la importancia de este problema médico, mencionamos que, en Alemania, la urosepsis representa el 9-31% de todos los casos de sepsis y presenta una mortalidad del 20-40%, que es baja en comparación con la sepsis en general 6. Por otra parte, la detección de BLEE en las bacterias conlleva un lapso de internación más prolongado y por lo tanto un costo mayor 7. En un estudio de urosepsis, fueron aislados 42 cepas de Escherichia coli (64%), de las cuales 34 cepas (80%) eran productoras de BLEE y 14 cepas (21%) de Klebsiella pneumoniae, de las que 9 cepas (64%) fueron productoras de BLEE 8.
Varias publicaciones, originadas en el país, así como en el exterior, apuntan a que los uropatógenos que concentran la mayor parte de los casos de resistencia antibiótica son Escherichia coli y Klebsiella pneumoniae3,8-10.
La prevalencia de la resistencia no solo ha aumentado en las bacterias causantes de infecciones; sino también en la colonización intestinal de personas sanas. Las enterobacterias productoras de BLEE, principalmente del tipo CTX-M, han alcanzado niveles de pandemia a nivel mundial en pocos años y se calcula que existen en el mundo 1.753 millones de personas colonizadas 11. Las afirmaciones de los investigadores son impactantes, ya que identifican a la resistencia bacteriana a los antibióticos como una crisis de la salud de alcance mundial 12.
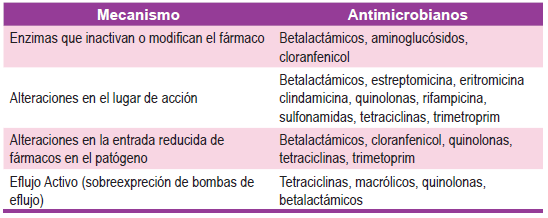
Los mecanismos de resistencia a los antibióticos son numerosos y afectan a los antibióticos de manera diferente, según detallamos en la Tabla 1 13,2.
Las betalactamasas son enzimas bacterianas que hidrolizan el enlace amida del anillo betalactámico por lo que protegen a los microorganismos de los efectos mortales de los antibióticos betalactámicos. Su producción es el mecanismo más importante de resistencia a estos antibióticos, especialmente en bacterias gramnegativas, causa predominante de las infecciones urinarias 2.
En la microbiología actual tiene mucha importancia la detección de los mecanismos de resistencia en los microrganismos gramnegativos, por su gran consecuencia para la clínica, la epidemiología y en general, para la salud pública. Existe aún controversias sobre cuál es la mejor técnica fenotípica para realizar las identificaciones, así como la interpretación de los resultados de la sensibilidad in vitro 14.
La incidencia de infecciones por Escherichia coli y Klebsiella productoras de BLEE aumentaron en los Estados Unidos entre los años 1997 al 2011. Las estimaciones apropiadas de las infecciones por BLEE cuando se combinan con otros mecanismos de resistencia a los antibióticos (ATB), permitirán la orientación adecuada de los recursos hacia la investigación, el descubrimiento de fármacos, la administración de antimicrobianos y la prevención de infecciones 15.
Es interesante mencionar, saliendo de ámbito de las infecciones urinarias, que un estudio muestra la alta prevalencia de Escherichia coli productora de BLEE en el ganado en Mecklemburgo-Pomerania Occidental, Alemania; hecho que abre la posibilidad del riesgo de transferencia entre el ganado y los trabajadores agrícolas de estas enterobacterias 16.
Es tan llamativa la diseminación de las BLEE en el mundo, que Canton R en una publicación lo llama “pandemia de BLEE” 17.
Las betalactamasas
Diversas y numerosas enzimas pueden modificar los antibióticos ya sea destruyéndolos o transformándolos en derivados inactivos. Las betalactamasas son enzimas que hidrolizan el enlace amida del anillo betalactámico. Una completa revisión de este tema fue publicado en el año 2005 18. La comprensión cabal del universo de estas enzimas requiere de una revisión de la clasificación de las betalactamasas. Son numerosas las betalactamasas que se han descrito y han recibido una gran variedad de nombres 19,20.
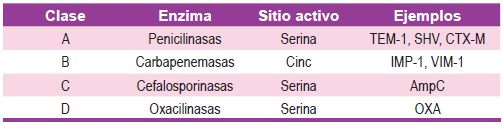
Las enzimas pueden clasificarse en función de su estructura primaria en cuatro clases moleculares (A a D), como vemos en la Tabla 2 19,21. Las Clase A y Clase C de betalactamasas son las más comunes y tienen un residuo de serina en el sitio activo, al igual que la clase D de B-Lactamasas. La clase B comprende el metalobetalactamasas 20.
Hace décadas, los plásmidos mediaban la resistencia de los antibióticos betalactámicos en Escherichia coli y otras enterobacterias que con mayor frecuencia portaban genes que codifican la clase A, enzimas como TEM-1 o SHV-1 o enzimas de clase D como OXA-1. Enzimas de clase B y C tenía un espectro de actividad más amplia pero casi siempre estaban codificados por genes de cromosomas y por lo tanto se limitan a especies bacterianas particulares 2.
Las enzimas también pueden clasificarse sobre la base de su espectro de sustrato y respuestas a los inhibidores, con un mayor número funcional de grupos. Tabla 3 19,22. Posteriormente esta clasificación fue actualizada por sus autores originales 23.
La incidencia de BLEE varía de acuerdo al área del globo en las que se originan los aislamientos 24-26.
El aumento de las resistencias de las enterobacterias ha sido progresivo desde la aparición de las primeras BLEE y ha llegado a afectar a los carbapenémicos con la aparición de carbapenemasas 27. El aumento de las BLEE conduce al aumento del consumo de carbapenémicos, hecho que puede favorecer la emergencia de las carbapenemasas.
La Klebsiella pneumoniae carbapenemasa, (KPC) es considerada la principal carbapenemasa de las enterobacterias. Su presencia genera un problema clínico serio debido a la falla en el tratamiento que induce su presencia 28.
En la literatura nacional encontramos publicaciones con respecto a las carbapenemasas originadas en pacientes hospitalizados, pero no identificamos un artículo que desarrolle específicamente KPC en IVU 29.
La metalobetalactamasa (metallo-β-lactamase) (MBL) fue descrita inicialmente en Japón y constituye una fuente importante de resistencia a los antibióticos de las bacterias que la producen 30,31.
Con estas consideraciones nos hemos propuesto hacer un estudio retrospectivo de un quinquenio, de los gérmenes aislados en las infecciones urinarias del Departamento de Microbiología de la Facultad de Ciencias Médicas de San Lorenzo, con el objetivo de determinar la prevalencia de los factores enzimáticos de resistencia encontrados in vitro en los urocultivos, en los gérmenes más prevalentes de las IVU.
MATERIALES Y METODOS
Se realizó un estudio observacional del tipo retrospectivo, de corte transverso de los urocultivos de pacientes de ambos sexos, mayores de 18 años, que acudieron a los Servicios de Consultorio Externo de Clínica Médica y Urgencias del Hospital de Clínicas de San Lorenzo por síntomas de infección urinaria en el periodo comprendido entre enero del 2015 hasta diciembre del 2018; y de junio a diciembre del 2019.
Se incluyeron todos los urocultivos procesados en el Laboratorio Central del Hospital de Clínicas en los que se aislaban uropatógenos con recuento de colonias ≥ 105 UFC/mL según criterios de Kass 32. Se excluyeron los urocutivos polimicrobianos, los que no contaban con antibiograma y los que contaban con datos clínicos incompletos.
Las muestras de orina fueron remitidas para su cultivo en Agar Sangre (Biomerieux, Francia) y Agar Eosina Azul de Metileno (Britania, Argentina) incubadas en aerobiosis a 35 ± 2 °C por 24-48 horas, siguiendo el protocolo de la Sociedad Española de Enfermedades Infecciosas y Microbiología Clínica 2002 33.
La identificación bacteriana fue realizada por el sistema automatizado VITEK® 2C (Biomerieux, Francia) y la tecnología MALDI-TOF MS (espectrofotometría de masa) con el sistema VITEK®MS (Biomerieux, Francia) en el último año. Para definir la sensibilidad antimicrobiana in vitro y la presencia de BLEE se determinaron las concentraciones inhibitorias mínimas (CIM) de acuerdo con las recomendaciones del Clinical and Laboratory Standards Institute (CLSI) 34-36.
La presencia de BLEE fue confirmada por el Advanced Expert System™ (AES) del aparato automatizado. Para la detección de las carbapenemasas de clase A (KPC) se llevó a cabo el test de ácido borónico (APB) y para la detección de las carbapenemasas de clase B (metalobetalactamasa, MBL) se realizó la prueba de ácido etilendiaminotetraacétido (EDTA). El test es positivo cuando se observa sinergia o ensanchamiento del halo de inhi¬bición entre los discos de los carbapenémicos y el disco del medio 14,35,36.
Comité de Ética de la Investigación. De acuerdo con el Dictamen del Comité de Ética de la Investigación, DI/FCM/UNA Nº 166/2020, del 23/07/2020, en el trabajo no se observan limitaciones éticas para su publicación.
Limitaciones de la publicación. Lo constituyen el hecho de que la susceptibilidad in vitro de los gérmenes no fue relacionada con la eficacia clínica de los antibióticos, ya que no contamos con un seguimiento asistencial de los pacientes. La disminución del procesamiento de urocultivos en los años 2015 y 2016, se dieron por razones administrativas y varias otras.
RESULTADOS
Se procesaron 45.085 muestras de orina en el Laboratorio de Microbiología, provenientes Servicios de Consultorio Externo de Clínica Médica y Urgencias del Hospital de Clínicas en el quinquenio elegido para el estudio, de las cuales 1031 cumplieron los criterios establecidos para la realización de esta investigación.
La distribución por sexo y edad fue de la siguiente manera: el 56% correspondió al sexo femenino y el 43% al sexo masculino. Los datos de dispersión de la edad en años, según el sexo se observó que la media en las mujeres fue de 52± 20, la moda 79 y la mediana 54; y en los hombres la media fue de 62±16, la moda 68 y la mediana de 64.
En la Tabla 4 se muestran los uropatógenos más frecuentemente aislados según el año evaluado, siendo la Escherichia coli la enterobacteria aislada con mayor frecuencia 553 (52% en promedio) seguida de la Klebsiella pneumoniae con 148 (14% en promedio).
Tabla 4. Distribución de uropatógenos según el año de aislamiento. Hospital de Clínicas - San Lorenzo. 2015 a 2019 (n:1031)

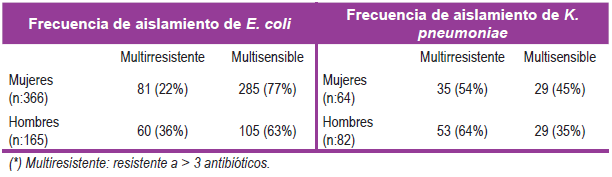
Teniendo en cuenta los uropatógenos más frecuentemente aislados, Escherichia coli y Klebsiella pneumoniae, podemos observar en la Tabla 5 la clasificación según resistencia y la distribución en hombres y mujeres.
Urocultivos de varones. En los urocultivos los mecanismos enzimáticos de resistencia de las dos principales bacterias aisladas (Escherichia coli y Klebsiella pneumoniae) en 60 aislamientos de gérmenes multiresistentes, el principal mecanismo de Escherichia coli fueron las BLEE (55 aislamientos en el quinquenio: 91%, seguida de las MBL (3 aislamientos en el quinquenio: 5%) y finalmente KPC (2 aislamientos en el quinquenio: 3%), datos que podemos ver en el Gráfico 1.
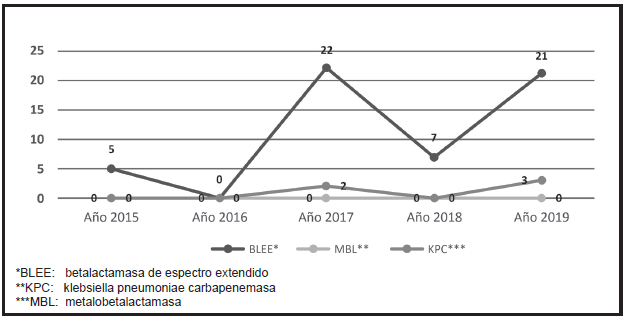
Gráfico 1. Mecanismos de resistencia en aislamientos de Escherichia Coli en urocultivos de varones. Hospital de Clínicas - San Lorenzo. 2015-2019 (n: 60)
En Klebsiella pneumoniae y sus mecanismos enzimáticos de resistencia en base a 53 aislamientos se puedo observar en orden decreciente de frecuencia: BLEE (31 aislamientos en el quinquenio evaluado: 58%), seguida de las KPC (13 aislamientos en el quinquenio evaluado: 25%) y, por último, MBL (9 aislamientos en el quinquenio evaluado: 16%) ver en el Gráfico 2.

Gráfico 2, Mecanismos de resistencia en aislamientos de Klebsiella pneumonie en urocultivos de varones. Hospital de Clínicas - San Lorenzo. 2015-2019 (n: 53)
Urocultivos en mujeres. teniendo en cuenta las principales bacterias aisladas podemos observar que los mecanismos enzimáticos de resistencia de Escherichia coli en base a 81 aislamientos de cepas multirresistentes están mediados por las BLEE (79 aislamientos en el quinquenio: 97%), seguido de las KPC (1 aislamiento en el quinquenio: 1%) y las MBL (1 aislamiento en el quinquenio: 1%), datos que son ilustrados en el Gráfico 3.
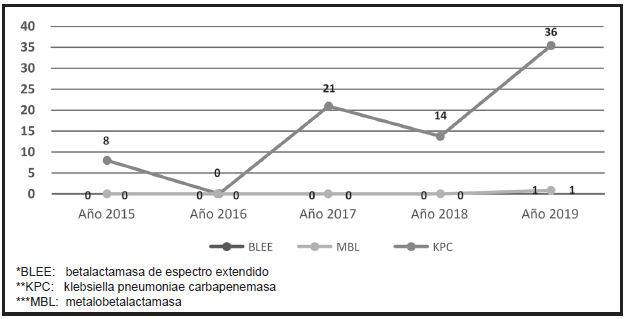
Gráfico 3. Mecanismos de resistencia en aislamientos de Escherichia Coli en urocultivos de mujeres. Hospital de Clínicas - San Lorenzo. 2015-2019 (n: 81)
En Klebsiella pneumoniae se pudo observar los siguientes mecanismos enzimáticos de resistencias en orden decreciente de frecuencia en base a 35 aislamientos: BLEE (19 aislamientos en el quinquenio: 54%), seguida de las KPC (12 aislamientos en el quinquenio: 34%) y, por último, MBL (4 aislamientos en el quinquenio: 13%), datos presentados en el Gráfico 4.
DISCUSION
Nos parece importante el estudio de las cepas productoras de BLEE en nuestro país, considerando que la diseminación de estos gérmenes constituye un real problema de salud pública nacional e internacional. Las estrategias de prevención deben centrarse en la infección nosocomial como lo publicamos 3 pero no debe olvidarse que las BLEE aparecen cada vez con mayor frecuencia en las infecciones comunitarias. Las decisiones terapéuticas deben basarse en el conocimiento de la distribución local de los microorganismos y sus patrones de resistencia, por lo que son necesarios estudios locales para el correcto manejo de las infecciones con gérmenes BLEE. Otra razón a tener siempre presente es el impacto económico del uso de los antibióticos 37.
Aspectos Microbiológicos
La determinación de la susceptibilidad antimicrobiana de los gérmenes in vitro constituye una de las funciones más importantes de los laboratorios de microbiología. Con los estudios in vitro no solamente se brinda una ayuda substancial a la práctica médica, sino también permite monitorizar periódicamente los niveles de resistencia de los microorganismos a los antimicrobianos en una localidad determinada, hecho trascendente para una medicina asistencial de calidad.
En la literatura médica nacional encontramos publicaciones que demuestran la frecuencia de enterobacterias productoras de BLEE en pacientes ambulatorios e internados, tanto de servicios privados de salud 10 como de hospitales públicos 3,29.
Si bien es posible la detección fenotípica del mecanismo enzimático de resistencia por métodos convencionales, sólo los métodos moleculares permiten la identificación del gen responsable de la resistencia 14. Con respecto a los mencionados en último lugar, un grupo de investigadores llevaron a cabo un estudio descriptivo retrospectivo para identificar los genes blaCTX-M2, blaPER-2, blaSHV y blaTEM, en aislamientos de enterobacterias productoras de BLEE, de muestras clínicas colectadas entre julio 2007 y abril 2008, provenientes de hospitales de la capital del país. El blaCTX-M2 fue el gen más frecuentemente identificado en este estudio 38.
Es importante resaltar algunos de los uropatógenos en los que se están concentrando los mayores problemas de resistencia antibiótica. Como hallamos en el presente estudio, se destacan Escherichia coli y Klebsiella pneumoniae resistente a cefalosporinas de tercera generación, especialmente por la presencia de BLEE 39,3,8-10.
Cada vez con mayor frecuencia se reporta el hallazgo comunitario de Escherichia coli uropatógena productora de BLEE, probablemente debido a que esta bacteria produce infecciones y está ampliamente distribuida en la población, lo que facilita los procesos de recombinación y transferencia, por lo que Escherichia coli presentan una gran diversidad de patrones de resistencia 40.
En el presente trabajo y de manera global, a lo largo del quinquenio estudiado, fue Escherichia coli la enterobacteria aislada con mayor prevalencia (52%) siguiéndole Klebsiella pneumonia (14%). Leguizamón et al publicaron datos de otro hospital de Asunción, en el que señalan que el uropatógeno más frecuentemente identificado fue Escherichia coli (70%) seguido de Klebsiella pneumoniae (18%). Otro dato importante de dicha publicación con respecto a BLEE, es que encontraron que el 24% de Escherichia coli y el 50 % de K. pneumoniae fueron productores de dicha enzima 41.
En nuestra investigación, los pacientes del sexo masculino, con infecciones urinarias por cepas de Escherichia coli multirresistentes fueron 60, y las enzimas de resistencia identificadas se distribuyeron con respecto al total de muestras (n: 165): la más frecuente fue BLEE (33%), seguido de la metalobetalactamasa (MBL) (1,8%) y por ultimo carbapenemasa klebsiella pneumoniae (KPC) (1,2%). El comportamiento de estas enzimas producida por Klebsiella pneumoniae, que incluyó 53 varones fue la siguiente con respecto al total de la muestra (n: 82): BLEE: 37%, KPC: 24% y MBL: 10%.
En los varones la BLEE fue predominante en los gérmenes arriba mencionados, pero la KPC la encontramos sobre todo en Klebsiella pneumoniae (24%).
Tuvimos 81 pacientes del sexo femenino, y cuando la IVU fue producida por Escherichia coli el mecanismo enzimático descrito con respecto a la muestra total (n: 366) fue en la siguiente proporción: BLEE (21%) KPC (0,2%) y MBL (0,2%). Por otro lado, 35 mujeres con IVU por Klebsiella pneumoniae presentaron, con respecto al total de pacientes evaluadas (n: 64): BLEE (29%), KPC (18%) y MBL: (6%). Predominó la producción de BLEE en las mujeres en ambos gérmenes. En las IVU causadas por Eschericha coli la producción de KPC fue baja (0,2%), pero en las que se aislaron Klebsiella peumoniae la producción de KPC fue netamente superior (18%).
Si bien inicialmente los primeros casos de BLEE fueron reportados en Alemania y Francia, rápidamente se extendieron a todo el mundo y América del Sur no fue la excepción 42. La prevalencia de estas bacterias productoras de BLEE en América del Sur aumentó desde el año 2005, particularmente en las infecciones nosocomiales. El problema de la alta prevalencia es potenciada por la diseminación de estas cepas multiresisentes a los ATB 43.
En Villa Montes, Chaco Boliviano, se ha encontrado también alta tasa de resistencia en uropatógenos en relación con producción de BLEE. En el estudio sobre 213 muestras de orina analizadas, Escherichia coli y Kblebsiella pneumoniae fueron aisladas, de las que el 11% fueron productoras de BLEE, por lo que Bolivia tiene una alta tasa de resistencia, tal como están afectados varios países de América del Sur 44.
Las infecciones urinarias por enterobacterias productoras de carbapenemasa, emergen como una preocupación mayor de salud pública. En un estudio reciente encontraron que Klebsiella pneumoniae y Escherichia coli se constituyen como los principales uropatógenos responsables de la emergencia de multirresistencia a antibióticos (45), de manera semejante a los datos que aportamos en la presente investigación. Fueron identificados como factores relacionados con la alta tasa de resistencia, el sexo femenino, la edad, hospitalización y antecedente de terapia con antibióticos a lo largo del quinquenio estudiado en el Hospital de Clínicas de San Lorenzo 3,45.
En una publicación sobre enterobacterias resistentes a carbapenemes que incluyó pacientes de Asunción y del Departamento Central, identificaron 76 cepas patógenas con resistencia a carbapenemes, de los cuales fueron del sector público 73 (96%) y del privado 3 (4%). Las muestras fueron tomadas del aparato respiratorio (36%), mientras que el 23% fueron de la orina 46. El mayor porcentaje de bacterias en las que fueron confirmadas la presencia de KPC corresponden a Klebsiella pneumoniae (87%). En nuestra observación, en varones, el 24% de KPC provino del mismo germen, mientras que en mujeres KPC se presentó en el 18% de las IVU producidas por Klebsiella pneumoniae.
En un seguro médico privado, de los 481 aislamientos de enterobacterias obtenidos, 456 fueron provenientes de muestras de urocultivo (95%). Al analizar la distribución de BLEE según la procedencia del paciente, la frecuencia de BLEE en los internados fue del 32% y en los del ambulatorio fue del 7%. Es decir, las enterobacterias productoras de BLEE son aisladas también de pacientes provenientes de la comunidad 10.
Desde el punto de vista microbiológico, Escherichia coli y Klebsiella pneumoniae fueron las principales bacterias que originan resistencia a los antibióticos y en las IVU identificadas en nuestro estudio, la BLEE fue la enzima más frecuentemente identificada en ambos sexos.
Aspectos Médicos
Cumplieron los criterios de inclusión para el estudio, 1031 urocultivos, es decir, el 2,2% de los 45.085 estudios de orina que se recibieron en el lapso de la observación. En la muestra evaluada; el 56% correspondió al sexo femenino y el 43% al sexo masculino. El promedio de edad en las mujeres fue de 52 años y en los varones evaluados fue de 62 años. La tendencia a predominar en las mujeres las IVU se mantuvo, pero no con un amplio margen como ocurre habitualmente. La edad promedio de los varones y las mujeres, no permitió polarizar la muestra examinada hacia los ancianos, hecho destacado porque aleja el acento que podría tener en ambos sexos la ancianidad como factor favorecedor de la aparición de las infecciones urinarias.
Eficacia clínica: los carbapenémicos son los fármacos más activos frente a las cepas productoras de BLEE y son de elección para las infecciones graves. Aunque también se pueden utilizar fosfomicina, nitrofurantoína, tigeciclina y piperacilina-tazobactam 19,47.
Existen nuevos antibióticos: meropenem-vaborbactam, imipenem-relebactam, plazomicina, cefiderocol, eravaciclina, y aztreonam-avibactam, a las que tenemos acceso limitado en el país 47.
Desde finales de la década de 1990, las Enterobacteriaceae resistente a múltiples fármacos (principalmente Escherichia coli) que producen las BLEE, como las enzimas CTX-M, han surgido dentro de la comunidad. como una causa importante de infecciones urinarias. Informes recientes también han descrito Escherichia coli productora de BLEE como una causa bacteriemia asociadas con estas infecciones urinarias de inicio comunitario. Se requieren pautas para la bacteriemia de inicio en la comunidad asociada con infecciones urinarias 48.
Tenemos referencia de un caso clínico diagnosticado de Escherichia coli metalobetalactamasa, aislado en una paciente del Hospital de Clínicas, a partir de la herida quirúrgica de fascitis necrotizante en región perianal y en hemocultivo 49. En nuestra casuista encontramos pocos casos de bacterias MBL en las IVU, pero debemos prestarles mucha atención para evitar la diseminación de los mismos.
La creciente resistencia antimicrobiana ha traído de la mano nuevos enfoques para la evaluación y manejo de las IVU, particularmente los gérmenes productores de carbapenemasas. Las asociaciones de antibióticos son de utilidad ante la aparición de uropatógenos resistentes a los ATB 50. Pero en la práctica médica el aumento de la resistencia a los ATB no se asocia con un crecimiento paralelo de propuestas eficaces para el manejo de las resistencias 51.
Conflictos de interés: Los autores declaran no tener conflictos de intereses con los datos presentados en el presente trabajo.