INTRODUCCION
La enfermedad celiaca (EC) es una afección sistémica inducida por el gluten de la dieta en personas genéticamente susceptibles y en quienes produce lesiones características en la mucosa intestinal, que llevan a un estado de malabsorción. El gluten desencadenante de esta enfermedad se encuentra en el trigo, avena, cebada y centeno 1-3.
La prevalencia de la EC es muy variable pero se estima entre 0,5 a 1 % de la población general, sobre todo en raza caucásica 4. Predomina en las mujeres, con una relación 7:3 respecto a los varones. Estudios genéticos demuestran que la EC aparece en sujetos susceptibles y portadores del antígeno de histocompatibilidad HLA-DQ2 en el 90% y HLA-DQ8 en el 10% restante 1,2. En el Paraguay la incidencia va en aumento por la mejoría en su reconocimiento y métodos diagnósticos más accesibles 5.
Existe un amplio espectro de presentación de EC que se agrupa en formas clínicas manifiestas, silentes y latentes 6,7. La EC manifiesta clásica es la más reconocida porque se presenta con los síntomas de un síndrome de malabsorción intestinal. Pero en muchos sujetos la manifestación suele ser atípica: anemia ferropénica, dispepsia, estreñimiento, flatulencia, estatura baja, aftas bucales a repetición, infertilidad, entre otras. La EC latente es la observada en pacientes celiacos que realizaron una dieta libre de gluten por lo que no tienen síntomas, los marcadores serológicos son negativos y la biopsia intestinal es normal o presenta algún grado de atrofia. En la EC silente ó subclínica el paciente presenta los anticuerpos elevados y las lesiones intestinales características. En esta forma está la mayoría (75%) de los celiacos, que pueden ser reconocidos por pertenecer a los grupos de riesgo de padecer esta afección 1-3.
El diagnóstico de EC se realiza habitualmente con la sospecha clínica y posterior dosaje de anticuerpos, sobre todo IgA antitransglutaminasa tisular 8-10. Sin embargo, el patrón de oro del diagnóstico en los adultos es la biopsia duodenal donde se observa el infiltrado linfoplasmocitario, la atrofia duodenal y la hiperplasia de las glándulas submucosas en grados variables 11.
Dentro del contexto de las enfermedades autoinmunes asociadas a la EC, existen dos que involucran a la glándula tiroides y que tienen en común que son mediadas por los linfocitos T y la infiltración linfocítica del parénquima 12,13. En la tiroiditis de Hashimoto los autoanticuerpos van dirigidos contra la peroxidasa (90%) y la tiroglobulina (25-50%) 14. Se manifiesta clínicamente por atrofia glandular e hipotiroidismo. La otra es la enfermedad de Graves, afección autoinmune en la cual se producen anticuerpos dirigidos contra el receptor de la TSH (90%), que se manifiesta clínicamente por bocio e hipertiroidismo 15. Ambas conforman un grupo de patologías llamadas enfermedades tiroideas autoinmunes 16.
Existen numerosas enfermedades asociadas a la EC silente entre las que destacan la de origen autoinmune: diabetes mellitus tipo 1, tiroiditis de Hashimoto, adrenalitis autoinmune, hepatitis autoinmune, colagenopatías, psoriasis, vitíligo, alopecia areata, entre otras 1-3. En el Paraguay, 6,6% de los celiacos son hipotiroideos, pero no se sabe cuántos celiacos existen entre los pacientes con enfermedades tiroideas autoinmunes en este país 5. Reconocer oportunamente a la EC silente permite a estos pacientes iniciar el tratamiento y disminuir el riesgo de complicaciones como las neoplasias del tubo digestivo 4,6.
OBJETIVOS
Determinar la frecuencia de EC en portadores de tiroiditis de Hashimoto y enfermedad de Graves.
Describir las características demográficas (edad, sexo, IMC) y clínicas (estado funcional tiroideo, presencia de diarreas, anemia e hipoalbuminemia).
MATERIALES Y MÉTODOS
Se aplicó un diseño observacional, descriptivo, prospectivo, multicéntrico. La población de estudio estuvo constituida por varones y mujeres, mayores de 18 años, portadores de tiroiditis de Hashimoto y enfermedad de Graves, que consultaron en el Hospital Nacional (Itauguá), Policlínico Municipal (Asunción) y Hospital de Policía Rigoberto Caballero (Asunción) en 2018 y 2019.
Fueron incluidos todos aquellos sujetos que accedieron a la determinación anticuerpo IgA antitransglutaminasa tisular y la IgA sérica. Se excluyeron a los conocidos portadores de EC, portadores de deficiencia de IgA, pacientes en tratamiento inmunosupresor por vía sistémica, hipotiroidismo congénito, post tratamiento con iodo radioactivo y post tratamiento quirúrgico.
Se aplicó un muestreo no probabilístico, de casos consecutivos. Por conveniencia, se incluyó a todos los pacientes que reunían los criterios de inclusión en el tiempo de estudio.
Se midieron variables demográficas (edad, sexo, procedencia), tipo de enfermedad tiroidea, estado nutricional, estado funcional tiroideo, síntomas digestivos (meteorismo, diarreas, constipación, dolor abdominal, intolerancia a lactosa) y datos laboratoriales: anticuerpo IgA antitransglutaminasa tisular, IgA sérica, anticuerpo antiperoxidasa, anticuerpo antitiroglobulina, índices hematimétricos, albuminemia. Se consideró positivo al anticuerpo IgA antitransglutaminasa tisular a todo valor ≥10 U/mL y déficit de IgA a <70 mg/dL.
Para el reclutamiento se solicitó permiso a las autoridades sanitarias. Luego, a los sujetos afectos de hipo e hipertiroidismo se les solicitaron las determinaciones séricas que fueron realizadas en el Departamento de Laboratorio del Hospital Nacional o en centros privados de Asunción.
Los que presentaban anticuerpo IgA antitransglutaminasa positivo fueron sometidos a endoscopía digestiva alta para la toma de biopsias duodenales en el Servicio de Endoscopía Digestiva del Hospital Nacional o en centros privados de Asunción. Todos los informes anatomopatológicos se basaron en la clasificación de Marsh. Si el estudio anatomopatológico resultaba confirmatorio de EC, se informaba al paciente sobre su afección y era educado por los autores para iniciar una dieta libre de gluten y derivado a la Fundación Paraguaya de Celiacos. Las afecciones tiroideas eran tratadas según del criterio del médico de cabecera.
Los datos se registraron en fichas técnicas y transcriptas a planilla electrónica. Los datos fueron descritos con el programa estadístico Epi Info 7©.
Cuestiones Éticas
Los pacientes fueron contactados en su idioma materno por los autores, quienes les entregaron una hoja de información. Los que aceptaron participar del estudio firmaron un consentimiento informado para las determinaciones laboratoriales y endoscópicas.
Todos decidieron voluntariamente someterse al estudio, no se sacó provecho de sujetos vulnerables, minoritarios ni dependientes, no fueron sometidos a riesgos innecesarios. Los casos de EC detectados se beneficiaron del tratamiento, mejorando su calidad de vida. Se protegió al máximo la confidencialidad.
Se recomendó la realización del estudio anatomopatológico de mucosa duodenal de los casos positivos, obtenida por endoscopía digestiva alta. Los resultados fueron entregados a los médicos tratantes para que los mismos determinen la conducta terapéutica adecuada. Los pacientes que se rehusaron a la realización del estudio laboratorial o la biopsia duodenal, siguen siendo atendidos en los centros donde consultan sin ningún tipo de discriminación.
Los costos de los estudios en el Hospital Nacional fueron gratuitos. No existió conflictos de interés comercial. Los autores no recibieron financiamiento externo. Los pacientes detectados con EC fueron remitidos a la Fundación Paraguaya de Celiacos y se beneficiaron con la información sobre la dieta sin gluten.
El protocolo de investigación fue evaluado por el Comité de Ética de la Facultad de Medicina de la Universidad Nacional de Itapúa.
RESULTADOS
Fueron contactados 87 pacientes con trastornos tiroideos (Figura 1).
La edad promedio de los pacientes fue 50 años y hubo predominio del sexo femenino (77%). La mayoría de los pacientes eran procedentes del Departamento Central (77%), con predominio de la ciudad de Itauguá (22%).
Las formas clínicas de enfermedad tiroidea autoinmune fueron la tiroiditis de Hashimoto en 18 casos (86,3%) y enfermedad de Graves Basedow en resto (13,7%). Los anticuerpos antiperoxidasa fueron positivos en 31,82% de los sujetos, los anticuerpos antitiroglobulina en 36,36% y la positividad de ambos anticuerpos se detectó en 31%. Según el estado funcional, los pacientes estaban en hipotiroidismo (68%), hipotiroidismo subclínico (18%) y en hipertiroidismo (14%).
Se detectó anticuerpos antitransglutaminasa positivo en tres pacientes, siendo todos del sexo femenino. No se detectó déficit de IgA sérica. La biopsia duodenal confirmó la presencia de lesiones compatibles con EC en los tres casos positivos (Figura 2).
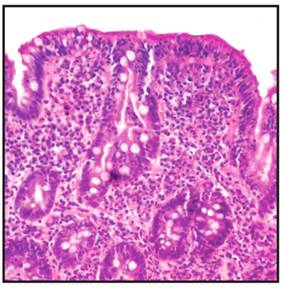
Figura 2. Microfotografía de mucosa duodenal de paciente con tiroiditis de Hashimoto y anticuerpo IgA antitransglutaminasa positivo. Se observa intenso infiltrado linfoplasmocitario, atrofia duodenal e hiperplasia de glándulas submucosas. HE (40x).
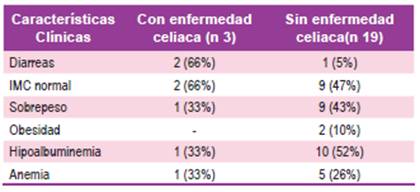
Ninguno de los pacientes incluidos en el estudio presentaba otra enfermedad autoinmune asociada. Entre las características clínicas destacó la presencia de diarreas entre los pacientes con enfermedad celiaca (Tabla 1).
DISCUSION
La frecuencia de EC detectada en esta muestra (13%) es mucho más elevada que la detectable en la población general de raza caucásica (1%) (4). Así también, esta frecuencia es superior a la detectada por otros autores. Bejares el al. hallaron EC en sólo 1,1% de sujetos con enfermedades tiroideas autoinmunes 17. En un estudio del Brasil la prevalencia de anticuerpos antiendomisio en 254 pacientes con enfermedades tiroideas autoinmunes fue 2,7% y en 1,2% se confirmó con biopsia duodenal. Todas eran mujeres y eran portadoras de tiroiditis de Hashimoto 18. Un reporte a gran escala detectó EC en 1,8% de los niños-adolescentes y en 7,2% de adultos con tiroiditis de Hashimoto recién diagnosticada 19. El riesgo de padecer EC silente en pacientes con tiroiditis de Hashimoto es elevado: RR 6,1 (IC 95% 1,2-17,6) así como en la enfermedad de Graves: RR 5,7 (IC 95% 3,2-9,3) 20.
Las enfermedades autoinmunes son trastornos complejos causados por una combinación de susceptibilidad genética y factores ambientales que pueden alterar el sistema inmunitario al atacar a los propios órganos. Estas alteraciones pueden facilitar que los pacientes con una enfermedad autoinmune sean vulnerables a otras afecciones autoinmunes. Tal es así que en 25% de la población occidental hay coexistencia de varias enfermedades autoinmunes 21. La asociación entre EC y enfermedades tiroideas autoinmunes se debe a diversos factores: la herencia poligénica, el sexo femenino, la fuerte asociación con antígenos HLA clase II y la presencia de interleukinas 22-24. Se postula además que el aumento de la zonulina y de la permeabilidad de la mucosa intestinal en los celiacos que ingieren gluten sin saber de su condición permitiría el ingreso de alérgenos que dispararían la lesión de otros órganos 25. Actualmente se considera a la mala absorción del Selenio, Iodo y vitamina D en EC como factores predisponentes de las tiroiditis autoinmunes ya que la deficiencia de estos nutrientes predispone a la lesión de la tiroides 26.
La prevalencia de enfermedades tiroideas autoinmunes en la población general es 5% 27 y entre 4,1% a 9,3% de los celiacos son portadores de enfermedades tiroideas autoinmunes 28,29. Por ello, los celiacos deberían tener un perfil tiroideo una vez diagnosticados. Una causa de la falta de respuesta a la dieta sin gluten es la tiroiditis no diagnosticada pues la persistencia de la diarrea puede ser un síntoma de hipertiroidismo 30.
La falta de sospecha clínica de EC puede retardar significativamente su diagnóstico. Es sabido el tiempo de exposición al gluten aumenta el riesgo de desarrollar procesos autoinmunes. Los pacientes con EC atípica y silente serían tan susceptibles a presentar complicaciones por déficit nutricional y autoinmunidad de la enfermedad como aquellos que presentan el cuadro clásico. Por ello conviene realizar una “búsqueda activa” en los grupos de mayor riesgo, como los portadores de enfermedades tiroideas autoinmunes. Estos casos se benefician también con el tratamiento de la dieta sin gluten 1-4.
Todos los casos con serología positiva de esta muestra aceptaron la endoscopía digestiva alta y las biopsias duodenales mostraron signos de EC. La demostración histológica de alteraciones en la mucosa intestinal sigue siendo el método confirmatorio de EC en el adulto 31. Debido al corte transversal de esta investigación no se pudo realizar la evolución del cuadro clínico de estos nuevos celiacos. Es reconocido que la detección de una enfermedad crónica repercute en su calidad de vida 32. Pero en contrapartida, el tratamiento oportuno con la dieta sin gluten disminuye el riesgo de complicaciones nutricionales y la aparición de neoplasias del tubo digestivo 33-36.
Llamó la atención la falta de desnutrición de los celiacos detectados en esta muestra, más aún con informe histopatológico de atrofia duodenal que presentaban. El IMC normal y el sobrepeso se explican porque la lesión intestinal afecta en forma parcheada al tubo digestivo, facilitando la absorción de nutrientes en forma distal. De hecho, hay informes de celiacos detectados con obesidad 37. El estado nutricional normal no debe ser motivo para no solicitar las pruebas serológicas en grupos de riesgo de EC 1-3.
Sería interesante evaluar el impacto de la EC no diagnosticada en el tratamiento de estas enfermedades tiroideas autoinmunes. Se especula que el mal control hormonal tiroideo podría deberse a la inadecuada absorción intestinal de los medicamentos o al contenido de gluten en ellos 30. El mal control del hipo o hipertiroidismo en las tiroiditis puede deberse a una EC no diagnosticada. Hay reportes de una reducción del 50% en la absorción de levotiroxina en hipotiroideos con atrofia duodenal 18. Es más, con la dieta sin gluten los autoanticuerpos tiroideos tienden a disminuir. Existe una correlación positiva entre los autoanticuerpos antitiroideos y el anticuerpo IgA antitransglutaminasa tisular. Otra afectación a evaluar es la anemia presente en las afecciones tiroideas que podría atribuirse a la atrofia vellositaria intestinal 38 aunque es sabido que la anemia es común tanto en el hipertiroidismo (14-40%) como en el hipotiroidismo (7-57%) 39.
Una debilidad de esta investigación fue el tamaño de muestra. Existió una elevada frecuencia de rechazo de los pacientes para participar de esta investigación. La excusa más frecuente fue el temor a conocer la portación de otra enfermedad que requerirá una dieta restrictiva de por vida, sobre todo con la ausencia de síntomas gastrointestinales 32. Este aspecto de la conducta humana requiere una investigación con enfoque cualitativo. En este estudio no se incluyó un grupo control de la población general debido a que las guías recomiendan el tamizaje de la EC en grupos de riesgo, como es aquel de los portadores de enfermedades tiroideas autoinmunes 1-3.
No obstante, como fortalezas se puede mencionar el enfoque prospectivo y multicéntrico, además de la confirmación histológica de todos los pacientes seropositivos. Es importante mejorar los conocimientos del personal sanitario respecto a la posibilidad de que sus pacientes puedan padecer una EC silente 40.
CONCLUSIONES
La frecuencia de pacientes con EC silente en los portadores de tiroiditis de Hashimoto y enfermedad de Graves fue 13%.
La presencia de diarreas y anemia fueron más frecuentes en los pacientes con EC.
Se recomienda el tamizaje en este grupo de riesgo a fin de llegar a un diagnóstico precoz y tratamiento oportuno. La detección de las formas silentes de EC es muy importante porque con el tratamiento se mejora el pronóstico y calidad de vida, se previenen complicaciones graves como las neoplasias, deficiencias nutricionales, osteoporosis y trastornos en la fertilidad femenina
Conflicto de intereses: no se declaran conflictos de interés.
Fuentes de financiación: autofinanciado.