INTRODUCCION
La Hemorragia Subaracnoidea (HSA) es una patología caracterizada por el sangrado en el espacio subaracnoideo, pudiéndose ser de causa traumática o espontánea 1. La HSA traumática es la más frecuente y, se localiza preferentemente en la región cortical de los surcos cerebrales, la espontánea es causada en la mayoría de los casos por ruptura de un aneurisma cerebral y, se localiza preferentemente en cisternas de la base y regiones proximales de las fisuras 2.
La HSA espontánea corresponde al 1% de las cefaleas ingresadas al servicio de urgencia, y al 7 % de los accidentes cerebrovasculares. Es una causa de morbilidad y mortalidad en el mundo entero. El 12 % de los pacientes fallecen antes de recibir atención médica, un cuarto de los que fueron ingresados al sistema de salud fallecen a pesar de haber recibido tratamiento médico o quirúrgico, y la mitad de los sobrevivientes padecen alguna secuela neurológica significante, incluyendo alteraciones cognitivas que impiden su reintegración laboral 1-3.
En el 80% de los casos la causa de la HSA espontánea es la presencia de uno o más aneurismas cerebrales. Los aneurismas cerebrales, generalmente surgen de los puntos de ramificación de las arterias principales, ya sea en la cara lateral de la arteria junto con el nacimiento de un ramo, como es el caso de los aneurismas de la arteria Comunicante Posterior (ComP), o por la subdivisión de un tronco en dos otros troncos como ocurre en los aneurismas de la bifurcación de la arteria cerebral media (ACM). Prácticamente nunca surgen en los segmentos rectos de los vasos arteriales, sino en la convexidad de las curvas, ya que ese es el sitio donde se generan cambios hemodinámicos que exponen a la pared arterial a un flujo mayor, propiciando la formación de un saco, cuyo fondo apuntará en dirección al flujo hemodinámico máximo en el segmento pre aneurismático 1.
El 80 % de los pacientes que están en condiciones neurológicas de aportar datos a la historia clínica refieren “la cefalea más intensa de su vida”, esta cefalea se caracteriza por tener un inicio súbito, y alcanzar su máxima intensidad rápidamente 1,4,5.
En el presente trabajo se describe la Hemorragia Subaracnoidea aneurismática en sus diferentes aspectos (datos demográficos, motivos de consulta, localización, posibles evoluciones y complicaciones) así como el tratamiento quirúrgico de los aneurismas cerebrales.
PACIENTES Y MÉTODO
Se realizó un estudio observacional, descriptivo, transversal, de pacientes sometidos a clipado de aneurismas cerebrales en el Hospital de Clínicas, entre enero del 2011 y diciembre de 2019.
Se incluyeron sujetos de sexo femenino y masculino, mayores de 17 años, operados de aneurismas cerebrales de la circulación anterior, en el Hospital de Clínicas, con historia clínica completa, excluyendo aquellos con datos faltantes así como operados de aneurismas de la circulación posterior.
Todos los pacientes fueron operados por una craneotomía Pterional.
Las variables descriptas fueron: edad, sexo, motivos de consulta, estudios radiológicos diagnósticos, escala de Glasgow y Hunt y Hess al ingreso y egreso, localización del aneurisma, segmento, cantidad, fase en la cual se realizó la cirugía, si se realizó o no clipado temporario durante el acto operatorio, si presentó o no vasoespasmo, y si desarrollo hidrocefalia dependiente de válvula de derivación ventrículo peritoneal en algún momento el seguimiento.
Análisis de Datos: Las variables analizadas en la presente trabajo fueron recopiladas en un cuestionario y almacenadas en planilla electrónica Excel 6,04.
Asuntos Éticos: Todos los sujetos recibieron el mismo trato y las mismas oportunidades en el proceso. Toda la información recogida se manejó en forma confidencial respetando la identidad de cada paciente.
El estudio será de utilidad para la comunidad científica para realizar programas de capacitación, por dar información que permitiría normar conducta para el mejoramiento del estilo de vida y pronóstico de pacientes.
RESULTADOS
Entre enero de 2011 y diciembre de 2019, se incluyeron a 249 pacientes operados de aneurismas cerebrales.
Con respecto a la distribución por sexo, 45% fueron varones y 65% mujeres, evidenciándose el predominio en el sexo femenino como describe la literatura.
La edad estuvo comprendida entre 17 y 93 años (47,5±13), observándose el mayor número de casos entre los 45 y 55 años.
El motivo de consulta más frecuente fue la cefalea, estando presente en el 78,7% de los casos, y siendo el único síntoma en 44% de ellos. Le sigue en frecuencia la asociación de la cefalea con vómitos y alteración del sensorio.
La escala de Hunt y Hess (HH) que representa el estado neurológico del paciente al ingreso, se distribuyó de la siguiente manera: 0: 6,7%, 1: 13,1%, 2: 66,9%, 3: 10,6%, 4: 0,84% y 5: 1,7%.
Hunt y Hess 0 incluye los pacientes con aneurismas cerebrales no rotos, es decir, que no tuvieron una HSA; consultaron por alteración del tercer par con o sin cefalea, hallazgo anormal en la tac simple de cráneo; en una paciente con cefalea de etiología descocida en estudio, impresionaba verse el saco aneurismático a nivel de la fisura Silviana. Pacientes con HH 3 y 4 no representan el real número de casos que acuden a la urgencia; dichos pacientes, por el mal estado neurológico no suelen ser candidatos a cirugía salvo que tengan un hematoma extenso que por comprometer la vida requieran un drenaje de urgencia, por lo que al no ser quirurgicos no fueron incluidos en este trabajo. Se observó que el mayor número de la muestra (66,9%) son pacientes con HH 2.
La escala de Fisher se distribuyó de la siguiente manera: 0: 6,7%, 1: 5,9%, 2: 7,8%, 3: 36,4% y 4: 43,2%. Los casos Fisher 0 incluyen los pacientes que no han tenido HSA es decir portadores de aneurismas no rotos. Se ve una mayor frecuencia de Fisher 3 y 4.
La escala de Glasgow al ingreso estuvo distribuida de la siguiente manera; 15: 77,5%, 14:10,2%, 13: 5,5%, 12:1,7%, 11:4,6% y menor o igual a 8: 2,1%. Los pacientes dentro del grupo de Glasgow menor a 8 fueron incluidos por ser operados de urgencia, por presentar hematomas intraparenquimatosos que ponían en riesgo la vida del paciente, teniendo todos ellos, un mal pronóstico neurológico.
Al egreso el Glasgow fue como sigue: 15:75,4%, 14:6,7%, 11-13: 9,7, 8-10: 4,23%. Se observó que la gran mayoría 82,1% fueron de alta con Glasgow mayor o igual a 14. Se observó que en general, los pacientes mantuvieron su nivel de conciencia e incluso se mostró mejoría en algunos de ellos. Aquellos con Glasgow de egreso menor a 11 en su mayoría fueron los pacientes que presentaron un Glasgow de ingreso bajo.
La mortalidad fue de 4,2%.
Con respecto a los estudios radiológicos realizados, considerando el estudio que brindó mayores datos en cada caso, se hizo el diagnóstico con arteriografía en el 51,7%, con Angio TAC en el 34,7% de los casos y con Angio RNM en el 13,5%. En el 15,2 % se solicitó más de un estudio auxiliar. Como se describe en la literatura el gold estándar para el diagnóstico de aneurismas cerebrales sigue siendo la arteriografía cerebral de 4 troncos; en los últimos años con el avance de los métodos no invasivos, y el principal beneficio en nuestro medio de abaratar los costos, solicitamos como primera instancia angio RMN o angio TAC y de existir dudas diagnósticas se recurre a la arteriografía cerebral.
La localización del aneurisma se distribuyó de la siguiente manera: arteria carótida interna (ACI) en el 50,9%, arteria comunicante anterior (CoA) en 25,7%, arteria cerebral media (ACM) en 21,6%, y arteria cerebral anterior (ACA) en el 1,6%.
En nuestra casuística la localización más frecuente de los aneurismas es la ACI, específicamente en su segmento comunicante posterior (44,9%), le siguen los del segmento oftálmico (2,4%), bifurcación (2%) y segmento coroideo (1,6%). Estos datos difieren con la literatura, que considera los aneurismas de la CoA como los más frecuentes.
Referente a la cantidad de aneurismas, se encontraron aneurismas múltiples en el 10,84% de los casos.
La fase de realización de cirugía fue: de 28,3% en fase aguda y 65% en fase tardía y, en 6,7% fueron aneurismas de hallazgo casual. Estos porcentajes no reflejan la tendencia del Servicio a operar los casos en fase tardía, sino que son varias las dificultades para poder realizar la cirugía en los primeros tres días; desde la disponibilidad de medios económicos para costear un estudio diagnóstico, materiales (clip), o disponibilidad de cama en Unidad de Cuidados Intensivos.
En cuanto a la cirugía, en 36,44% de los casos se realizó clipado temporario (CT). El CT no formó parte de la rutina del acto quirúrgico, se reservó para los casos en los cuales la disección del aneurisma ponía en riesgo la integridad del mismo; se requirió con mayor frecuencia en aneurismas de la ACM así como en pacientes con HSA Fisher 3 y 4 lo cual podría explicarse por las dificultades técnicas que surgen durante la disección de un aneurisma frente a cerebros con alto contenido de sangre en el espacio cisternal, edematizados, o con hematomas intraparenquimatosos que causen algún tipo de efecto de masa. Considerando la fase en la cual fue realizada la cirugía, se requirió proporcionalmente con mayor frecuencia el clipado temporario en cirugías de fase aguda, en esta etapa el cerebro puede encontrarse tenso, friable, incluso con el drenaje de LCR puede ser dificultosa la disección de las estructuras anatómicas y del saco aneurismático, por lo que se explica éste hallazgo.
En el 70,4% se perforó la lámina terminalis con el objetivo de comunicar la circulación de LCR.
Con respecto a las complicaciones; la mortalidad fue de 4,2%, tuvo vasoespasmo radiológico el 46% y vasoespasmo clínico el 24,5 %, fueron sometidos a craniectomía descompresiva el 11% por vasoespasmo, y desarrolló hidrocefalia dependiente de VDVP el 5,5%.
Otras complicaciones que no tuvieron relación directa con la HSA fueron: un caso de trombosis venosa profunda, uno de tromboembolismo pulmonar, un paciente que en su tercer día post operatorio hizo un cuadro de oclusión intestinal y un caso de síndrome de Steven - Johnson en un paciente con HSA Fisher IV, que recibía Difenilhidantoína.
DISCUSION
Sin lugar a duda los aneurismas cerebrales, constituyen una de las patologías más graves y demandantes en Neurocirugía: un verdadero reto al Neurocirujano vascular, exigiendo paciencia, táctica, técnica, precisión y destreza. Aun así en manos experimentadas la evolución natural de la patología es en ocasiones catastrófica con elevadas cifras de mortalidad y secuelas irreversibles, motoras o cognitivas. Vemos también con grata sorpresa, que con una buena rehabilitación post operatoria se logran mejorías espectaculares en la recuperación del paciente, que nos sorprende a los mismos cirujanos, devolviéndonos las fuerzas y esperanzas de que lo que hacemos con la mayor dedicación tiene sus frutos.
Los aneurismas según su localización exigen distintos abordajes y tácticas existiendo ciertas características y detalles a tener en cuenta que podrían ayudar a disminuir las complicaciones y facilitar el acto quirúrgico.
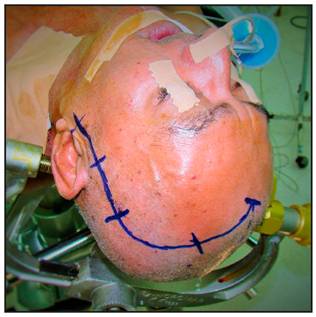
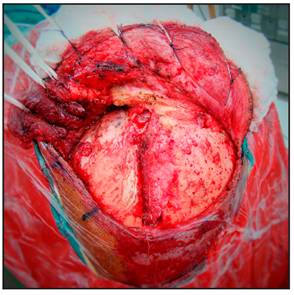
La craneotomía de elección para abordar los aneurismas de la circulación anterior del Polígono de Willis es la Pterional utilizando la técnica de Yasargil. La incisión cutánea inicia un centímetro anterior al trago a nivel del arco cigomático y se dirige por detrás de la implantación del cuero cabelludo hasta la línea temporal superior, donde realiza una curvatura dirigiéndose hacia la línea media (Figura 1 y 2).
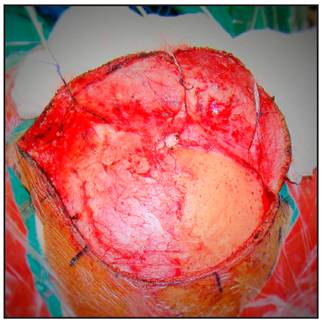
El flap cutáneo es retraído anteriormente (Figura 3).
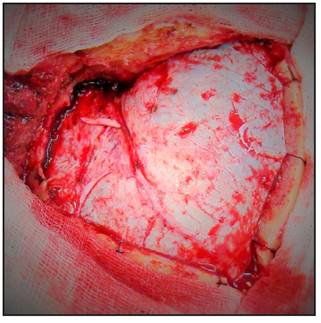
Se procede a realizar la disección interfacial del músculo temporal, se inicia aproximadamente 2,5 cms por detrás del reborde orbitario a nivel de la línea temporal superior, con bisturí número 15, desde la línea temporal superior en dirección al arco del cigoma, con el objetivo de evitar lesionar el ramo frontal del nervio facial y posteriormente se retrae el flap muscular rostral e inferiormente (Figura 4 y 5).
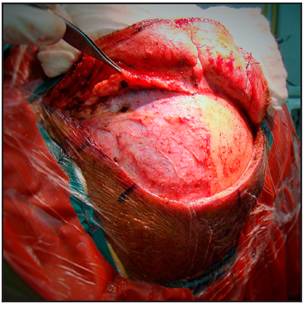
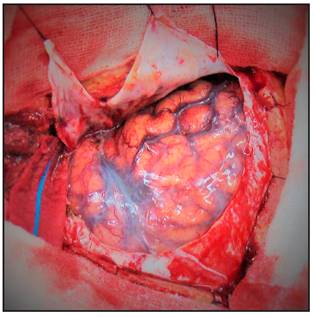
Se realiza la craneotomía, se retira el flap óseo, se drila el ala del esfenoides hasta el proceso clinoideo anterior el cual puede ser removido extraduralmente o bien drillado intradural en caso de que sea necesario (Figura 6 y 7).
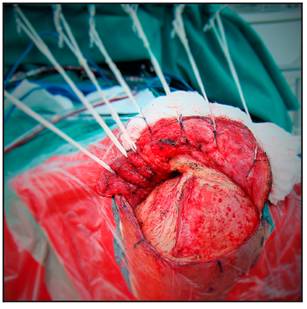
Una vez abierta la duramadre la disección o no de la cisura de Silvio y los pasos a seguir dependen ya de la localización de cada aneurisma en particular (Figura 8).
En el 85-95% de los casos el aneurisma se encuentra en el sistema carotídeo. Los aneurismas de la arteria comunicante anterior (CoA) son los aneurismas más comunes hallados en la práctica neuroquirúrgica 2,3 según los hallazgos de la literatura, sin embargo, a lo largo de los años en nuestra casuística, los aneurismas ComP de la arteria carótida interna (ACI) fueron los más frecuentes. El segmento paraclinoideo abarca a la ACI una vez que penetra la duramadre, desde el techo del seno cavernoso hasta el nacimiento de la ComP, los aneurismas de esta región suelen ser más frecuente en mujeres, y en el 20% de los casos se presenta como aneurismas múltiples. La arteria cerebral media es una localización frecuente de aneurismas, representan el 34% de los aneurismas que sangraron, y el 48% de los aneurismas no rotos, datos similares a los encontrados en nuestra muestra 5.
Existen variaciones en cuanto a la incidencia de la HSA aneurismática en distintas regiones: se demostró en varios estudios la incidencia más alta en Finlandia y Japón (22.5 casos - 100.000 habitantes), más baja en América del Sur y Central, e intermedia en los otros países (9.1-100.000) (6,7). La incidencia aumenta con la edad, siendo en promedio la edad de presentación, mayores de 50 años 8. La mayoría de los estudios muestran una mayor incidencia en el sexo femenino y en la raza negra 9,10. La prevalencia en el sexo femenino se refleja en nuestros resultados, aunque el promedio de edad de nuestra muestra, fue menor de lo esperado.
Los factores de riesgo más conocidos incluyen la HTA, el hábito de fumar, el abuso de alcohol, el uso de drogas simpaticomiméticas y ciertos síndromes genéticos como la enfermedad renal poliquística autosómica dominante y el Síndrome de Ehlers- Danlos tipo IV 11-14.
El antecedente de HSA aneurismática en un familiar de primer grado aumenta el riesgo de padecer una HSA a lo largo de la vida 12,13,15,16,17.
La prevalencia de aneurismas no rotos en la población en general encontrada en autopsias es del 0.2 al 9,9 % 18, en nuestra casuística fue de 6,4% coincidiendo con la literatura. De ellos los que tienen menor riesgo de ruptura son los de la carótida cavernosa, los cuales por la alta morbimortalidad del tratamiento en sí, requieren un análisis de cada caso en particular 17-23.
Se considera que todos los aneurismas intradurales, sintomáticos, independientemente del tamaño deben ser tratados, más aún en los casos que haya historia de HSA previa por otro aneurisma o en familiares de primer grado. En casos en los cuales no puede realizarse tratamiento quirúrgico por alguna comorbilidad o edad avanzada del paciente, debe realizarse un seguimiento cercano con estudios imagenológicos no invasivos (angioTAC, angioRMN), ya que en caso de que el crecimiento del aneurisma sea demostrado se debería reconsiderar un acto quirúrgico 24.
La hemorragia Subaracnoidea es la forma de presentación más frecuente de los aneurismas cerebrales. El 10- 43% de los pacientes refirieron una cefalea previa, o centinela 25,26. La cefalea puede estar acompañada por uno o más signos o síntomas que incluyen; nauseas, vómitos, rigidez de nuca, fotofobia, alteración del nivel de conciencia, o déficit neurológico focal. Episodios convulsivos puede ocurrir en el 20% de los casos 27.
La cefalea centinela aumenta el riesgo de resangrado en 10 veces, suele ocurrir 2 a 8 semanas antes de la HSA, y puede estar acompañada de vómitos. El meningismo es infrecuente 26,28,29.
El estado del paciente al ingreso es el mejor factor predictivo de su probable evolución y para tener registros estándares de ello se utiliza la escala de Glasgow y la de Hunt y Hess (30,31). Como se vio en los resultados, aquellos pacientes que ingresan con un buen estado neurológico tienen una evolución favorable, pero aquellos que ingresaron con Glasgow menor a 8 tuvieron complicaciones diversas, desde vasoespasmo hasta óbito.
La tomografía computarizada es el primer estudio realizado en pacientes con sospecha clínica de HSA 32-34. El patrón tomográfico de la hemorragia puede orientar respecto a la localización del saco aneurismático.
Se utiliza la escala de Fisher para categorizar a los pacientes según la cantidad de sangre en el espacio subaracnoideo, la presencia o no de hemoventrículo, y la asociación o no de hematoma intraparenquimatoso 34,36.
En caso de tomografía normal con duda diagnóstica se debe realizar una punción lumbar según indican las guías actuales 37-40.
En los últimos años, avances en AngioTAC y AngioRMN, han vuelto estos estudios una alternativa diagnóstica no invasiva para los aneurismas cerebrales incluso en algunos centros es la AngioTAC el estudio de primera línea solicitado en pacientes con HSA 41-46. Desde que nuestro centro dispone estos métodos auxiliares, fue parte del protocolo de la institución solicitar uno de ellos; se prefiere Angio TAC para los casos de aneurisma roto, y angio RMN para los trombosados o para complementar la Angio TAC. En caso de hallazgos no concluyentes, o de resultar negativos, debe solicitarse una arteriografía, método que continúa siendo el gold estándar 47-49, es por este motivo que el 15% de los pacientes tuvieron más de un estudio auxiliar.
La mortalidad de esta patología si bien fue disminuyendo en el trascurso de los años, permanece siendo alta. En estudios epidemiológicos se ha encontrado una mortalidad del 32% en EE. UU., 43% en Europa, y 27 % en Japón, sin tener en cuenta los pacientes que fallecen antes de llegar al centro asistencial (12%) 50-54. Nuestras cifras son más alentadoras por el hecho que el trabajo solo incluye los pacientes intervenidos quirúrgicamente, y como se explicó anteriormente, por protocolo del servicio solo son operados aquellos con un buen nivel de conciencia o con un deterioro severo que requiere un drenaje de hematoma de urgencia.
El vasoespasmo es una de las causas de la alta morbimortalidad de esta patología 55, el mayor predictor es el hallazgo tomográfico, específicamente la cantidad de sangre depositada en el espacio cisternal subaracnoideo 56. Se detecta en el 50 a 70% de las angiografías de pacientes con HSA 57, y el evento isquémico ocurre en el 19 al 46% de los casos 58. Nuestra taza de arteriografía es baja por lo que no contamos con los datos de espasmo arteriográfico, pero el evento isquémico se presentó en cifras similares.
El clipado de aneurisma por craneotomía fue el tratamiento de elección en el mundo entero hasta el año 1991, cuando Guglielmi, neuroradiólogo intervencionista Italiano, describió la oclusión aneurismática por abordaje endovascular 59. Ambas técnicas fueron mejorando con los años teniendo cada vez mejores resultados de forma independiente. Recién en el año 2005 se publicó un estudio multicéntrico randomizado (ISAT) comparando ambos tratamientos en los diferentes aspectos; con este estudio se pudo ver la tendencia hacia el tratamiento endovascular al disminuir la mortalidad global, mejorar la calidad de vida en cuanto a la dependencia y disminuir el riesgo de convulsiones, con la contra partida de que tienen un riesgo mayor de resangrado, tal vez por sus tasas de oclusiones incompletas o subtotales mayores 60.
Con respecto al tiempo quirúrgico, peores son los resultados cuanto más se retrasa la cirugía, principalmente por la menor incidencia de resangrado con el tratamiento precoz a pesar de las dificultades técnicas que pueda haber comparado con la cirugía en fase tardía 61. En nuestro Servicio, se prefiere la cirugía en fase aguda, y los valores a predominio de fase tardía solo reflejan las distintas carencias que hay que sobrepasar, desde medios económicos para el estudio diagnóstico, luego para los materiales, y finalmente de una unidad en terapia intensiva.
CONCLUSION
En nuestra muestra predominó el sexo femenino, la edad promedio fue de 47 años. La cefalea fue el motivo de consulta más frecuente.
No hubo diferencias significativas entre la escala de Glasgow de ingreso y egreso, es decir los pacientes mantuvieron su nivel de conciencia e incluso algunos mejoraron, en particular los asociados a hematomas intraparenquimatosos que fueron drenados en el acto quirúrgico.
La localización más frecuente de los aneurismas fue la arteria carótida interna derecha, en su segmento comunicante posterior. En cuanto a la cantidad, predominó la presentación como aneurismas únicos.
En su mayoría, los casos fueron operados en fase tardía.
El clipado de los aneurismas cerebrales sigue siendo una técnica con buenos resultados, y de hecho, la única con la que se cuenta en el sector público de Salud en el Paraguay e incluso la más realizada en el sector privado por motivos económicos.