INTRODUCCION
El estudio de las formas de onda de velocidad de flujo del sistema venoso fetal y en particular del ductus venoso (DV) es una herramienta muy útil para optimizar la comprensión de su hemodinamia, ya que posibilita corroborar en el feto humano investigaciones experimentales efectuadas en animales mediante técnicas más complejas e invasivas.
Adicionalmente, la incorporación de esta metodología permite identificar al feto con hipoxia grave que desarrolla acidemia e insuficiencia cardíaca y en los últimos años el estudio del DV durante el primer trimestre ha evidenciado ser útil en el rastreo de anomalías cromosómicas.
Anatomía - histología
Conocido también como conducto venoso de Arancio, se origina en el seno portal, se dirige hacia arriba, atrás y a la izquierda, desembocando junto a las venas hepáticas y vena cava inferior en el vestíbulo venoso subdiafragmático, el que a su vez vuelca su contenido en la aurícula derecha 1. Tiene una longitud al término de la gestación de 20 mm aproximadamente y forma de trompeta con su extremo proximal más angosto de 0,5 mm en la semana 20 y 2 a 3 mm al término de la gestación 2.
Mavrides et al 1 informaron que presenta abundantes fibras de elastina en toda su extensión, lo que sugiere, a diferencia de otras venas, que este vaso se comporta como un sistema de presión elevado, generando un flujo de alta velocidad permanente. Además tiene numerosas fibras nerviosas en toda su estructura e irregularidades del endotelio 3 lo que permite soportar la hipótesis de que su totalidad se encuentra regulado activamente con la capacidad de cambiar de diámetro a modo de respuesta a diferentes estímulos como la saturación de oxígeno y la viscosidad de la sangre 4.
Circulación fetal
El DV desempeña un papel muy importante en la distribución de sangre que llega desde la placenta por la vena umbilical (VU), ésta transporta sangre ricamente oxigenada desde la placenta al feto. El primer órgano en irrigar es el hígado fetal que envía el 55% de la sangre oxigenada al lóbulo izquierdo, 20% al lóbulo derecho y el 25% restante al corazón por el seno portal mediante el DV 5.
En tales condiciones el atrio derecho recibe sangre de la vena cava inferior que contiene tanto sangre de bajo como de alto tenor de oxígeno, éste último aportado por el DV. Las diferencias de velocidades y de dirección permiten separar la sangre que entra por el atrio derecho (porción terminal de la vena cava inferior) de forma a orientar de preferencia la sangre oxigenada vía crista dividens (septum secundun rígido) al atrio izquierdo y al ventrículo izquierdo. Con esta disposición la sangre transportada evita el corazón derecho y la circulación pulmonar. Desde las cavidades izquierdas pasa a los troncos supraórticos, permitiendo llevar sangre muy oxigenada al territorio cerebral y a las coronarias 6.
La recomposición de la circulación fetal se efectúa inmediatamente después del parto. Con los primeros movimientos respiratorios los pulmones se llenan de aire, se reduce la resistencia pulmonar vascular, aumenta la circulación pulmonar y el canal arterial se cierra. Después del nacimiento, el flujo venoso umbilical disminuye drásticamente y, consecuentemente, el flujo del DV y las venas hepáticas medial e izquierda también son reducidas. En torno a las 3 semanas de vida, el DV y la VU se obliteran definitivamente.
Técnica del registro de la onda de velocidad de flujo (OVF)
La identificación anatómica del DV puede objetivarse en numerosos casos mediante la ecografía bidimensional en modo B con equipos de alta resolución. Sin embargo, el Doppler color facilita su ubicación ya que su elevada velocidad de flujo es codificada por el color (aliasing), lo que realza su visualización aun cuando sea difícil identificarlo mediante el modo B.
El registro de la OVF del DV puede obtenerse si el feto se encuentra situado con el dorso anterior o posterior mediante utiliza la técnica sagital 7 (Figura 1), donde el DV puede ser apreciado en toda su extensión partiendo del seno portal. Si el feto se encuentra con el dorso a la derecha o a la izquierda, se utiliza la técnica transversal (Figura 2) situando el volumen de la muestra en el borde del seno portal. La Fetal Medicine Foundation (FMF) propuso la estandarización para unificar los criterios (Tabla 1) 8. El tiempo de examen promedio tiene que ser alrededor de 2 minutos.
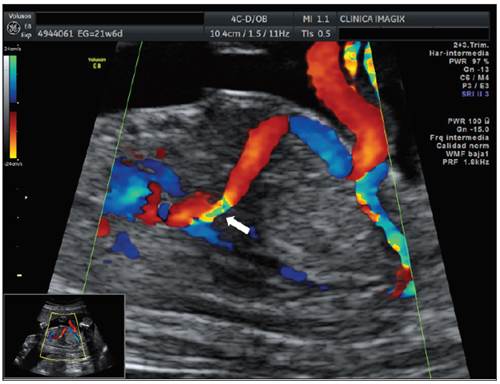
Figura 1 Corte parasagital derecho de un feto de 21,6 semanas donde se observa el trayecto del ductus venoso (flecha blanca) en su totalidad partiendo del seno portal (técnica sagital).
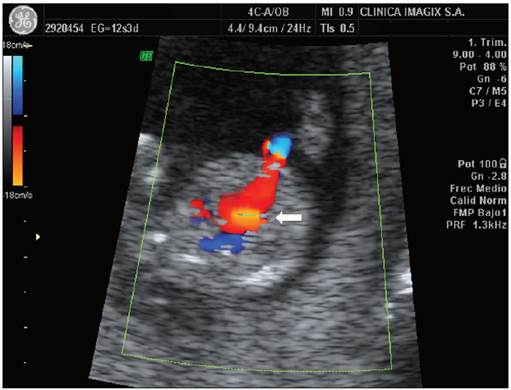
Figura 2 Corte transversal de un feto de 12,3 semanas donde se observa el efecto de aliasing (flecha) en la identificación del ductus venoso (técnica sagital).
Tabla 1 Propuesta de estandarización por parte de la Fetal Medicine Foundation (FMF) para unificar los criterios en la obtención de la onda de velocidad de flujo del ductus venoso

Se caracteriza por presentar flujo anterógrado constante compuesto por tres ondas (Figuras 3): un primer pico de máxima velocidad, que corresponde a la sístole ventricular llamada onda S, que tiene relación con el flujo eyectivo del corazón. Posteriormente, un segundo pico durante la diástole precoz o llenado pasivo ventricular denominado onda D, que corresponde a la disminución de la postcarga del ventrículo derecho, la cual favorece su llenado. Finalmente se observa un valle correspondiente al llenado activo de los ventrículos o contracción auricular denominada onda a.
Valores de referencia
Con el fin de cuantificar el flujo de sangre en el DV, varios autores 9-13 (han sugerido diferentes índices tales como el índice de pulsatilidad venoso (IPV) (S-a/Vm) equivalente al índice de pulsatilidad de los vasos arteriales y es el mas utilizado en la práctica corriente, el índice S / D, el índice ductus venoso (DVI) definida como (Sa) / S o (Sa) / D, y el índice de perfusión (PFI) definida como Tamx / S.
Los valores del IPV disminuyen con la edad gestacional, lo cual es consistente con la disminución de la postcarga ventricular debido a una disminución de la resistencia placentaria y a una mayor capacidad cardíaca.
Las alteraciones del DV pueden ser consideradas cualitativa o cuantitativamente como elevación del IPV sobre el percentil 95, onda a ausente o reversa 14 (Figura 4).
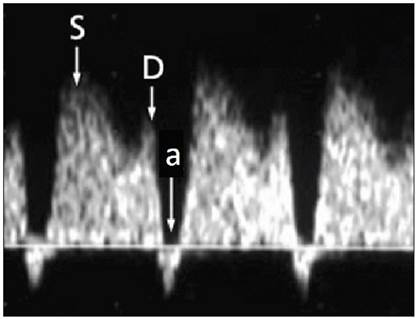
Figura 4 Componentes de la Onda de Velocidad de Flujo del Ductus Venoso, con onda a invertida (flujo reverso)
Cribado de cromosomopatías
El primero en demostrar la relación entre la OVF del DV alterado y cromosomopatías durante el primer trimestre de la gestación, fue Montenegro et al 15 quienes demostraron flujo anormal, velocidad inferior a 2 cm/s durante la contracción atrial, en fetos con anomalías cromosómicas y TN aumentada.
Posteriormente se impuso como un método válido y útil para reducir la tasa de falsos positivos en el rastreo de cromosomopatías, derivada de la combinación de la edad materna (EM) y de la translucencia nucal (TN) y, de este modo, disminuir el número de procedimientos invasivos de diagnóstico 16.
Para el cribado de cromosomopatías, si consideramos una EM media de 27 años como ocurre en Estados Unidos y muchos países de Europa occidental, la prevalencia de trisomía 21 a las 12 semanas para esa edad es de 1 en 400. En una muestra representativa de 20.000 embarazos, el asesoramiento de riesgo a través de la combinación de la edad materna, estudios bioquímicos y TN, clasificaría a 1000 de esos embarazos como de alto riesgo y este grupo comprendería a 45 (90%) de los 50 casos estimados de trisomía 21.
Una opción para el manejo del grupo de 1000 gestaciones de alto riesgo es efectuar un procedimiento invasivo, que diagnosticaría los 45 casos de trisomía 21, pero esa política representaría una pérdida fetal vinculada al procedimiento de 10 embarazos 17.
Una política alternativa sería efectuar el estudio del DV en los 1000 embarazos de riesgo y reservar el procedimiento invasivo para aquellos casos con flujo anormal -menos del 0,5% de toda la población- a expensas de una pequeña disminución de la sensibilidad (disminución del 7% que cambia el porcentaje de detección del 90% al 83%) para la detección de trisomía 21. Esa política permitirá entonces, identificar alrededor del 80% luego de efectuar una prueba invasiva en menos del 0,5% de las pacientes (10 veces menos).
Siguiendo esa política, Matias et al 18 propusieron una estrategia en dos escalones: inicialmente se analiza la TN, y en caso de que ésta sea superior o igual al percentil 95 para la edad gestacional, se estudia la OVF del DV. En este sentido apreciaron que en el grupo de fetos con TN aumentada, el 93% (54/58) de las anomalías cromosómicas tuvieron DV alterado, mientras que, si ésta era normal, sólo 3% (4/134) fueron aneuploides.
Otros autores como Zoppi et al 19 siguieron estas mismas recomendaciones y analizaron 330 fetos (34 cromosomopatías) concluyendo que la probabilidad de encontrar fetos aneuploides cuando la TN está aumentada, es mayor cuando la OVF del DV está ausente o es reversa.
Pero Nicolaides et al 20, quienes aportan el mayor número estudiado de cribado en dos niveles, en 75.821 pacientes, reportaron el 94,2 % de tasa de detección para la alteración del DV en la trisomía 21 (306/325) y una tasa de falsos positivos de 2,1%.
Entre los parámetros cuantitativos o cualitativos que se pueden obtener con la OVF del DV, aun no está claro cual de ellos es el de mayor utilidad para el cribado de cromosomopatías en el primer trimestre.
Borrell et al 21 en un estudio que incluyó a 436 mujeres y entre ellas 22 cromosomopatías, determinaron un incremento en el IPV igual o superior al 95 percentil con tasa de detección para la trisomía 21 del 73%, muy superior a la obtenida mediante el estudio cualitativo, ausencia o flujo reverso en la onda “a” del 27%, hallazgos independientes de la medida de la TN.
Sin embargo, otros autores 15,22 consideran que el mejor parámetro es precisamente la ausencia o inversión del flujo en la onda “a”, propuesta realizada también por la FMF.8
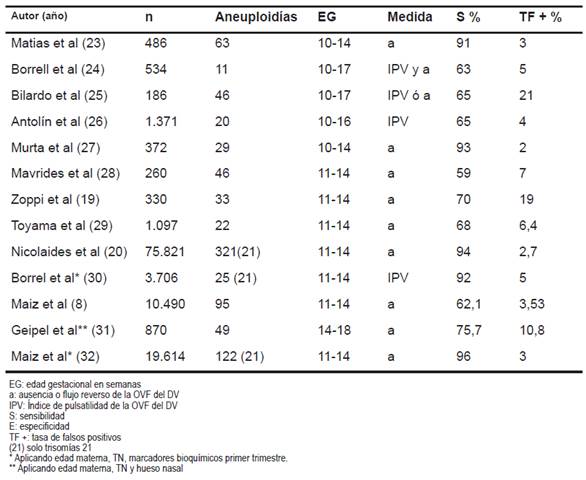
En la Tabla 2 resumimos los principales estudios publicados, resaltando que todos los autores coinciden en que la OVF del DV constituye una segunda línea en el cribado de cromosomopatías.
La sensibilidad y la especificidad de la prueba se pueden usar para definir likelihood ratio positivos y negativos 33. Suponiendo que esto sea independiente de otros factores, la relación de probabilidad se puede aplicar al algoritmo de riesgo para la detección combinada de primer trimestre 34.
Tabla 2 Sensibilidades, especificidades y tasa de falsos positivos de la OVF del DV para todas las cromosomopatías según diversos autores. 23-32
El utilizar variables dicotómicas y no continuas, hace que causen cambios extremos en el riesgo en lugar de cambios graduales observados con las variables continuas, similar a lo que sucede con el hueso nasal (ausente o presente) 35.
Sin embargo, al usar el DV como variable continua, cuantificando el IPV en lugar de simplemente categorizar la forma de la onda, se demostró que en la evaluación de poblaciones de fetos euploides y aneuploides, la proporción relativa de fetos distribuidos alrededor de la mediana de “IPV alto” aumenta en todas las trisomías 36. Los cocientes de probabilidad para el IPV se derivan, por lo tanto, utilizando un modelo mixto de la misma manera en que se generan los cocientes de probabilidad para la TN. El análisis del diagrama de dispersión determina que la inclusión de la evaluación del IPV tiene potencial de detectar una alta proporción de fetos trisómicos con TN con espesor normal, estimado que, al agregar la evaluación de IPV al algoritmo combinado del primer trimestre, se puede lograr una sensibilidad del 97% y una especificidad del 3% 37.
Actualmente, el cribado de cromosomopatías en el primer trimestre en algunos países donde es posible realizar rutinariamente el ADN fetal libre en sangre materna 38 a partir de las 9 semanas de gestación, se torna en una opción muy válida por sus resultados de altas tasas de detección y muy bajas tasas de falsos positivos 39.
Cardiopatías congénitas (CC)
Son las malformaciones congénitas más comunes 40 y la evaluación del DV puede proporcionar información adicional en el estudio de la circulación fetal en aquellas situaciones en que se produce disfunción miocárdica 41,42.
En tal sentido, se reportó una asociación significativa entre OVF anormales en el DV y la vena cava inferior en CC. Kiserud et al 43 comunicaron 30 fetos con malformaciones cardíacas con alteraciones en la OVF del DV, 12 con defectos septales, 16 con dilatación de los ventrículos y 2 con taquicardia supraventricular; reportando una sensibilidad del 64% en general y del 84% en el caso de que la patología comprometa las válvulas auriculoventriculares y los grandes vasos. No obstante, estos resultados estaban condicionados por malformaciones extracardíacas, además del número pequeño de casos incluidos.
Durante el primer trimestre o inicios del segundo, los datos de los estudios de Matias et al 44 sugieren que el aparición del flujo del ductus anormal en fetos con cariotipo normal y TN aumentada, tiende a identificar el grupo con mayor riesgo de presentar cardiopatías; datos confirmados también por otros autores 45. Este flujo anormal del DV fue observado independientemente de la malformación cardíaca y puede afectar el corazón derecho o izquierdo 46.
Sin embargo, otros autores han demostrado OVF anormales, especialmente en asociación a defectos cardíacos que afecten las cavidades derechas 47. Así, Gembruch et al 48 determinaron en un estudio que incluyó 146 fetos con CC, sensibilidad general del IPV del 19%, pero llega al 45% cuando ellas comprometen al corazón derecho aisladamente y al 83% cuando se acompaña de hydrops. Por lo tanto, estos autores plantean que en estos fetos los cambios en la OVF responden a disfunción miocárdica.
Maiz et al 8 demostraron de forma concordante que, en fetos con TN aumentada y cariotipo normal, el hallazgo de un flujo anormal en el DV aumentaba en tres veces el riesgo de un feto estar afectado por una CC, mientras que un flujo normal en el DV disminuía a la mitad ese riesgo.
Sin embargo, para Matias et al 6 sus resultados parecen ser más una contribución válida para el rastreo de cardiopatías, ya que la mayoría de los fetos con defecto cardíaco, independientemente del valor de la TN, presentan flujo ductal anormal. Además, este hecho tiene mayor importancia en la tetralogía de Fallot, en que muchos de estos casos están asociados con TN debajo del percentil 95 pero que pueden presentar flujo ductal anormal entre las 10 y 14 semanas. Siendo así, la evaluación complementaria del estándar de flujo en el DV, especialmente en los fetos con TN aumentada, podrá justificar un examen de rastreo de cardiopatías de segundo nivel, comprensiblemente menos sensible pero más específico, que permita preseleccionar más eficazmente a las embarazadas a ser beneficiadas con ecocardiografía fetal detallada en el inicio del segundo trimestre.
En una serie 18 de 486 mujeres que acudieron a una biopsia de vellosidades coriales luego del cribado del primer trimestre, se evaluó el DV antes del procedimiento invasivo. El 90,5% de los fetos con anomalías cromosómicas tenían una onda a ausente o invertida en comparación con el 3,1% de fetos euploides Sin embargo, 7/13 (54%) fetos cromosómicamente normales con forma de onda anormal del DV fueron diagnosticados mas tarde algún defecto cardíaco.
En otro estudio Bianco et al 49 determinaron una OVF alterada en el 33% de fetos con CC, de los cuales un número similar presentó muerte intrauterina o neonatal; en tanto que el grupo de fetos con cardiopatías congénitas y OVF normal, la mortalidad alcanzó el 17%. Por lo que para estos autores la observación de una onda alterada independientemente del cariotipo y la edad gestacional, es predictiva de un mal resultado perinatal.
En este contexto, se puede suponer que la evaluación de la OVF del DV no es de mucha utilidad en el cribado de cardiopatías congénitas, pero ésta se presenta como una herramienta muy útil en la monitorización de la función cardíaca en fetos portadores de CC. Por lo que ante su diagnóstico prenatal, la detección del flujo anormal indicaría descompensación cardíaca con desarrollo inminente de hydrops fetal, acompañado de un pronóstico fetal reservado. Esta medida podrá contribuir para mejorar la programación terapéutica, mejorar la salud neonatal y minimizar el trauma emocional de los padres al posibilitar el ofrecimiento de orientaciones más precoces.
Otras malformaciones
Un flujo anormal del DV en el primer trimestre de embarazo puede además ser encontrado en otras malformaciones fetales, tal como osteocondrodisplasias, artrogriposis, hernia diafragmática, onfalocele, por citar algunas que han sido descritas, generalmente por compresión torácica con compromiso de retorno venoso 6.
Gestaciones gemelares
El síndrome de transfusión feto-fetal (STFF) es una complicación propia de las gestaciones monocoriales, caracterizado por la presencia de conexiones vasculares entre las dos circulaciones fetoplacentarias. Como resultado, el flujo sanguíneo es derivado de un gemelo al otro, conllevando la sobreperfusión de un feto (receptor) y la infraperfusión de otro (feto donante) 50.
Afecta entre el 10 al 30% 51 de los embarazos gemelares monocoriónicos y es responsable del 17% de la mortalidad perinatal. La predominancia significativa de este síndrome explica la mortalidad 3-5 veces mayor en los embarazos monocoriónicos que en los dicoriónicos, principalmente antes de las 24 semanas, etapa en que la pérdida perinatal en los embarazos monocoriónicos es del 12,2% versus 1,8% en los dicoriónicos 52.
Ecográficamente se presenta con una combinación de polihidramnios en una de las cavidades, con valores del bolsillo vertical máximo (BVM) superior a 8 cm por un lado y por el otro, oligohidramnios, con BVM menor a 2 cm, lo que genera la observación de un feto “apretado” sin apenas actividad y situado junto a la pared anterior uterina (stuck twin). Además, debe presentarse en gestaciones monocoriales y ambos fetos del mismo sexo 51.
La evaluación de la OVF del DV como uno de los parámetros para la estadificación del STFF fue propuesta por Quintero et al 53.
Hecher et al 54 investigaron el perfil circulatorio del feto donante y del receptor en 20 STFF, que presentaron polihidramnios agudo entre las 17-27 semanas de gestación. Fueron realizadas investigaciones Doppler en ambos fetos de los vasos arteriales y el DV, la vena cava inferior, la vena hepática derecha y el flujo ventricular tricuspídeo y mitral. Los valores promedios de la mayoría de las velocidades de flujos en el lado venoso mostraron un significativo descenso en los dos grupos de fetos y un significativo incremento en los valores promedios de los índices, describiendo una onda pulsátil en los tres vasos venosos en el grupo de receptores, mientras que en el grupo de donantes, este sólo fue el caso en el DV. Cinco receptores y cuatro donantes tuvieron ausencia o flujo reverso durante la contracción auricular en el DV. Todos estos fetos mostraron pulsaciones en la vena umbilical.
En la evaluación fetal entre las 11 y 14 semanas, el STFF puede sospecharse precozmente por el aumento del espesor de la TN en uno o ambos fetos, evidenciando esto, sobrecarga cardíaca así como mayor prevalencia de flujo anormal en el DV durante la contracción auricular. Cuando se encuentra una TN por encima del percentil 95 en este tiempo de la gestación, las posibilidades de desarrollar luego un STFF grave se multiplican por cuatro (52) denotando que la misma constituye una disfunción cardíaca transitoria.
Matias et al 55 analizaron 99 gestaciones monocoriales biamnióticas entre las semanas 11 - 14 hallando que la asociación de la TN aumentada y la OVF del DV en uno o ambos fetos resulto un RR de desarrollar STFF de 11,86 (CI 95% 3,05-57,45), con sensibilidad de 75,0% y especificidad del 92,0%. Un recientemente meta-análisis confirmó estos hallazgos 56.
La utilización rutinaria de la evaluación del DV en gestaciones monocoriales en la semana 11 - 14, indudablemente ayuda a realizar no solo un diagnóstico precoz de aparición del STFF, sino permitir programar una intervención temprana para evitar las consecuencias graves e irreversibles que ocurren en estos fetos cuando se instala esta patología.
Hipoxia fetal crónica
La secuencia de la alteración de los flujos sanguíneos se inicia con el aumento de la impedancia del flujo de la arteria umbilical, seguida de la redistribución arterial fetal y finalmente alteración de los flujos venosos, entre ellos el DV y la alteración de la frecuencia cardíaca fetal.
En la primera parte de la adaptación hemodinámica fetal a la hipoxia se observa un aumento del volumen cardíaco hacia el ventrículo izquierdo, hecho que favorece la perfusión cerebral fetal. El mecanismo de compensación de la redistribución de flujo arterial fetal hacia el cerebro, corazón y suprarrenales permiten al feto evitar un mayor daño secundario a la hipoxia intrauterina. Cuando esta compensación llega a su límite fisiopatológico, la descompensación puede ocurrir rápidamente. La alteración del DV marca un punto de inflexión que podría conducir a la interrupción iatrogénica del embarazo afectado 57.
La evaluación del Doppler del DV juega un papel importante en el manejo de los fetos con Restricción de Crecimiento Intrauterino (RCIU) temprana con la esperanza de mejorar el momento del parto y el resultado perinatal 58.
En contraste con las alteraciones en la arteria umbilical y la arteria cerebral media, que son signos tempranos de resultados adversos, los estudios longitudinales han demostrado que las formas de onda del flujo de DV se vuelven anormales solo en estadios avanzados de compromiso fetal 59,60.
Hecher et al 61 describieron la secuencia temporal de cambios en las variables de monitorización fetal en la RCIU; hallaron que el IPV del DV y la variación a corto plazo de la frecuencia cardíaca fetal son los indicadores más importantes para valorar el momento óptimo del parto antes de las 32 semanas de gestación y se correlacionan con el resultado fetal en el momento del parto.
Por su parte, Ferrazzi et al 62 identificaron la secuencia temporal de cambios anormales de Doppler en la circulación fetal en fetos con RCIU severos y lejos del término. Los primeros cambios ocurrieron en las arterias umbilicales (ausencia de flujo de fin de diástole - AFFD) y en la cerebral media (centralización). Los cambios tardíos se asociaron significativamente con la muerte perinatal e incluyeron el flujo reverso de la arteria umbilical y alteraciones en la OVF del DV (en particular, la onda a inversa).
Otro estudio 63 demostró que la ausencia de la onda a reversa de ella del DV durante la contracción auricular, se asocian con mayor morbi-mortalidad perinatal independientemente de la edad gestacional al momento del parto.
Bilardo et al 64 analizaron 70 fetos con RCIU interrumpidos entre las 26 y 33 semanas de gestación, evaluaron mediante un análisis multivariado la utilidad de la arteria umbilical, DV y la variabilidad a corto plazo de la monitorización electrónica, en relación al mal pronóstico perinatal (mortalidad perinatal, hemorragia cerebral > grado II o displasia broncopulmonar). El mal pronóstico perinatal se observó en 27% de los fetos estudiados y la presencia del DV alterado se asoció significativamente a esta condición. Determinaron, además, que el riesgo de presentar un mal resultado perinatal aumentaba 3 y 11 veces si el IPV del DV era 2 desviaciones estándar (SD) por sobre la media de 2 a 7 días antes del parto, o bien 3 SD un día antes de la interrupción respectivamente. Estos resultados indican que la medición de la IPV es un buen predictor del resultado perinatal y puede ser útil para determinar el momento del parto en los fetos con RCIU temprana.
Baschat et al 65 analizaron prospectivamente la evolución perinatal de fetos con RCIU de origen vascular asociado a alteraciones del Doppler arterial y venoso. Tres grupos fueron individualizados para el estudio: índices Doppler de la arterial umbilical alterados (diástole cero o flujo reverso) aislados, Doppler umbilical alterados mas centralización fetal (reducción de los índices de resistencia de la arteria cerebral media) y el tercer grupo con los fenómenos anteriores presentes además de alteraciones a nivel del DV, revelando un aumento de la mortalidad perinatal, 0 vs 3% y 40% respectivamente, p<0,005) y en mayor escala con neonatos con complicaciones respiratorias (29% vs 59% y 67%% respectivamente, p<0,05). De esa manera las alteraciones de los índices Doppler del DV permiten seleccionar un grupo de alto riesgo de mortalidad y morbilidad perinatal.
A diferencia de lo observado en los vasos arteriales, las modificaciones de los vasos venosos y entre ellos el DV, se asocian temporalmente con un compromiso fetal severo 66.
Por lo tanto, la evaluación del flujo del DV es útil en la monitorización de RCIU con redistribución fetal. Una hemodinamia normal a nivel venoso nos habla de un mecanismo de compensación adecuado, por el contrario, una alteración de estos parámetros nos da cuenta de fenómenos de descompensación.
En la intención de optimizar el momento ideal de la interrupción de la gestación se incorporan al arsenal de estudios Doppler la evaluación de ratio cerebro-placentario que un futuro no lejano tendríamos la respuesta si sería un mejor marcador que el IPV del DV 67.
Morbilidad.
Un estudio llevado a cabo en centros asistenciales de Europa, multicéntrico aleatorizado, el TRUFFLE (Trial of Umbilical and Fetal Flow in Europe) involucró la randomización de 503 gestantes con RCIU con Doppler patológico que tengan edades gestacionales comprendidas entre 26 y 32 semanas de las 542 que cumplían los criterios de internación. Los grupos de aleatorización fueron los siguientes: Grupo 1 control, el nivel actual de la atención: el tiempo de nacimiento se basa en criterios cardiotocografía, a saber, la variabilidad a corto plazo por debajo de punto de corte predefinido sobre la base de la edad de gestación; Grupo 2A: el momento del parto sobre la base de los primeros cambios del ductus venoso (índice de pulsatilidad> percentil 95) y Grupo 2B: el momento del parto sobre la base de los cambios tardíos del ductus venoso (onda a ausente). Los objetivos están enfocados hacia las secuelas neurológicas graves a dos años y a largo plazo (objetivos secundarios).
Un informe preliminar de sus resultados 68 determinó que la media de la edad gestacional en el momento del diagnóstico fue de 29 ± 1,6 semanas y la media ± peso fetal estimado fue de 881 ± 217 g; en el 12 (2,4%) se produjo muerte fetal intrauterina. La edad gestacional al momento del parto fue de 30,7 ± 2,3 semanas, y el peso al nacer de 1013 ± 321 g. De los 491 recién nacidos vivos, hubo resultados disponibles para 490, de los cuales hubo 27 (5,5%) muertes y 118 (24%) recién nacidos con grave morbilidad. Estos fueron más pequeños al nacer (867 ± 251 g) y nacieron antes (29,6 ± 2,0 semanas). La muerte y la morbilidad severa se relacionaron significativamente con la edad gestacional, tanto al inicio del estudio como al momento del parto y también con la presencia de morbilidad hipertensiva materna. La mediana de tiempo hasta el parto fue de 13 días para las mujeres sin hipertensión, 8 días para las personas con hipertensión gestacional, 4 días para la preeclampsia y 3 días para el síndrome HELLP.
Un análisis de esa cohorte fue publicado recientemente 69 informando que del 92% (463/503) de los fetos que sobrevivieron, el 1% (6/443) se produjo parálisis cerebral. Entre todas las mujeres no hubo diferencias en el resultado basado en el grupo aleatorizado; sin embargo, de los sobrevivientes, un número significativamente mayor de fetos aleatorizados al grupo con ductus venoso tardío tuvo un resultado normal (133/144; 95%) que aquellos asignados al azar a cardiotocografía computarizada sola (111/131; 85%). En 38% (118/310) de los recién nacidos <32 semanas, la indicación de interrupción de la gestación fue 52% (55/106) en el grupo DV tardío, 37% (37/99) en el DV temprano y 25% (26/105) en el grupos de cardiotocografía computarizada.
Este estudio concluye que entre los RN vivos sobrevivientes, el resultado de desarrollo neurológico a los 2 años fue mejor en aquellos asignados al parto en función de los cambios tardíos del ductus venoso y no hay razones para el nacimiento basado solo en los cambios del Doppler cerebral en restricciones severas y precoces.
Agenesia del DV
La agenesia del ductus venoso (ADV) es una anomalía poco frecuente cuya prevalencia se estima que en 1/2500 gestaciones, aunque esta cifra disminuye en los centros de referencia aproximadamente de 1 en 556 70.
Como consecuencia, se origina una conexión aberrante entre la vena umbilical y la aurícula derecha mediante un shunt umbilico - porto - sistémico. Se distinguen dos variantes: intrahepáticas y extrahepáticas.
En los shunts intrahepáticos 71, el drenaje umbilical se realiza a través del sistema porta y en el caso del shunt extrahepático 72, la conexión de la vena umbilical con la aurícula derecha puede ser a través de la vena iliaca, la vena renal, la vena cava inferior, o directamente la propia aurícula derecha. La mayoría de los casos se encuentran en este grupo, en el que el drenaje de la vena umbilical es a través de estructuras vasculares derechas. Lo más frecuente es que la vena umbilical drene a la vena cava o la aurícula derecha.
Según Berg et al 71, se relacionaban con un amplio abanico de anomalías. De los 23 casos reportados seis correspondían a síndromes malformativos complejos, cuatro a alteraciones cromosómicas, otros cuatro a defectos aislados del corazón y en un caso una anomalía extrahepática aislada. Además 12 de 23 cursaron con cambios hidrópicos
Durakovic et al 73, confirmaron estos hallazgos siendo el más frecuente en los casos de shunt extrehepático la cardiomegalia (39%) y en los shunt intrahepáticos el hidrops fetal (23%).
En forma general, en toda gestación en la que se detecte cardiomegalia, polihidramnios u otros cambios hidrópicos sin una causa que los explique, hay que sospechar una alteración del ductus venoso y debería realizarse un estudio meticuloso de dicho vaso. En caso de diagnosticar su ausencia, debería realizarse una exploración ecográfica detallada, una ecocardiografía fetal y cariotipo para descartar las posibles anomalías asociadas.
Algunas revisiones afirman que hasta un 45% se asocian con cromosomopatías como síndromes de Turner o Noonan, trisomía 21 o 18, mosaicismos 74.
El pronóstico es desfavorable debido a la alta tasa de abortos espontáneos o voluntarios así como a muerte fetal intrauterina; sin embargo, los que nacen suelen tener buen pronóstico (sobre todo si son intrahepáticas y no existen anomalías asociadas). Además, hay que tener en cuenta la alta incidencia de prematuridad 75 y RCIU 76, junto con la problemática asociada a dichas entidades.















