Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO
Related links
-
 Similars in
SciELO
Similars in
SciELO
Share
Anales de la Facultad de Ciencias Médicas (Asunción)
Print version ISSN 1816-8949
An. Fac. Cienc. Méd. (Asunción) vol.46 no.1 Asunción June 2013
ARTICULO ORIGINAL
Resultados del empleo del Sistema Aspirativo Sellado en el tratamiento de heridas complejas *
Results of using the Sealed Aspiration System in the complex wounds treatment
Aldana Ubillús C
Servicio de Cirugía, Primera Cátedra de Clínica Quirúrgica. Facultad de Ciencias Médicas. Universidad Nacional de Asunción.
* Tesis presentada en la Facultad de Ciencias Médicas, Universidad Nacional de Asunción, para optar al grado de profesor asistente de la Primera Cátedra de Clínica Quirúrgica.
RESUMEN
Introducción: Las heridas complejas son de difícil tratamiento. La presión negativa tópica aporta cambios favorables a la misma existiendo dispositivos comerciales diseñados para el efecto. La ausencia de los mismos en Paraguay estimuló el desarrollo de un diseño artesanal de similares características. Objetivo: Describir y comunicar la experiencia obtenida con el empleo del Sistema Aspirativo Sellado en el manejo terapéutico de heridas complejas. Pacientes y Métodos: Estudio experimental de series temporales de pacientes que reunieron los criterios de inclusión como ser adultos de ambos sexos, portadores de heridas complejas, tratados son el Sistema Aspirativo Sellado en cinco años. Resultados: La serie incluye 47 pacientes portadores de 53 heridas con edad media de 51 años. El 62,3% presentó patologías concomitantes, 74% fueron heridas agudas y 26% heridas crónicas. La mayoría se localizó en los miembros inferiores, otras asentaron en el abdomen, miembros superiores, tórax y región sacra. El tiempo medio de utilización de la presión negativa tópica fue de 17,4 días y se comprobó mejoría trófica de la herida en todos los casos. Posteriormente el 79,25% de las heridas fueron reparadas quirúrgicamente y el 20,75% recibió tratamiento conservador. En 18 casos se utilizó la presión negativa encima de los injertos de piel y colgajos musculares. Todos presentaron buena evolución. Conclusión: En todos los casos el Sistema Aspirativo Sellado mejoró el estado tisular de una herida compleja, simplificando el tratamiento de la misma.
Palabras clave: terapia de presión negativa para heridas, resultado del tratamiento.
ABSTRACT
Introduction: The complex wounds are difficult to treatment. The negative-pressure wound therapy brings favorable changes in the same, there are commercial devices designed for this purpose but the absence of them in Paraguay stimulated the development of a traditional design with similar characteristics. Objective: Describe and communicate the experience with the use of Sealed Aspiration System in the therapeutic management of complex wounds. Patients and Methods: Experimental study of time series of patients who met the inclusion criteria such as adults of both sexes, carrying complex wounds treated with Sealed Aspiration System in five years. Results: The series included 47 patients with 53 wounds with a mean age of 51 years. 62.3% had comorbidities, 74% were acute injuries and 26% chronic wounds. Most are located in the lower limbs, others settled in abdomen, upper limbs, chest and sacral region. The average time of use of vacuum was 17.4 days, improvement was found in the wound trophic all cases. Subsequently the 79.25% of the wounds were repaired surgically and 20.75% received conservative treatment. In 18 cases we used in vacuum over skin grafts and muscle flaps, all had good performance. Conclusion: In all cases the Sealed Aspiration System improved tissue from a complex wound, simplifying the treatment thereof.
Key words: Negative-pressure wound therapy, treatment outcome.
INTRODUCCION
La herida compleja es un defecto de cobertura cutánea con exposición de elementos nobles como son por ejemplo los tendones o el hueso; puede ser extensa, con necrosis o alteración vascular y/o asociada a patologías sistémicas (1). Esta pone en juego la calidad de vida y el tratamiento es costoso. En ella, la presión negativa tópica produce ciertos cambios satisfactorios (2-5) como reducción del edema (6) con restauración del flujo sanguíneo y linfático (7), inducción a la angiogénesis y neovascularización (8), formación de tejido de granulación (5,9). Estos cambios constituyen condiciones favorables para la cicatrización de la herida (10). Además, los estudios apoyan la reducción del tamaño de la herida (11) y la disminución de la carga bacteriana (6) o la substitución de gérmenes patógenos por especies menos agresivas (12). En el año 1997 Morykwas (5) y Argenta (13) promovieron un dispositivo que asocia la cobertura de la herida con un material permeable de poliuretano, una membrana oclusiva y la aspiración proveída por una consola portátil; éste es comercializado actualmente con el nombre de VAC®. Hoy en día existen varias marcas de este tipo de equipamiento médico y el costo de los mismos suele ser elevado. En 1844 Jules Guérin ya había imaginado un equipo similar (14) mientras que en el año 2006 Bui et al. reportaron un diseño artesanal operado con aspiración mural (15); este último se refiere al uso del vacuum de pared que suele localizarse generalmente en la cercanía de una cama en el ambiente hospitalario. Los autores demuestran así la utilidad del método ante restricciones económicas o por indisponibilidad de aquellas consolas portátiles mencionadas anteriormente. En el año 2007, en Paraguay, la ausencia de estos equipos estimuló el desarrollo del Sistema Aspirativo Sellado (SAS), método artesanal empleado en nuestro Servicio.
El objetivo del presente trabajo consiste en describir y comunicar la experiencia obtenida con el empleo del SAS como método artesanal en el manejo terapéutico de heridas complejas, y valorar el aporte de la presión negativa tópica para el logro de una reconstrucción definitiva.
PACIENTES Y METODOS
Estudio experimental de series temporales que incluyó a pacientes adultos de ambos sexos, portadores de heridas complejas, tratados con el SAS entre agosto de 2007 y octubre de 2011 en la Primera Cátedra de Clínica Quirúrgica, Facultad de Ciencias Médicas de la Universidad Nacional de Asunción (1ª.CCQ-FCM-UNA), y que cumplieron con el protocolo de trabajo con el Sistema de Presión Negativa Tópica empleado en la Cátedra.
Se seleccionaron heridas exudativas o con edema, con fibrina, hipogranulación y necrosis superficial, previa limpieza quirúrgica, fístula enterocutánea asociada a herida cutánea, colgajo muscular e injerto de piel. Fueron excluidas las heridas infectadas sin toilette quirúrgico previo, las neoplásicas, aquellas con exposición de vasos o anastomosis vascular, con fístulas de origen desconocido y los pacientes con tratamiento anticoagulante o hemorragias.
Se descartaron de este modo seis pacientes y un total de cuarenta y siete pacientes (portadores de 53 heridas en total) fueron finalmente incluidos.
Las variables estudiadas fueron: edad y sexo, patologías asociadas, tipo de herida, localización, tiempo de utilización del SAS, fase en que se instaló el SAS (pre o postoperatoria) y las complicaciones del procedimiento durante la ejecución. De igual manera fueron estudiados la técnica de reconstrucción en la etapa final, la evolución, las complicaciones postoperatorias y el tiempo de cicatrización. Las modalidades de utilización del SAS como tratamiento fueron: SAS seguido por un tratamiento quirúrgico reconstructivo (injertos de piel y colgajos cutáneos); SAS seguido por un manejo conservador (cicatrización dirigida); SAS aplicado en el postoperatorio (de injertos de piel y colgajos musculares).
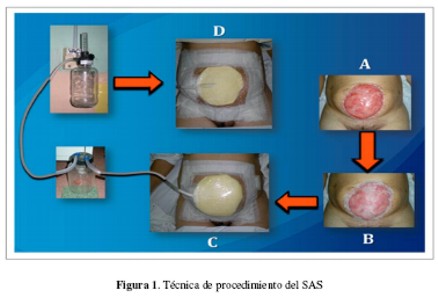
Técnica de procedimiento del SAS: Los materiales utilizados fueron: aspiración de pared o aspirador portátil, tubo K-66 con tres orificios en uno de sus extremos, esponja estéril, recipiente colector, Micropore 3M® y film alimentario transparente u Opsite® según disponibilidad.
Inicialmente se practica la curación de la herida con suero fisiológico al 0,9% y luego una fina capa de gasa vaselinada es posicionada encima de dicha lesión. Con un par de tijeras se corta la esponja a las dimensiones de la herida y se fabrica un túnel en su espesor con el mismo instrumental. La esponja es colocada sobre la gasa vaselinada, y mantenida en posición con el film alimentario u Opsite®. Esta cobertura es reforzada con Micropore® a lo largo del perímetro para asegurar el sellado del sistema. Se confecciona un pequeño ojal sobre esta membrana oclusiva, a nivel del orificio de entrada del túnel de la esponja. El extremo fenestrado del tubo k-66 es introducido a través del ojal y túnel mencionados con anterioridad; la zona de unión entre tubo y membrana oclusiva es reforzada con Micropore® u Opsite® de manera a evitar fugas de aire. El otro extremo de la K-66 es conectado con el frasco colector y con la fuente de aspiración. Se utiliza una presión negativa continua entre -70 y -100 mmHg. La curación de la herida es realizada cada 48 o 72 horas según la importancia del drenaje de líquidos o del tipo de herida (Figura 1).
El diseño del SAS difiere del dispositivo comercial primeramente en el uso de materiales cuya disponibilidad no suele ocasionar inconvenientes, sea por su bajo costo o por el fácil acceso a los mismos en nuestro medio hospitalario; sin embargo el uso de la aspiración de pared condiciona a la permanencia del paciente en el hospital durante todo el tratamiento.
RESULTADOS
La serie incluyó 47 pacientes portadores de 53 heridas (31 en mujeres y 22 en hombres), con edad media de 51 años (rango etario entre 18 y 80 años). Entre éstos 47 pacientes, 44 presentaron una sola herida durante la internación; otros tres pacientes padecieron dos heridas simultáneas en diferentes localizaciones. Finalmente tres pacientes requirieron otra internación, ulterior a la primera, por presentar una nueva herida cutánea.
El 62,3% de los pacientes presentaron patologías concomitantes (comorbilidades), siendo las más frecuentes la hipertensión arterial (43% de los casos) y la diabetes mellitus (32% de los casos). Otras menos frecuentemente encontradas fueron insuficiencia cardiaca, desnutrición, artritis reumatoide, enfermedad de Cushing, enfermedad de Parkinson, dislipidemia y obesidad.
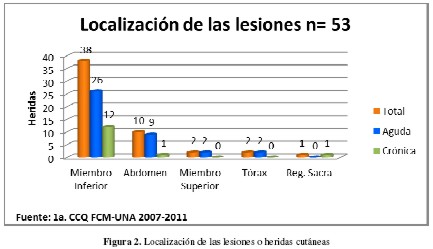
El 74% de las heridas fueron agudas (de menos de un mes de evolución) y el 26% crónicas (de más de tres meses de evolución). La mayoría estaba localizada en los miembros inferiores. Otras localizaciones, menos frecuentes fueron abdomen, miembros superiores, tórax y región sacra (Figura 2).
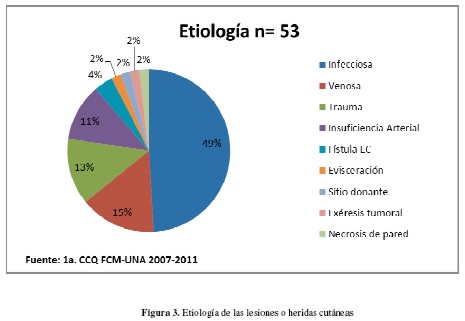
Predominaron las heridas de origen infeccioso (26 casos) debidas la mayoría de las veces a celulitis o fascitis necrotizante, más una necrosis pancreática infectada que requirió desbridamiento quirúrgico y laparostomía. Ocho presentaban patologías venosas de miembro inferior, siete heridas traumáticas, seis insuficiencias arteriales crónicas de miembro inferior, dos heridas con fístula enterocutánea secundaria a cirugía digestiva, una evisceración, un sitio donante de colgajo dorsal ancho, una exéresis tumoral en el miembro inferior y una necrosis de pared abdominal (Figura 3).
En cuanto a las características de las lesiones se observó edema y exudado en el 89%, fibrina 81%, necrosis superficial 45%, hipogranulación 26%, herida y fístula 8%, heridas complejas en pacientes con contraindicación de cirugía reconstructiva inmediata debido al delicado estado clínico general 9%. Las heridas asociaron dos o más características en la mayoría de los casos.
El tiempo de utilización del SAS fue de 17,4 días (rango de 4 y 44 días). Durante el uso en la fase preoperatoria exclusiva (preparación de la herida para una reconstrucción), el tiempo medio de utilización fue de 16,6 días. Se comprobó una mejoría trófica de la herida en todos los casos con reducción del exudado y del edema, formación satisfactoria de tejido de granulación, con fácil remoción de las placas de necrosis y fibrina. En tres ocasiones el tejido de granulación recubrió el hueso expuesto en la pierna. En cinco pacientes se obtuvo la granulación de tendones expuestos y en una paciente se obtuvo la granulación de una malla expuesta en el abdomen. Se constató el cierre espontáneo de dos fístulas enterocutáneas de bajo débito y el cierre de una fístula pancreática sobre una laparostomía. Se observó igualmente la formación de tejido de granulación sobre una pleurostomía.
Para la reconstrucción concluida la utilización del SAS, 42 heridas (79,25%) fueron reparadas quirúrgicamente y 11 (20,75%) recibieron tratamiento conservador. Las reconstrucciones utilizadas fueron: injerto de piel parcial (36 heridas); colgajo cutáneo, fasciocutáneo o musculocutáneo (6 heridas); cicatrización dirigida (11 heridas).
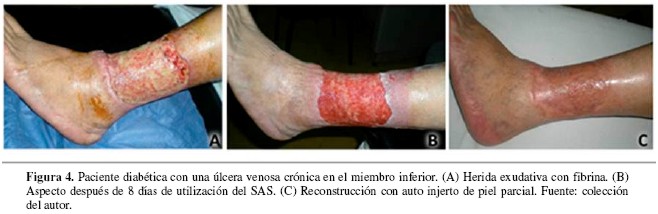
Entre las heridas tratadas con injertos de piel (36 en total), 32 (89%) cicatrizaron antes de las seis semanas postoperatorias (Figura 4).
Se observó retardo en la cicatrización en cuatro casos; dos casos requirieron un nuevo injerto y otros dos casos quedaron en cicatrización dirigida. Esto último se refiere al tratamiento no quirúrgico, conservador, con controles en consultorio para guiar la cicatrización espontánea en forma correcta mediante el uso de apósitos adecuados hasta el cierre completo de la herida. Por otra parte, durante el seguimiento a los dos años se constató una osteomielitis crónica en un paciente con previa exposición de la tibia. La infección asentó en un pequeño segmento óseo requiriendo secuestrectomía y toilette quirúrgico. Durante la utilización del SAS, siete pacientes manifestaron dolor y otros seis desarrollaron maceración cutánea peri-lesional. Esto no interrumpió el tratamiento aspirativo. No se presentaron casos de hemorragias ni complicaciones infecciosas en la fase aguda.
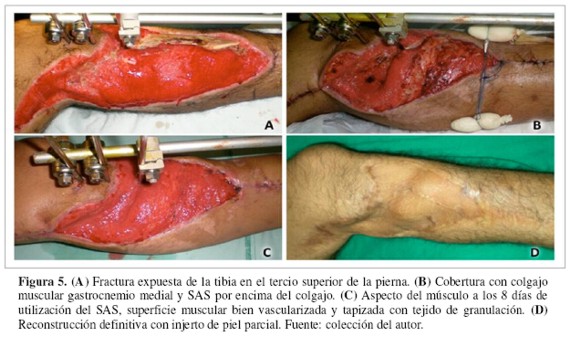
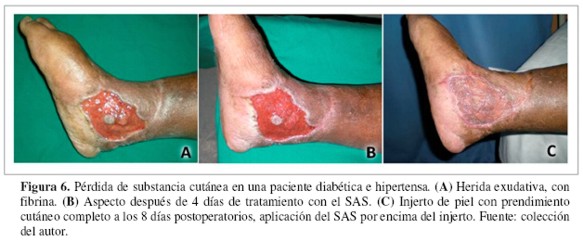
El SAS fue aplicado en el postoperatorio de cirugías reconstructivas (Figuras 5 y 6) en 18 casos (34%), tres con colgajos musculares y 15 con injertos de piel. Los colgajos musculares sobre fracturas expuestas de tibia (un colgajo gastrocnemio medial y dos colgajos hemisóleos mediales) mostraron reducción del edema, superficie homogénea y buena perfusión tisular. Los injertos de piel se localizaron en el miembro inferior; este grupo también fue tratado con el SAS en el preoperatorio durante un tiempo medio de 16 días. Las revisiones del injerto mostraron buena adhesión tisular y prendimiento en todos los casos (13 casos antes de la tercera semana y dos casos antes de cuarta semana). Dos pacientes presentaron recurrencia, debido a que ambos dejaron de asistir a sus controles respectivos.
DISCUSIÓN
El SAS consiste en la aplicación de presión negativa tópica sobre una herida. A razón de una experiencia personal en Francia (16) y con la inspiración de otras fuentes (15), se consideró la elaboración del mismo con materiales de bajo costo. Esta no se trata de una técnica nueva pues responde al mismo principio universal de uso de la presión sub-atmosférica. Como otras escuelas quirúrgicas hicieron en el extranjero (17), se adoptaron materiales más accesibles, similares pero mejor adaptados a nuestro medio y realidad. Se elaboró así un diseño que ocluye la herida con un material permeable, aislado del medio externo en forma hermética con una membrana transparente para proveer una presión negativa eficaz en la herida, sin fugas de aire.
Desde el año 2007 utilizamos el SAS en la 1ª.CCQ-FCM-UNA ante la carencia de equipamiento industrial. Recién a fines del 2009 arribaron a Paraguay unas consolas, pero las pocas unidades importadas y su elevado costo obstaculizaron el uso en la mayoría de pacientes de escasos recursos que acuden al Hospital de Clínicas. El SAS fue aplicado para mejorar el estado tisular de una herida como puente a una cirugía reconstructiva (aplicación preoperatoria), para mejorar la evolución postoperatoria de colgajos musculares e injertos de piel (aplicación postoperatoria) o como alternativa a una cirugía (cicatrización dirigida).
En este trabajo se tuvieron en cuenta la evolución, las complicaciones postoperatorias y el tiempo de cicatrización. Se incluyeron estas tres últimas variables para facilitar la interpretación de los resultados postoperatorios de los injertos cutáneos. Las indicaciones de la terapia con vacío no solo debe tener en cuenta el tipo de herida, sino también al paciente y a su estado general. Diversos pacientes sin comorbilidades han sido tratados con nuestro protocolo. Del mismo modo se ha asistido a pacientes de diversas edades, con diferentes heridas y de etiologías variadas, aún con la presencia de comorbilidades. Considerando que la mayor parte de nuestra población presentó patologías concomitantes, se puede notar que esto no constituyó obstáculo alguno para la indicación del uso del SAS. Más bien, el manejo adecuado de una herida en pacientes hipertensos o diabéticos –comorbilidades más frecuentemente constatadas en este estudio- tal vez colaboró en cierto modo con el mejor control de la patología concomitante, mediante una disminución del estrés como factor desencadenante de una compensación metabólica o de la hipertensión arterial. En situaciones de extrema morbilidad, no obstante, es importante que sea priorizado el estado general del paciente. Si bien en la 1ª. CCQ se suele recurrir a un manejo multidisciplinario a través de un sistema de interconsultas con las diferentes especialidades médicas, el traslado del enfermo a otro Servicio puede ser requerido para realizar un tratamiento clínico optimizado. Esto dificulta el seguimiento estricto del SAS por nuestro equipo, obligándonos a abandonar en estos pacientes el protocolo de trabajo propuesto.
Las heridas agudas predominaron a las crónicas, pues se constataron más internaciones de urgencia que en forma programada. Como dicta la literatura, el vacuum se utilizó en heridas de diversas localizaciones. La importancia de esta realidad se ve reflejada en la variedad de situaciones que pueden ser resueltas mediante este tipo de tratamiento, desde una pequeña herida del dedo del pie hasta grandes defectos de la cabeza o del tronco (18-21). Las etiologías fueron múltiples, incluyendo heridas infectadas luego del debridamiento quirúgico. Así, la presión negativa no substituyó el tratamiento quirúrgico inicial para una infección tisular y fue más bien considerada como una medida adyuvante a la cirugía de urgencia y al tratamiento antibiótico correspondiente. Las lesiones debidas a una insuficiencia venosa crónica de miembros inferiores merecen una especial atención; en este trabajo han sido tratadas heridas crónicas de varios años de evolución. Dependiendo del aspecto macroscópico de las mismas fueron realizadas biopsias múltiples previas a cualquier tratamiento para descartar una neoplasia subyacente. Todos los pacientes fueron advertidos de la necesidad de tratar la patología vascular de base después de nuestro manejo terapéutico, caso contrario la recurrencia sería latente. El tiempo promedio de utilización del SAS durante la preparación de la lesión como puente hacia una reconstrucción final fue de 16,6 días, cifra comparable con lo descrito en la literatura (22). Sin embargo esta cifra depende de los diferentes tipos de herida y del aspecto de las mismas en la evaluación clínica inicial.
Aunque no se haya realizado un estudio comparativo con curaciones convencionales, por ejemplo el simple uso de gasas y vendas, la experiencia clínica en la especialidad permite afirmar una reducción del tiempo de preparación de una herida compleja con el SAS. En efecto, normalmente este tipo de lesión suele requerir un tiempo más prolongado para conseguir las condiciones ideales de reconstrucción. Se constató mejoría tisular en todos nuestros pacientes; incluyendo casos difíciles como la granulación sobre una malla abdominal, huesos y tendones expuestos. En coincidencia con otros autores (23), se apreció la reducción de líquidos y mejoría en la perfusión tisular.
No se objetivó una disminución de la colonización bacteriana pues no fueron tomadas muestras de cultivo sistemáticamente; no obstante se observó la ausencia de infecciones evolutivas. En ciertos casos la reducción del tamaño del defecto cutáneo permitió considerar la cicatrización dirigida; ciertamente, la terapia con vacío produce este efecto en forma más precoz si la comparamos con el tratamiento convencional de una herida (24). En esta serie dos fístulas enterocutáneas postoperatorias de bajo débito cerraron espontáneamente. En este contexto, la utilidad de la presión negativa tópica ya ha sido demostrada (25). En fístulas sin protrusión mucosa, el cierre espontáneo es posible cuando el débito intestinal es bajo, mientras que en fístulas de alto débito o con protrusión mucosa se direcciona el contenido intestinal hacia la fuente de aspiración; esto evita el trauma químico de la herida circundante, permitiendo la granulación y cicatrización de esta última. La mayoría de las lesiones fueron reparadas quirúrgicamente con injertos de piel parcial. Con la técnica convencional la mayoría de las heridas cicatrizaron antes de la sexta semana pero algunos casos presentaron cicatrización retardada. Esto es lo que normalmente se puede esperar con esta técnica estándar, sin aspiración, pues es difícil que el prendimiento del injerto sea absoluto. En cambio durante el tiempo en que se utilizó el SAS sobre un injerto de piel, la cicatrización definitiva fue certera y en un plazo de tiempo inferior. Esto se explica por la reducción de exudados bajo el injerto, la aplicación uniforme de éste sobre el lecho y por la inmovilización eficaz (26). En cuanto a otras técnicas de reconstrucción, según Eisenhardt et al., la reducción del edema mejora la microcirculación muscular (27). En efecto, en el presente trabajo se pudo constatar que la aplicación del SAS sobre colgajos musculares permitió el desarrollo de una superficie menos exudativa y más homogénea, propicia para una reconstrucción definitiva. Han sido resueltas de este modo tres fracturas expuestas, recubiertas con colgajos musculares y SAS en forma exitosa. La reducción del edema se explica en este caso por la presión directa sobre el músculo, la aspiración de líquidos con desplazamiento de los mismos del espacio extracelular, y la reducción de infiltrados linfocitarios y de macrófagos que limita la expresión inflamatoria de ciertas citoquinas (27-28).
En caso de exposición ósea se aconseja mantener al hueso en un ambiente húmedo y limpio para evitar la desecación (29). Es importante realizar las curaciones con una frecuencia seguida para minimizar los riesgos infecciosos. Para evitar infecciones es preferible, además, no utilizar multicapas de pequeñas esponjas en contacto con la herida (29) y no olvidar interponer la gasa vaselinada, caso contrario, se expondría a inclusiones de cuerpos extraños o a daño tisular durante la ablación de la esponja. Esta medida incluye a las laparostomías, donde es preferible utilizar algún material no adherente (30,31).
La literatura reporta también una retención de líquidos en la herida como probable causa de un síndrome de shock tóxico (32). Este hecho podría deberse a una falla en la aspiración (obstrucción del tubo, fuga de aire) o a la falta de curaciones. El control del correcto funcionamiento del sistema es de rigor. En este trabajo no se presentó ningún paciente con esta complicación.
La maceración cutánea puede ser evitada colocando una esponja del mismo tamaño que la herida y no sobre la piel sana; algunos equipos utilizan láminas de Alginato sobre la zona irritada y por debajo del film adhesivo (24). En este trabajo se utilizó betametasona en crema asociada a una gasa vaselinada sobre la zona irritada. En cuanto al dolor, en la mayoría de los casos fue bien tolerado y no impidió la continuidad del tratamiento aspirativo. El tratamiento analgésico suele ser suficiente para paliar esta molestia.
Entre las complicaciones, Barringer et al. reportaron dos pacientes con depleción volumétrica probablemente por aspiración importante de fluidos (33). Ambos casos subrayan la importancia de monitorizar el débito aspirativo y realizar las correcciones hidroelectrolíticas del medio interno. En el presente trabajo no se constató este inconveniente, siendo el débito aspirativo de poca importancia en todos los casos.
Los sangrados constituyen tal vez una de las complicaciones más frecuentes y graves (34). Como medida preventiva se debe evitar la aspiración sobre vasos expuestos (35) o en sitios de anastomosis (6) y extremar cuidados en pacientes con alto riesgo de hemorragias, tratamiento con anticoagulantes o antiagregantes plaquetarios. En nuestra experiencia no se constataron hemorragias, tal vez debido a los cuidados que se tuvieron y a los criterios de exclusión. Además mientras se utilice una presión de aspiración estricta entre -70 mmHg y -100 mmHg el peligro de sangrado es bajo. El Consenso Internacional dicta como rango terapéutico una presión entre -40 mmHg y -150 mmHg para obtener sin riesgos los efectos deseados (36). Entre las contraindicaciones se menciona a la exposición de elementos nobles como el caso de los nervios (6), heridas neoplásicas malignas y osteomielitis (37). En efecto éstas últimas precisan un tratamiento específico previo para luego abordar la reconstrucción correspondiente. No se incluyeron pacientes con este tipo de heridas.
El SAS es un método artesanal que utiliza materiales de bajo costo y una fuente de aspiración, constituyéndose en una herramienta terapéutica sumamente interesante; sin embargo no supera en calidad o comodidad a los dispositivos industriales. Estas últimas son consolas prácticas, livianas, transportables y con un sistema de alarma o dispositivos de seguridad que aseguran un funcionamiento óptimo que utilizan una batería recargable con varias horas de autonomía y permiten realizar el tratamiento en forma ambulatoria. No obstante tienen un costo muy elevado y hasta el momento la utilización de los mismos no está cubierta por ningún tipo de seguro médico en nuestro país. Por ello el SAS es un elemento útil pero no de primera línea y en nuestra experiencia permitió salvar situaciones clínicas dramáticas en pacientes con pocos recursos económicos. Sin embargo la curva de aprendizaje merece ciertos cuidados. La riqueza de la literatura confirma la necesidad de dominar conceptos e indicaciones, de identificar las contraindicaciones y reconocer las complicaciones. El SAS, en buenas manos, puede resolver casos complejos constituyendo una valiosa herramienta de trabajo, como se demostró en este trabajo, cuyo manejo terapéutico brindó resultados positivos con mejoría tisular de heridas agudas y crónicas, contusas o traumáticas, dehiscentes, edematosas, exudativas, fibrinosas, con hipogranulación, fístulas entero-cutáneas y laparostomías, simplificando el tratamiento de una herida compleja. Pero también puede ser un arma de doble filo, altamente peligroso, si se lo utiliza indiscriminadamente o con desconocimiento de sus posibles consecuencias. Aconsejamos, por lo tanto, una formación exhaustiva de la teoría y la práctica tanto del personal de blanco como del paciente y de su entorno, antes de recurrir a este tipo de procedimiento.
CONFLICTOS DE INTERÉS
El autor declara no tener conflictos de interés.
REFERENCIAS BIBLIOGRÁFICAS
1. Ferreira MC, Tuma Junior P, Carvalho VF, Kamamoto F. Complex wounds. Clinics. 2006; 61(6): 571-578. [ Links ]
2. Tanna N, Clary MS, Conrad DE, Lenert J, Sadeghi N. Vacuum-assisted closure for wound dehiscence in head and neck reconstruction. Plast Reconstr Surg. 2009 Jan;123(1):19e-21e. [ Links ]
3. Byrnside V, Glasgow M, Gurunluoglu R. The vacuum-assisted closure in treating craniofacial wounds. J Oral Maxillofac Surg. 2010 Apr;68(4):935-42. [ Links ]
4. Poglio G, Grivetto F, Nicolotti M, Arcuri F, Benech A. Management of an exposed mandibular plate after fibula free flap with vacuum-assisted closure system. J Craniofac Surg. 2011 May;22(3):905-8. [ Links ]
5. Morykwas MJ, Argenta LC, Shelton-Brown EI, McGuirt W. Vacuum-assisted closure: a new method for wound control and treatment: animal studies and basic foundation. Ann Plast Surg. 1997 Jun;38(6):553-62. [ Links ]
6. Orgill DP, Bayer LR. Update on negative-pressure wound therapy. Plast Reconstr Surg. 2011 Jan;127 Suppl 1:105S-115S. [ Links ]
7. Banwell PE, Téot L. Topical negative pressure (TNP): the evolution of a novel wound therapy. J Wound Care. 2003 Jan;12(1):22-8. [ Links ]
8. Labler L, Rancan M, Mica L, Härter L, Mihic-Probst D, Keel M. Vacuum-assisted closure therapy increases local interleukin-8 and vascular endothelial growth factor levels in traumatic wounds. J Trauma. 2009 Mar;66(3):749-57. [ Links ]
9. Morykwas MJ, Faler BJ, Pearce DJ, Argenta LC. Effects of varying levels of subatmospheric pressure on the rate of granulation tissue formation in experimental wounds in swine. Ann Plast Surg. 2001 Nov;47(5):547-51. [ Links ]
10. Erba P, Ogawa R, Ackermann M, Adini A, Miele LF, Dastouri P, Helm D, Mentzer SJ, D'Amato RJ, Murphy GF, Konerding MA, Orgill DP. Angiogenesis in wounds treated by microdeformational wound therapy. Ann Surg. 2011 Feb;253(2):402-9. [ Links ]
11. Isago T, Nozaki M, Kikuchi Y, Honda T, Nakazawa H. Effects of different negative pressures on reduction of wounds in negative pressure dressings. J Dermatol. 2003 Aug;30(8):596-601. [ Links ]
12. Mouës CM, Vos MC, van den Bemd GJ, Stijnen T, Hovius SE. Bacterial load in relation to vacuum-assisted closure wound therapy: a prospective randomized trial. Wound Repair Regen. 2004 Jan-Feb;12(1):11-7. [ Links ]
13. Argenta LC, Morykwas MJ. Vacuum-assisted closure: a new method for wound control and treatment: clinical experience. Ann Plast Surg. 1997 Jun;38(6):563-76. [ Links ]
14. Glicenstein J. Jules Guérin (1801–1885) et locclusion pneumatique des plaies. Ann Chir Plast Esthet. 2008 Aug;53(4):378-82. [ Links ]
15. Bui TD, Huerta S, Gordon IL. Negative pressure wound therapy with off-the-shelf components. Am J Surg. 2006 Aug;192(2):235-7. [ Links ]
16. Aldana C, Sultan S, Sagnat A, Malka G, Danino A. Système de pansement à pression négative avec le vide murale. Etude rétrospective sur 25 cas. Résultats cliniques, discussion légale. 51ème Congrès National SOFCPRE. Marseille 2006. [ Links ]
17. Webster R, Ely PB, Milani A, Filho GP, Valiati A, Filho AM, Cunha T, Rech D. Alternative materials in vacuum-assisted closure. Plast Reconstr Surg. 2011 Dec;128(6):784e-5e. [ Links ]
18. Bonnet F, Paraskevas A, Petit F, Lantieri L. Utilisation du Vacuum-Assisted Closure® pour la reconstruction d'une perte de substance complexe de la verge. Ann Chir Plast Esthet. 2006 Jun;51(3):249-52. [ Links ]
19. Wong LK, Nesbit RD, Turner LA, Sargent LA. Management of a circumferential lower extremity degloving injury with the use of vacuum-assisted closure. South Med J. 2006 Jun;99(6):628-30. [ Links ]
20. Hsia JC, Moe KS. Vacuum-assisted closure therapy for reconstruction of soft-tissue forehead defects. Arch Facial Plast Surg. 2011 Jul-Aug;13(4):278-82. [ Links ]
21. Graewe FR, Ross RJ, Perks T, van der Walt C, Zuehlke AE. A novel application of vacuum-assisted closure in auricular reconstruction. Plast Reconstr Surg. 2009 Dec;124(6):440e-2e. [ Links ]
22. Le Franc B, Sellal O, Grimandi G, Duteille F. Évaluation coût-efficacité de la thérapie par pression négative dans la préparation chirurgicale des pertes de substance cutanée. Ann Chir Plast Esthet. 2010 Jun;55(3):195-203. [ Links ]
23. Morykwas MJ, Simpson J, Punger K, Argenta A, Kremers L, Argenta J. Vacuum-assisted closure: state of basic research and physiologic foundation. Plast Reconstr Surg. 2006 Jun;117(7 Suppl):121S-126S. [ Links ]
24. Mouës CM, van den Bemd GJ, Heule F, Hovius SE. Comparing conventional gauze therapy to vacuum-assisted closure wound therapy: a prospective randomised trial. J Plast Reconstr Aesthet Surg. 2007;60(6):672-81. [ Links ]
25. D'Hondt M, Devriendt D, Van Rooy F, Vansteenkiste F, D'Hoore A, Penninckx F, Miserez M. Treatment of small-bowel fistulae in the open abdomen with topical negative-pressure therapy. Am J Surg. 2011 Aug;202(2):e20-4. [ Links ]
26. Dunn RM, Ignotz R, Mole T, Cockwill J, Smith JM. Assessment of gauze-based negative pressure wound therapy in the split-thickness skin graft clinical pathway-an observational study. Eplasty. 2011 Mar 16;11:e14. [ Links ]
27. Eisenhardt SU, Schmidt Y, Thiele JR, Iblher N, Penna V, Torio-Padron N, Stark GB, Bannasch H. Negative pressure wound therapy reduces the ischaemia/reperfusion-associated inflammatory response in free muscle flaps. J Plast Reconstr Aesthet Surg. 2011. In Press. [ Links ]
28. Hanasono MM, Skoraki RJ. Securing skin grafts to microvascular free flaps using the vacuum-assisted closure (VAC) device. Ann Plast Surg. 2007 May;58(5):573-6. [ Links ]
29. Argenta LC, Morykwas MJ, Marks MW, DeFranzo AJ, Molnar JA, David LR. Vacuum-assisted closure: state of clinic art. Plast Reconstr Surg. 2006 Jun;117(7 Suppl):127S-142S. [ Links ]
30. Layton B, Dubose J, Nichols S, Connaughton J, Jones T, Pratt J. Pacifying the open abdomen with concomitant intestinal fistula: a novel approach. Am J Surg. 2010 Apr;199(4):e48-50. [ Links ]
31. Brox-Jiménez A, Díaz-Gómez D, Parra-Membrives P, Martínez-Baena D, Márquez-Muñoz M, Lorente-Herce J, Jiménez-Vega J. Sistema de cierre asistido por vacío en heridas complejas. Estudio retrospectivo. Cir Esp. 2010 May;87(5):312-7. [ Links ]
32. Gwan-Nulla DN, Casal RS. Toxic shock syndrome associated with the use of the vacuum-assisted closure device. Ann Plast Surg. 2001 Nov;47(5):552-4. [ Links ]
33. Barringer CB, Gorse SJ, Burge TS. The VAC dressing--a cautionary tale. Br J Plast Surg. 2004 Jul;57(5):482. [ Links ]
34. Petzina R, Malmsjö M, Stamm C, Hetzer R. Major complications during negative pressure wound therapy in poststernotomy mediastinitis after cardiac surgery. J Thorac Cardiovasc Surg. 2010 Nov;140(5):1133-6. [ Links ]
35. White RA, Miki RA, Kazmier P, Anglen JO. Vacuum-assisted closure complicated by erosion and hemorrhage of the anterior tibial artery. J Orthop Trauma. 2005 Jan;19(1):56-9. [ Links ]
36. Birke-Sorensen H, Malmsjo M, Rome P, Hudson D, Krug E, Berg L, Bruhin A, Caravaggi C, Chariker M, Depoorter M, Dowsett C, Dunn R, Duteille F, Ferreira F, Francos Martínez JM, Grudzien G, Ichioka S, Ingemansson R, Jeffery S, Lee C, Vig S, Runkel N; International Expert Panel on Negative Pressure Wound Therapy [NPWT-EP], Martin R, Smith J. Evidence-based recommendations for negative pressure wound therapy: treatment variables (pressure levels, wound filler and contact layer)--steps towards an international consensus. J Plast Reconstr Aesthet Surg. 2011 Sep;64 Suppl:S1-16. [ Links ]
37. Lambert KV, Hayes P, McCarthy M. Vacuum assisted closure: a review of development and current applications. Eur J Vasc Endovasc Surg. 2005 Mar;29(3):219-26. [ Links ]