Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO
Related links
-
 Similars in
SciELO
Similars in
SciELO
Share
Anales de la Facultad de Ciencias Médicas (Asunción)
Print version ISSN 1816-8949
An. Fac. Cienc. Méd. (Asunción) vol.45 no.2 Asunción Dec. 2012
ARTICULO ORIGINAL
Relación entre la edad gestacional en recién nacidos con menos de 1500g y ductus arterioso persistente
Relation between the gestational age in newborn child less than 1500 grams and in the persistence of ductus arteriosus
Silvero Isidre RA, Oreggioni Weiberlen ML, Mir Ihara PK
Estudiantes de Medicina. Facultad de Ciencias Médicas. Universidad Nacional de Asunción
RESUMEN
Introducción: El ductus arterioso durante la vida fetal es un vaso que conduce la sangre desde la arteria pulmonar a la aorta que permite que el 90% del gasto ventrículo derecho sea derivado a la circulación sistémica y solo el 10% a la circulación pulmonar. El ductus con cortocircuito de izquierda a derecha es un problema frecuente en recién nacidos menores de 1500 gramos y cuando el ductus se hace termodinámicamente significativo, con síntomas de compromiso cardiorrespiratorio, aumenta la morbilidad. Objetivo: Determinar el grado de asociación entre ductus arterioso persistente en recién nacidos con un peso menor de 1500 gramos y la edad gestacional. Material y Métodos: Diseño observacional, analítico de casos y controles. Método de muestreo no probabilístico de casos consecutivos. Fuente de datos de segundo orden. El periodo de estudio fue desde el 2 de enero del año 2009 al 5 de noviembre del año 2010. Se estudiaron 1972 niños nacidos menores de 1500 gramos registrados en el Departamento de Neonatología del Hospital Materno Infantil del Hospital de Clínicas, sin distinción de sexo, raza y edad gestacional. La persistencia de Ductus Arterioso fue determinada por medios clínicos o ecocardiográficos. Resultados: Se han estudiado un total de 1972 niños, con una incidencia de 42 % (826 casos). Para la primera parte del estudio se han dividido en dos grupos. Grupo 1: Rango entre 21 a 29 semanas. Media gestacional de 26.77 +/- 1,93 semanas, pesos promedio de 953.15 g. Incidencia de 51,06% (602 casos). Grupo 2: Rango entre 30 a 38 semanas. Media gestacional de 31,66 +/- 1,57 semanas, pesos promedio de 1287,25 g. Incidencia de 28,24% (224 casos). Analizando los grupos se obtuvo x²: 100.12 y OR: 2,26. Para determinar que la relación es inversa, se procedió a buscar la regresión y correlación. Se decidió agrupar a los niños en grupos, los cuales tenían 3 semanas cada uno. Se ha hallado: Coeficiente de Correlación= -0,563926293, R²= 0,318012864, pero al quitar los grupos de los extremos, con quienes se tuvo inconvenientes (Grupo de 21 – 23 y Grupo de 36 – 38), se halló una correlación casi perfecta de -0,972 y R²= 0,944. Conclusión: La asociación es inversa entre edad gestacional y persistencia de Ductus Arterioso. Con un 165% más persistencia de ductus arterioso para los niños de 21 a 29 semanas. Concluyendo que el 31,8% de la persistencia de ductus arterioso se debe a la menor edad gestacional, pero pudiendo aumentar hasta 94,4% quitando los grupos de los extremos.
Palabras clave: Ductus. Edad gestacional. Relación. Muy bajo peso de nacimiento
ABSTRACT
Introduction: During the fetal life the ductus arteriosus is a vessel that carries blood from the pulmonary artery to the aorta, which allows that the 90% of right ventricular output is derived to the systemic circulation and only the 10% to the pulmonary circulation. The ductus with left to right short circuit is a common problem in newborn child under 1500 grams and when the ductus becomes thermodynamically significant, with cardio-respiratory compromise symptoms, the morbidity increases. Objective: Determine the category of association between persistent ductus arteriosus in newborn child that weigh less than 1500 grams and the gestational age. Material and Methods: Observational design, Case-control analytic. Non-probability method in consecutive cases. Second order source data. The study period was from January 2th, 2009 to November 5th, 2010. In this research, 1972 infants born under 1500 grams have been studied. They were registered in the Neonatal Department of Hospital Materno Infantil of Hospital de Clínicas, without distinction of sex, race and gestational age. Persistent ductus arteriosus was determined by clinical or echocardiography means. Results: 1972 children in general were studied with an incidence of 42% (826 cases). For the first part of the study, children were divided into two groups. Group 1: Range between 21-29 weeks. Gestational average of 26.77 + / - 1.93 weeks, average weight 953.15 g. Incidence of 51.06% (602 cases). Group 2: Range between 30-38 weeks. Gestational average of 31.66 + / - 1.57 weeks, average weight 1287.25 g. Incidence of 28.24% (224 cases). After analyze the two groups the results obtained were x ²: 100.12 and OR: 2.26. In order to determinate the relationship is inverse, the investigators proceeded to look for the regression and correlation. Then, they decided to divide the children into groups, which were 3 weeks each. It has been found: Correlation Coefficient = -0.563926293, R ² = 0.318012864, but by removing the end groups, with whom they had drawbacks (Group 21-23 and Group 36-38), we found an almost perfect correlation of -0.972 and R² = 0.944. Conclusion: The association between gestational age and persistent ductus arteriosus is reversed, with an increase of 165% persistence of ductus arteriosus in children of 21-29 weeks. In other to summarize, the 31.8% of persistent ductus arteriosus is due to the lower gestational age, but it may increase to 94.4% if the end groups are removing.
Key words: Ductus. Gestational age. Relationship. Very low birth weight.
INTRODUCCIÓN
El peso al nacer es un excelente indicador de la cantidad y tipo de asistencia médica que requerirá el recién nacido y es uno de los mejores predictores de mortalidad infantil. Los neonatos con peso de nacimiento menor a 1500 g se los clasifica como de muy bajo peso de nacimiento (MBPN). Aunque el porcentaje de neonatos de MBPN, según las estadísticas en diversos países, es de 0,7 al 1% de los nacimientos, constituyen entre el 20 al 50% de los que fallecen antes del primer año de vida, según un estudio latinoamericano. La incidencia de RNMBP es de 1,35% en el Centro Materno Infantil del Hospital de Clínicas (1).
Cabe destacar que el Centro Materno Infantil del Hospital de Clínicas es la única unidad de neonatología del Paraguay en pertenecer a la Red Neocosur. Esta es una agrupación de unidades de neonatología del cono sur, con la misión de contribuir al mejoramiento continuo de los indicadores de salud neonatal, y uno de los proyectos que contempla es la evaluación continua del pronóstico del recién nacido con muy bajo peso en la región del cono sur americano (2).
La sobrevida de los recién nacidos ha aumentado considerablemente en las últimas décadas con el desarrollo de los cuidados intensivos neonatales y los avances tecnológicos. Como consecuencia existe un aumento en la morbilidad, en especial en los neonatos de MBPN.
Una de las causas de morbilidad en el recién nacido es la persistencia de ductus arterioso (PDA). El ductus arterioso deriva de la porción dorsal del sexto arco aórtico y conecta el tronco de la arteria pulmonar con la aorta descendente, distal al origen de la arteria subclavia izquierda (3).
El ductus arterioso tiene una función esencial en la oxigenación del feto. Los tejidos más sensibles al oxigeno que sirven para optimizar la distribución del mismo, y a los que se los puede considerar como sistema de homeostasis del oxígeno, incluyen el cuerpo carotideo, cuerpos neuroepiteliales del pulmón, células cromafines de la medula adrenérgica fetal y células musculares lisas en una variedad de vasos, uno de esos vasos es el ductus arterial (4).
Por ende la oxigenación es de vital importancia para determinar el cierre del ductus arterioso (5). Se han investigado mecanismos que tratan de dilucidar estos procesos (6). Esto podría explicar su asociación con las afecciones o trastornos respiratorios y la relación inversa con la edad gestacional (7). Otros factores de riesgo incluyen bajo peso al nacer, diabetes gestacional, algunos medicamentos en el embarazo e incluso se reportan factores de riesgo genéticos (8-11).
La PDA más allá del periodo neonatal inmediato, tras la disminución de la resistencia vascular pulmonar, produce un cortocircuito de izquierda – derecha. En los casos de ductus muy grandes el aumento del flujo pulmonar aumenta el flujo de retorno a la aurícula izquierda, el volumen de llenado del ventrículo izquierdo (precarga) y un aumento del volumen latido, lo que lleva a la dilatación y aumento de presión tele diastólica del ventrículo izquierdo con dilatación y aumento de la presión de la aurícula izquierda. El resultado es el edema pulmonar y el fallo cardiaco izquierdo. También se pueden disparar los mecanismos compensatorios mediados por el sistema simpático adrenal y renina-angiotensina-aldosterona, con hiperdinamia, hipertrofia miocárdica y retención de líquidos con sobrecarga de volumen.
Se puede llegar a comprometer el flujo coronario por robo aórtico en diástole combinado con el aumento de presiones tele diastólica comentada antes. Esta situación suele ser mal tolerada en prematuros y en niños nacidos a término con un PDA grande, en otros puede pasar inadvertido. Puede suceder que el hiperflujo pulmonar impida la regresión rápida de la capa muscular lisa de las arterias pulmonares, desarrollando hipertensión pulmonar fija por enfermedad vascular pulmonar, con alteración de la íntima, trombosis y proliferación fibrosa. En estos casos el ductus persiste con un cortocircuito invertido (derecha–izquierda).
La necesidad de mejorar la sobrevida y al mismo tiempo disminuir la morbilidad del RNMBP se plantea como uno de los desafíos de la neonatología. Más de la mitad de los que sobreviven al alta hospitalaria lo hacen con complicaciones. Acciones dirigidas a mejorar la sobrevida sin morbilidad en el Recién nacido tendrían un impacto importante en la salud pública. Conocer los indicadores de morbilidad y mortalidad en centros de atención es útil para implementar mejoras y optimizar resultados, es decir, disminuir la morbilidad. Se justifica la importancia de conocer acerca de esta enfermedad, pues la incidencia varía desde un 20% en prematuros mayores de 32 semanas hasta el 60% en menores de 28 semanas según la literatura (12).
La interrogante que se plantea es el grado de relación de la patología con la edad gestacional en niños menores de 1500 g, pues la edad gestacional aumentaría las probabilidades de padecer la enfermedad. Esto demostraría dentro de los RNMBP, la gran importancia del desarrollo del feto y cómo las semanas de gestación pueden afectar el desarrollo de toda la vida de una persona.
El objetivo de este estudio fue hallar una asociación entre la PDA en niños nacidos con un peso máximo de 1500 gramos y la edad gestacional.
MATERIALES Y MÉTODOS
Diseño observacional, analítico de casos y controles. Se incluyeron 1972 niños nacidos de hasta 1500 gramos registrados en el Hospital Materno Infantil del Hospital de Clínicas durante el periodo del 2 de enero de 2009 al 5 de noviembre de 2010. Se hallaron 826 casos de PDA, sin distinción de sexo, raza y edad gestacional. Criterios de exclusión: Fichas incompletas, muerte antes de diagnóstico de PDA, mayores a 1500 g. El diagnostico de PDA fue determinado por medios clínicos o ecocardiográficos. Método de muestreo no probabilístico de casos consecutivos. Fuente de datos de segundo orden.
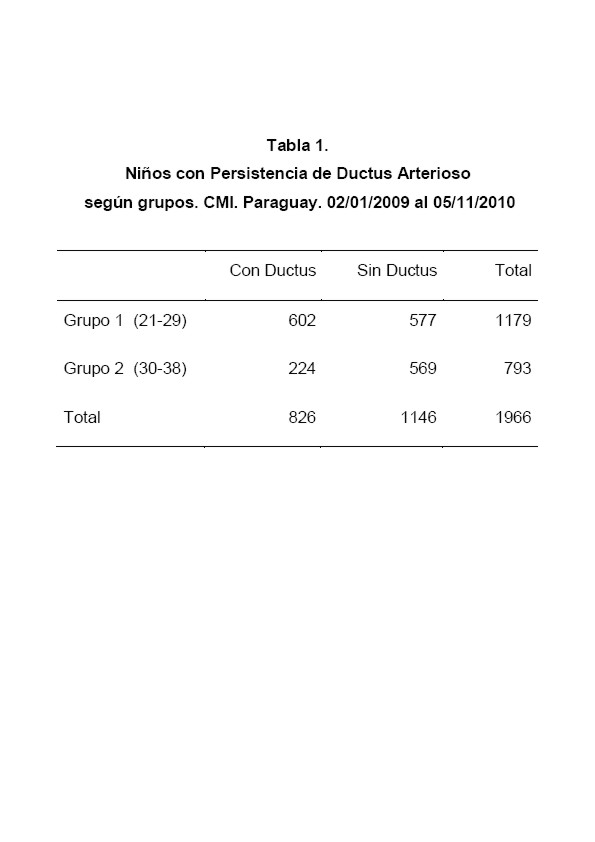
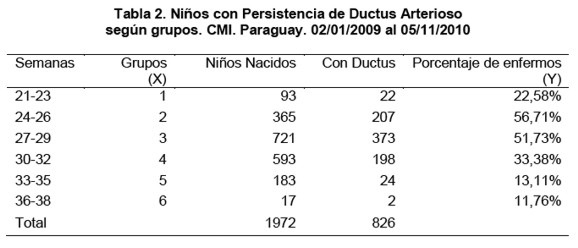
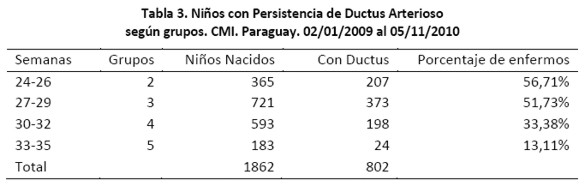
Se estudiaron las variables edad gestacional, PDA, peso al nacer, sexo. Se procedió a dividir el grupo según la edad gestacional, encontrando la mayor edad de 38 semanas y menor de 21, por ende se los separó en dos grupos de 9 semanas cada uno (Tabla 1). Luego para verificar que la relación es inversa, se procedió a buscar la regresión y correlación teniendo en cuenta como variable independiente la edad gestacional y dependiente el porcentaje de PDA. Debido a la dificultad de conseguir datos avcerca de niños con pocas semanas (21 – 23) con dificultades de supervivencia y también de niños con muchas semanas (36 – 38), por ser poco probable que niños con esas semanas tengan menos de 1500 g, se decidió agrupar a los niños en grupos, los cuales tenían 3 semanas cada uno (Tabla 2).
Asuntos estadísticos: Los datos fueron cargados en el programa Microsoft® Excel® y se utilizaron como pruebas estadisticas x², OR, P, coeficiente de correlación, coeficiente de determinación. Se consideró significativo a un valor de p menor de 0,05.
Asuntos éticos: Se respetó la confidencialidad de la información. Se evitó la identificación de los pacientes en la base de datos. Se tomaron medidas para evitar que la información llegue a terceros.
RESULTADOS
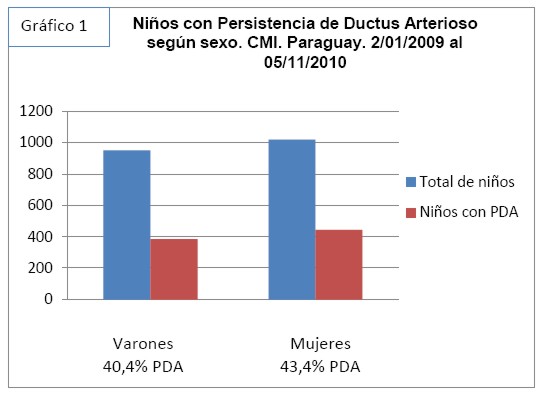
Se constató un total de 950 varones, de los cuales 384 (40,4%) tenían PDA y 1018 mujeres, de las cuales 442 (43,4%) tenían PDA (Grafico 1). Prevalencia de 42%.
- Grupo 1: El primer grupo con rango de edad entre 21 a 29 semanas. Se halló una edad gestacional media de 26.77 +/- 1,93 semanas (EE de la media: 0.056), media de los pesos de 953.15 g. Incidencia de 51,06%
- Grupo 2: El segundo grupo con rango de edad entre 30 a 38 semanas. Se halló una edad gestacional media de 31,66 +/- 1,57 semanas (EE de la media: 0.05), media de los pesos 1287,25 g. Incidencia de 28,24% (Ver tabla 1).
Analizando los grupos se obtuvo x²: 100.12 y OR: 2.26. Por ende se puede concluir que se ha llegado a una asociación que no se debe al azar, con 126% más PDA para el Grupo 1.
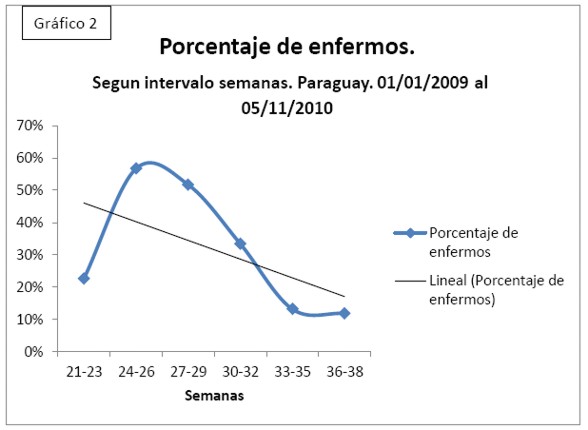
Se ha hallado un Coeficiente de Correlación= -0,563926293, R²= 0,318012864. (Gráfico 2)
Por ende se puede sostener que tienen una relación inversa y que el 31,8% de PDA se debe a la Edad Gestacional.
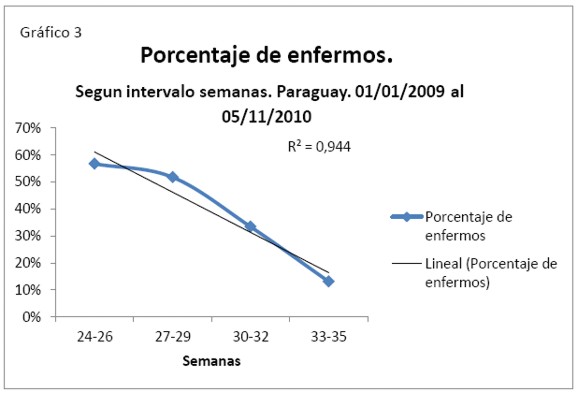
Debe mencionarse un interesante hallazgo, al quitar los grupos con quienes habíamos tenido inconvenientes por la poca cantidad de muestra, Grupo de 21 – 23 por las bajas probabilidades de sobrevivir y Grupo de 36 – 38 porque superan los 1500 gramos, se halló una correlación casi perfecta de -0,972 y R²= 0,944. Se puede sugerir en este caso que más del 94% de ductus persisten según edad gestacional (Ver tabla 3).
Se puede deducir que esta gran diferencia se debe a la pequeña cantidad de muestra en los grupos extremos.
DISCUSIÓN
A medida que disminuye la edad gestacional en los neonatos de MBPN, se produce un aumento de la morbilidad, en nuestro estudio se comprueba el aumento de la PDA a medida que disminuye la edad gestacional. No se encontraron trabajos nacionales previos para comparar los resultados. Concluyendo que el 31,8% de la PDA se debe a la edad gestacional, pero pudiendo aumentar incluso hasta 94% quitando los grupos de los extremos, en los cuales existe poca cantidad de muestra. Un dato innovador relacionado a esto es que a tan solo 5 semanas menos de edad gestacional, se encontró 126% más PDA.
El cierre del vaso se cree que ocurre en dos etapas, la constricción inicial del vaso en gran medida es provocado por un aumento de la tensión arterial de oxígeno (como la ventilación del pulmón se inicia) y por una caída precipitada en niveles de PGE2 en el nacimiento, la PGE2 puede relajar la pre-constricción del ductus in vitro y la infusión de PGE2 mantiene la permeabilidad del vaso después del nacimiento (13).
v Al tener en cuenta la tensión arterial de oxigeno como desencadenante de los procesos de cierre del ductus se entiende como los neonatos con déficit de surfactante, una sustancia endógena secretada en los pulmones por los nuemonocitos tipo II para disminuir la tensión superficial y facilitar el intercambio de oxígeno en los alveolos, y problemas respiratorios tengan una mayor incidencia de PDA. Según la literatura, en prematuros sin síndrome de distrés respiratorio (SDR) el cierre ductal se produce en un período similar al de RNT, demostrando la importancia del oxígeno como el agente que desencadena el cierre del conducto arterioso.
El descenso dramático de los niveles de PGE2 circulante que ocurre en el nacimiento se debe a la pérdida de los prostanoides en lechos capilares placentarios, y la redirección de la salida ventricular derecha a la circulación pulmonar, donde los altos niveles de la PGE2 son catabolizados por la enzima 15-(NAD)hydroxyprostaglandina deshidrogenasa (HPGD). El transporte de PGE2 a través de la membrana celular es la etapa limitante de velocidad en el catabolismo de PGE2. La importancia de la disminución en los niveles de PGE2 en el nacimiento en el cierre de DA es apoyado por el hallazgo de que los ratones que carecen de HPGD mueren en el período perinatal con PDA, y por la alta incidencia de PDA en familias con un alelo mutante de este gen.
En los recién nacidos prematuros, así como los de muy bajo peso al nacer, tienen una deficiente producción de surfactante y por ende una baja saturación de oxígeno, esto desencadena una respuesta vasodilatadora que dificulta la caída de los niveles de PGE. Sin embargo, la permeabilidad del DA, tanto en el útero y después del nacimiento, es sensible a los anti-inflamatorios no esteroideos (AINES), como indometacina, que inhibe la actividad de la ciclooxigenasa (COX). COX convierte el ácido araquidónico en prostaglandina endoperóxido (PGH2), una etapa limitante de velocidad en la producción de toda prostaglandina (PG), prostaciclina, y la síntesis de tromboxano. La exposición del feto a la indometacina puede resultar en el cierre de DA en el útero, y el tratamiento con indometacina a menudo pueden ser pasibles de cierre de PDA. Sin embargo, este tratamiento fracasa en el 10-40% de los pacientes, pudiendo reabrirse el conducto arterioso en el 20-30%, esto afecta principalmente a neonatos menores a 1.000 g de peso (14).
Para dilucidar este inconveniente en el tratamiento del PDA, se han estudiado los mecanismos relacionados al cierre del ductus arterioso. Se ha encontrado la importancia de genes de canales de calcio y potasio (CACNB2 /calcium L-channel beta2 subunit, CACNA1G/ alpha1G (calcium T-channel), and KCNA2 /Kv1.2 potassium-channel), estos estarían relacionado en la constricción del ductus arterioso por oxigeno-inducción. Estudios en primates comprueban que la gestación inmadura y la ausencia de exposición a glucocorticoides antes del nacimiento alteran la expresión de ARNm de genes de canales de calcio y del canal de potasio que participan en la vasoconstricción. Se especula que estos canales pueden desempeñar un papel en el cierre del ductus prematuro durante la inhibición de la prostaglandina, ya que parecen estar alterados en PDAs que no responden al tratamiento indometacina (15). Estos datos explicarían la relación inversa casi perfecta (94%) que tiene la edad gestacional y la PDA. Este problema en la utilización de indometacina lleva al debate sobre que método es el más eficaz ante el tratamiento de PDA, pues otro de los métodos muy utilizados es el cierre por método quirúrgico. (16-17) Cabe también señalar que el momento ideal del cierre del ductus es todavía algo incierto, pues el cierre precoz después del nacimiento también demuestra problemas en la alimentación y crecimiento (18-20).
Los neonatos del Grupo 1 (21 a 29 semanas) tienen un promedio de peso de 953.15 g. A los estos se los considera neonatos con extremo bajo peso de nacimiento (EBPN), por poseer un peso menor a 1.000 g de peso. Estos son los neonatos con mayor riesgo de PDA, además de poseer mayores complicaciones en el tratamiento (21-23).
En ellos se encontró una incidencia del 51.06%, la cual es mucho mayor al Grupo 2 (30 a 28 semanas) con un promedio de peso de 1287,25 g. y una incidencia de 28,24%. La incidencia de PDA es del 5-10% de todas las Cardiopatías Congénitas y es más frecuente en niñas (24). Lo cual coincide con nuestro estudio, en el cual se encontró un 3% más de PDA en niñas. En los fetos el ductus arterioso es suma importancia para desarrollo, pues desde la sexta semana de gestación soporta la mayor parte del débito del ventrículo derecho, que constituye el 60% del gasto cardíaco, llegando incluso a derivar el 90% del gasto ventrículo derecho a la circulación sistémica y solo el 10% a la circulación pulmonar total, para asegurar la correcta oxigenación. Esta función es normal e indispensable para la vida fetal. Además se ha demostrado que la deficiencia de oxigeno está relacionada con PDA. Entonces, ¿Sera que en todos los casos la persistencia de ductus arterioso es perjudicial? Posiblemente se trate de un mecanismo de emergencia para priorizar la suprevivencia. Se siguen investigando las consecuencias de PDA en niños con RNMBP, tanto a corto como a largo plazo (25), pero es claro que las consecuencias empeoran a medida que disminuye la edad gestacional.
AGRADECIMIENTOS
Al Departamento de Neonatología del Hospital Materno Infantil del Hospital de Clínicas – Paraguay por abrirnos las puertas. A la Prof. Rocío Pagliaro por los consejos en la parte estadística y al Dr. Gustavo Rodríguez por incentivarnos a la realización y publicación de la investigación.
REFERENCIAS BIBLIOGRÁFICAS
1. Genes L, Lacarrubba J, Caballero C, Fonseca R, Mir R, Céspedes E, et al. Morbi-mortalidad en Recién Nacidos de muy Bajo Peso al Nacer. Unidad de Neonatologia. Centro Materno Infantil. Hospital de Clínicas. Pediatría 2010 Volumen 37 – numero 1. [ Links ]
2. Marshall G, Tapia J, D'Apremont I, Grandi C, Barros C, Alegria A, et al. A New Score for Predicting Neonatal Very Low Birth Weight Mortality Risk in the NEOCOSUR South American Network. J Perinatol (2005) 25, 577–582. [ Links ]
3. Medrano C, Zavanella C. Ductus arterioso persistente y ventana aorto pulmonar. (Internet). Sociedad española de cardiología pediátrica y cardiopatías congenitas. Disponible en: http://www.aeped.es/sites/default/files/documentos/7_ductus.pdf. Acceso 8 de agosto de 2011. [ Links ]
4. Weir EK, Archer SL. The Role of Redox Changes in Oxygen Sensing. Respir Physiol Neurobiol. 2010 December 31; 174(3): 182–191. [ Links ]
5. Weir EK, Obreztchikova M, Vargese A, Cabrera JA, Peterson DA and Hong Z. Mechanisms of oxygen sensing: a key to therapy of pulmonary hypertension and patent ductus arteriosus. Br J Pharmacol. 2008 October; 155(3): 300–307. [ Links ]
6. Yokoyama U, Minamisawa S, Ishikawa Y. Regulation of vascular tone and remodeling of the ductus arteriosus. J Smooth Muscle Res. 2010;46(2):77-87. [ Links ]
7. Bhandari V, Zhou G, Bizzarro MJ, Buhimschi C, Hussain N, Gruen JR, Zhang H. Genetic Contribution to Patent Ductus Arteriosus in the Premature Newborn. Pediatrics. 2009 February; 123(2): 669–673. [ Links ]
8. Hammoud MS, Elsori HA, Hanafi EA, Shalabi AA, Fouda IA, Devarajan LV. Incidence and risk factors associated with the patency of ductus arteriosus in preterm infants with respiratory distress syndrome in Kuwait.Saudi Med J. 2003 Sep;24(9):982-5. [ Links ]
9. Reese J, Veldman A, Shah L, Vucovich M and Cotton R. Inadvertent Relaxation of the Ductus Arteriosus by Pharmacological Agents that are Commonly Used in the Neonatal Period. Semin Perinatol. 2010 June; 34(3): 222–230. [ Links ]
10. Hajj H, Dagle JM. Genetics of patent ductus arteriosus susceptibility and treatment. Semin Perinatol. 2012 Apr;36(2):98-104. [ Links ]
11. Ruiz MD, Gómez E, Párraga MJ, Tejero MA, Guzmán JM. Ductus Arterioso Persistente. Iinternet). 2da edición. Madrid: Asociación Española de Pediatría; 2008. Disponible en: http://www.aeped.es/sites/default/files/documentos/36.pdf. Acceso 9 de agosto de 2011. [ Links ]
12. Junca PV, Gonzalez A, Arrizaga N. Indometacina en el tratamiento del ductus arterioso persistente en recién nacidos prematuros. Rev. Chil. Pediatr. (1991) 62 (5); 293-297. [ Links ]
13. Gruzdev A, Nguyen M, Kovarova M, Koller BH. PGE2 through the EP4 receptor controls smooth muscle gene expression patterns in the ductus arteriosus criticalfor remodeling at birth. Prostaglandins Other Lipid Mediat. 2012 Mar;97(3-4):109-19. http://www.ncbi.nlm.nih.gov/pmc/articles/PMC3312001/ [ Links ]
14. Waleh N, Hodnick R, Jhaveri N, McConaghy S, Dagle J, Seidner S, McCurnin D, Murray JC, Ohls R, Clyman RI. Patterns of gene expression in the ductus arteriosus are related to environmental and genetic risk factors forpersistent ductu patency. Pediatr Res. 2010 Oct;68(4):292-7. [ Links ]
15. Barroso C, Ferré R, Gallego V, Hernández Y, Wood MA, Moreno E et al. (Internet). FARMACIA HOSPITALARIA TOMO II. Coordinadora Mª Cinta Gamundi Planas. 2002 Disponible en: http://www.sefh.es/bibliotecavirtual/fhtomo2/CAP17.pdf. Acceso 14 de agosto de 2011. [ Links ]
16. Kaempf JW, Wu YX, Kaempf AJ, Kaempf AM, Wang L, Grunkemeier G. What happens when the patent ductus arteriosus is treated less aggressively in very low birth weight infants? J Perinatol. 2012 May;32(5):344-8. [ Links ]
17. Malviya M, Ohlsson A, Shah S. Surgical versus medical treatment with cyclooxygenase inhibitors for symptomatic patent ductus arteriosus in preterm infants. Cochrane Database Syst Rev. 2008 Jan 23;(1):CD003951. [ Links ]
18. Clyman RI, Couto J, Murphy GM. Patent ductus arteriosus: are current neonatal treatment options better or worse than no treatment at all?. Semin Perinatol. 2012 Apr;36(2):123-9. [ Links ]
19. Jaillard S, Larrue B, Rakza T, Magnenant E, Warembourg H, Storme L. Consequences of delayed surgical closure of patent ductus arteriosus in very premature infants. Ann Thorac Surg. 2006 Jan;81(1):231-4. [ Links ]
20. Evans N. Preterm patent ductus arteriosus: should we treat it?. J Paediatr Child Health. 2012 Sep;48(9):753-8. [ Links ]
21. Hamrick SE, Hansmann G. Patent ductus arteriosus of the preterm infant. Pediatrics. 2010 May;125(5):1020-30. [ Links ]
22. Koch J, Hensley G, Roy L, Brown S, Ramaciotti C, Rosenfeld CR. Prevalence of spontaneous closure of the ductus arteriosus in neonates at a birth weight of 1000 grams or less. Pediatrics. 2006 Apr;117(4):1113-21. [ Links ]
23. Eichenwald EC, Stark AR. Management and outcomes of very low birth weight. N Engl J Med. 2008 Apr 17;358(16):1700-11. [ Links ]
24. Perich R. Cardiopatías congénitas más frecuentes. Pediatr Integral 2008;XII(8):807-818. [ Links ]
25. Korbmacher B, Lemburg S, Zimmermann N, Stannigel H, Godehardt E, Heusch A Management of the persistent ductus arteriosus in infants of very low birth weight: early and long-term results. Interact Cardiovasc Thorac Surg. 2004 Sep;3(3):460-4. [ Links ]