DESARROLLO DEL TEMA
El Bloqueo Interauricular (BIA) se produce por un deterioro en la conducción auricular que implica un retraso en la conducción del estímulo eléctrico desde la aurícula derecha a la aurícula izquierda. Las causas probables de interrupción del haz de Bachmann incluyen isquemia, enfermedad degenerativa del envejecimiento, enfermedades infiltrativas, enfermedad coronaria difusa y afecciones inflamatorias1-7. Los factores de riesgo para el BIA avanzado, la fibrilación auricular (FA) y el accidente cerebrovascular (ACV) parecen ser muy similares, y la patogénesis subyacente probablemente se deba a fibrosis miocárdica y remodelación auricular3-7.
El bloqueo interauricular se relaciona clínicamente a la aparición de taquiarritmias supraventriculares y está relacionado al remodelamiento auricular. Aunque el agrandamiento auricular y el BIA comparten un patrón electrocardiográfico similar, son dos entidades separadas. A pesar de esto, durante los últimos años, muchos autores aún asocian una duración de la onda P mayor a 120 ms con agrandamiento de la aurícula izquierda. El remodelamiento auricular modifica la velocidad de conducción, la arquitectura cardiaca, los canales iónicos dependientes de voltaje, y los componentes de resistencia y capacitancia, como son el espacio extracelular y las uniones celulares8. La alteración en estas propiedades afecta las propiedades electrofisiológicas de la conducción auricular y, por lo tanto, favorece el BIA, los trastornos auriculares y la génesis de arritmias auriculares8. Por lo tanto, hemos realizado una revisión sobre la fisiopatología envuelta en el desarrollo del BIA y su relación con la aparición de arritmias auriculares.
Fisiopatología del bloqueo Interauricular
El Bloqueo Interauricular (BIA) se produce por un deterioro en la conducción auricular que implica un retraso en la conducción del estímulo eléctrico desde la aurícula derecha a la aurícula izquierda. Este fenómeno fue descripto por primera vez por George Bachmann en el año 1941, pero no fue hasta 1979 cuando Antony Bayés de Luna describió el bloqueo de la conducción auricular y lo clasificó en bloqueo inter e intra auricular, refiriéndose a “inter” al bloqueo entre las aurículas derecha e izquierda e “intra” al bloqueo dentro de una misma aurícula9,10.
Los factores de riesgo para el BIA avanzado, la fibrilación auricular (FA) y el accidente cerebrovascular (ACV) parecen ser muy similares, y la patogénesis subyacente probablemente se deba a fibrosis miocárdica y remodelación auricular3-7. Estos cambios de remodelación tanto a nivel estructural como a nivel electrofisiológico producen electrogramas auriculares anormales. Un electrograma endocárdico auricular anormalmente prolongado y fraccionado registrado en estos pacientes mediante el mapeo endocárdico de la aurícula derecha durante ritmo sinusal, podría traducir una actividad eléctrica localizada y no homogénea relacionada con una conducción retardada, no uniforme y anisotrópica a través de un miocardio auricular patológico11-14 (Figura 1). Además, se ha demostrado histológicamente que los tejidos donde se originan los electrogramas anormalmente prolongados y fraccionados presentan procesos fibro-degenerativos12-16. Estas zonas de miocardio auricular patológico que presentan áreas de fibrosis son claramente observables como zona de bajo voltage en los mapeos electroanatómicos endocárdicos tridimensionales en ritmo sinusal17) (Figura 2).
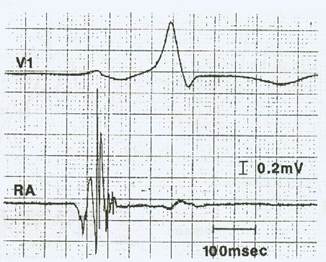
Figura 1: Ejemplo de un “electrograma auricular anormal”. Este electrograma auricular anormal se registró desde la zona lateral alta de la aurícula derecha (AD) mediante un mapeo endocárdico en ritmo sinusal. Se trata de un electrograma auricular anormal como se define en el texto. Reimpreso con permiso de Konoe A, Fukatani M, Tanigawa M, et al. Electrophysiological abnormalities of the atrial muscle in patients with manifest Wolff-Parkinson-White syndrome associ ated with paroxysmal atrial fibrillation. Pac Clin Electrophysiol 1992; 15: 1040-1052.
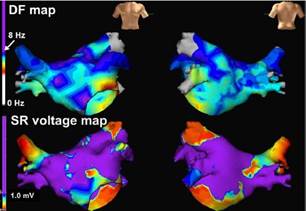
Figura 2: Mapas representativos de ubicaciones de electrograma auricular fraccionado complejo (CFAE) (panel superior) y voltaje auricular izquierdo durante el ritmo sinusal (SR, panel inferior). Las áreas CFAE se muestran en colores no morados. Las áreas de bajo voltaje durante SR se definieron como aquellas de menos de 1,0 mV y se muestran en colores que no son morados. No se observa superposición entre las áreas CFAE y las áreas de bajo voltaje durante SR. Reimpreso con permiso de Sasaki N, Watanabe I, Okumura Y, Nagashima K, Kogawa R, Sonoda K, et al. Complex fractionated atrial electrograms, high dominant frequency regions, and left atrial voltages during sinus rhythm and atrial fibrillation. J Arrhythmia 2017;33:185-191.
Las causas probables de interrupción del haz de Bachmann incluyen isquemia, enfermedad degenerativa del envejecimiento, enfermedades infiltrativas, enfermedad coronaria difusa y afecciones inflamatorias3-7. El BIA avanzado ocurre secundario a la conducción auricular interrumpida, lo que puede conducir a cambios en períodos refractarios auriculares y la aparición de latidos auriculares prematuros, desencadenantes de arritmias auriculares18-22. El BIA puede servir como un valioso marcador electrocardiográfico para evaluar el riesgo de nueva aparición de FA.
Conducción inter e intra auricular: El estímulo eléctrico originado en el nodo sinusal alcanza al nodo aurículo-ventricular (AV) a través de tres vías intra auriculares: el tracto anterior, el tracto medio (vía de Wenckebach) y el tracto posterior (vía de Thorel). El tracto anterior se bifurca en dos vías: el fascículo de Bachmann, el cual envía los impulsos eléctricos a la aurícula izquierda, y una segunda vía que desciende al nodo AV2.
El fascículo de Bachmann (FB) es una estructura en forma de banda compuesta por fibras miocárdicas que cruzan a nivel subepicárdico frente a la vena cava superior, esta estructura se considera una vía ultrarrápida de activación interauricular. Tiene una dirección anterior, rodeando a la vena cava superior y luego penetra en la banda anterior interauricular. El fascículo continúa hacia la aurícula izquierda y conecta a ambas aurículas en la porción superior del surco interauricular. En estudios con animales de experimentación se demostró que la velocidad de conducción en el FB es casi 2 veces mayor que en el resto del miocardio auricular. Su período refractario efectivo también es significativamente más largo que el del miocardio de la aurícula derecha y el de la aurícula izquierda, con lo cual el FB puede ser bloqueado particularmente cuando el tejido auricular adyacente todavía está listo para ser activado19.
En condiciones normales, la conducción interauricular se produce no solo a través del fascículo de Bachmann sino también a través de vías adicionales. La mayor parte de la conducción interauricular (72%) se limita a un solo sitio. En el 69% de los casos, esto ocurre a través del fascículo de Bachmann. Sin embargo, Tapanainen et al.20 demostraron que las bandas musculares en la superficie auricular inferior cerca del seno coronario, y la parte posterior de la fosa ovallis también contribuyen a la conducción interauricular en menor proporción (5-15%).
En cuanto a la fisiopatología del BIA, dependerá del remodelado auricular, el cual se llevará a cabo a diferentes niveles. Este remodelado modificará la velocidad de conducción, que está dado por las propiedades activas y pasivas de conducción. Las propiedades pasivas se refieren a la arquitectura cardiaca, los componentes de resistencia y capacitancia, como son el espacio extracelular y las uniones celulares. Las propiedades activas son las conductancias de los canales iónicos dependientes de voltaje; los más importantes son los canales de sodio21. La alteración en estas propiedades, dada por un aumento en las propiedades pasivas (en el caso de fibrosis) o una disminución en las propiedades activas, afecta las propiedades electrofisiológicas de la conducción auricular y, por lo tanto, favorece el BIA y los trastornos auriculares21.
El estudio de estos fenómenos se ha realizado principalmente en modelo de corazón de rata, y se ha observado que está formado en un 60% por cardiomiocitos y que menos del 25% del corazón está constituido por fibroblastos, los cuales son componentes dinámicos encargados de mantener la estructura del corazón y secretar la mayoría de las proteínas de la matriz extracelular. Al aumentar el número de fibroblastos en el corazón existe un aumento en la capacitancia y resistencia, lo que causa una disminución en la velocidad de conducción eléctrica. Los fibroblastos tienen un potencial de acción menos negativo, por lo que al unirse a los cardiomiocitos provocan que estos se despolaricen durante la diástole, lo que da dos efectos: actividad desencadenada e inactivación de los canales de sodio, que origina una despolarización lenta durante el potencial de acción22.
Es bien sabido que el aumento del estrés oxidativo está presente en hipertensión arterial sistémica, infarto del miocardio, insuficiencia cardiaca, miocardiopatías, cirugía cardiaca y ablación; todos ellos aumentan el remodelado cardiaco con proliferación de fibroblastos, lo que origina daño estructural en el corazón y, como consecuencia, una conducción anormal. Además, desde el punto de vista eléctrico, el BIA establece un entorno favorable para la reentrada, ya que las alteraciones de la conducción disminuyen la longitud de onda del tejido auricular y aumentan la dispersión del período refractario, que son sustratos conocidos de reentrada y se han demostrado en pacientes con FA. Finalmente, es probable que, debido a una activación anormal como la activación retrógrada de la aurícula izquierda, el BIA se asocia con una mayor incidencia de latidos auriculares prematuros, facilitando así el inicio de la reentrada23.
Definición y clasificación del Bloqueo Interauricular: El bloqueo interauricular se define como el retraso de conducción entre ambas aurículas en la zona del fascículo de Bachmann. Según su clasificación se divide en dos tipos de bloqueo en función a los hallazgos electrocardiográficos:
BIA parcial: aquel en el que se evidencia una onda P de más de 120ms de duración en cualquiera de las derivaciones
BIA avanzado: aquel en el que, además de lo anterior, se evidencia una morfología bifásica de la onda P (con componente positivo-negativo) en alguna de las derivaciones de cara inferior (DII, DIII, aVF) (Figura 3).
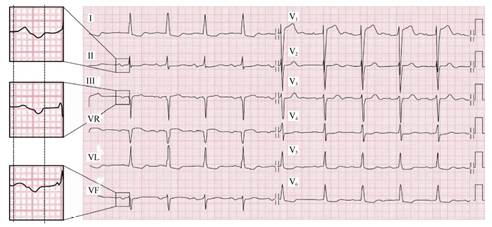
Figura 3: Bloqueo interauricular avanzado. Se observa una Onda P con una duración mayor de 200 ms, con una morfología de patrón difásico (positivo-negativo) con negatividad terminal en las derivaciones electrocardiográficas inferiores II, III, y aVF. Reimpreso con permiso de Bayés de Luna A, Baranchuk A, Escobar Robledo LA, Massó van Roessel A, Martínez Sellés M. Diagnosis of interatrial block. J Geriatric Cardiol 2017;14: 161-65.
El modelo de activación que esto traduce fue confirmado hace muchos años en modelos animales y más recientemente fueron validados nuevamente en forma invasiva utilizando mapeo intracardiaco22.
Otra clasificación aceptada, es la morfológica23, haciendo analogía a los bloqueos producidos en otras partes del sistema de conducción cardiaco:
Primer grado (parcial) la onda P tiene un eje eléctrico normal; el impulso eléctrico de la aurícula derecha a la izquierda tiene una propagación normal, pero existe un retraso en esta (onda P ≥ 120 ms).
Segundo grado: (bloqueo interauricular o aberrancia en la conducción auricular) la onda P cambia su morfología de manera intermitente, de una morfología normal a un patrón de BIA o de un BIA de primer grado a morfología de BIA de tercer grado y viceversa.
Tercer grado: (avanzado) el impulso eléctrico de la aurícula derecha a izquierda se encuentra bloqueado a nivel del fascículo de Bachman y la activación a la aurícula izquierda se realiza de manera retrógrada a través de las conexiones musculares en la proximidad del seno coronario. El ECG demuestra una onda P ≥ 120 ms de forma bimodal en las derivaciones DI y aVL y bifásica (±) en DII, DIII y aVF por la activación caudocraneal de la aurícula izquierda. Aunque esta clasificación es más completa, en la mayoría de los estudios se utiliza la primera clasificación porque tiene una implicancia clínica y además es más simple para utilizar por todos los profesionales de salud.
Como ocurre con cualquier alteración de la conducción, el BIA cumple los tres criterios necesarios para ser considerado un bloqueo: el patrón de ECG puede aparecer de forma abrupta y transitoria, el patrón de ECG puede aparecer sin otros procesos asociados, como el agrandamiento de la cámara cardíaca (en particular, agrandamiento de la aurícula izquierda) y un patrón de ECG similar puede reproducirse experimentalmente. Estos criterios se han demostrado en varios artículos anteriores2.
BIA como predictor de arritmias supraventriculares
Con una población que cada vez aumenta más la expectativa de vida, el BIA se está volviendo más significativo. La prevalencia del BIA se ha estimado en alrededor del 5% para los menores de 20 años, aumentando a casi el 60% en aquellos mayores de 50 años24. El bloqueo interauricular se relaciona clínicamente a la aparición de taquiarritmias supraventriculares y está relacionado al remodelamiento auricular. Aunque el agrandamiento auricular y el BIA comparten un patrón electrocardiográfico similar, son dos entidades separadas. A pesar de esto, durante los últimos años, muchos autores aún asocian una duración de la onda P mayor a 120 ms con agrandamiento de la aurícula izquierda. Sin embargo, al respecto es importante mencionar que la capacidad del ECG para detectar el agrandamiento de la aurícula izquierda en presencia de BIA es solo del 50%. Esto aumenta al 75% cuando se asocia con una onda P bifásica con un componente negativo distal >40 ms en la derivación V12,23. Además, puede producirse una onda P prolongada en los ancianos independientemente del tamaño auricular. También puede ocurrir como consecuencia de una enfermedad aguda como infarto de miocardio o pericarditis2,23.
Claramente, el agrandamiento de la aurícula izquierda y el BIA son dos entidades diferentes; sin embargo, se asocian con frecuencia. El BIA, particularmente el bloqueo avanzado, es un signo sensible de agrandamiento auricular que está presente en aproximadamente el 90% de los casos. Por lo tanto, el BIA puede manifestarse independientemente del tamaño de la aurícula izquierda; sin embargo, generalmente se asocia a un aurícula más grande2.
El bloqueo interauricular se relaciona a la aparición de taquiarritmias supraventriculares, especialmente a la fibrilación auricular y al flutter auricular; esta asociación constituye el denominado síndrome de Bayés, descrito por primera vez en 198823. Sólo se logró suficiente relevancia clínica en el año 2003, cuando se documentó la asociación con fibrilación auricular en pacientes previamente diagnosticados con este tipo de bloqueo. En el año 2014 se propuso la presencia del bloqueo interauricular avanzado como el factor de riesgo más fuerte para la aparición de FA de nuevo inicio y accidente cerebrovascular de origen cardioembólico debido a que conduce a una activación reiterada y asincrónica de la aurícula izquierda24. El BIA avanzado ocurre secundariamente a la conducción auricular interrumpida o enlentecida, lo que puede conducir a cambios en períodos refractarios auriculares y la aparición de latidos auriculares prematuros, desencadenantes de arritmias auriculares18-22. El BIA puede servir como un valioso marcador electrocardiográfico para evaluar el riesgo de nueva aparición de FA.
Ciertos estudios clínicos sobre el BIA han reportado una alta prevalencia de este bloqueo interauricular en entornos hospitalarios y ambulatorios, lo que llevó a algunos autores a referirse a este hallazgo electrocardiográfico como una pandemia infradiagnosticada2,25-28. Un estudio clínico de 1000 ECG no seleccionados, consecutivos, en pacientes hospitalizados, observó la presencia del BIA en el 47% de los pacientes que tenían ritmo sinusal normal29. Por otro lado, en el ámbito ambulatorio, un estudio realizado en la población general de una comunidad de ancianos mayores de 65 años reveló que la prevalencia de BIA fue del 59%20. En otro estudio realizado sobre una población de la comunidad de ancianos de un programa de atención integral para personas mayores se encontró una prevalencia de BIA de 48,6%30. Es evidente que el BIA es un hallazgo electrocardiográfico bastante frecuente, por ende, es importante buscarlo e identificarlo sobre todo en personas mayores, ya que la incidencia de fibrilación auricular también aumenta en personas de la tercera edad. Se considera que el BIA es un fuerte predictor del desarrollo de FA. Los pacientes con BIA poseen una desincronización interauricular que puede predisponerlos a desarrollar FA20-23. En un estudio prospectivo con un seguimiento medio de 16 meses, la prevalencia de BIA fue comparado entre 308 pacientes que desarrollaron FA con un grupo control de 308 pacientes que permanecieron en ritmo sinusal durante el período de seguimiento. La prevalencia de BIA fue del 52% en la cohorte que desarrolló FA, en comparación con solo un 18% en la cohorte control31. En el estudio ARIC, se demostró que los pacientes con BIA avanzado tenían tasas de FA significativamente más altas que aquellos sin BIA avanzado. Esta mayor incidencia de FA fue muy significativa incluso después del ajuste para factores demográficos, factores de riesgo cardiovascular, enfermedad de las arterias coronarias, e insuficiencia cardíaca congestiva32. Sadiqali F, et al.33 examinaron en 97 pacientes, si el BIA avanzado podría predecir la FA de inicio reciente en pacientes con insuficiencia cardíaca grave que requieren terapia de resincronización cardíaca. Durante el seguimiento, se detectó FA en 29 pacientes y la incidencia fue mayor en pacientes con BIA avanzado comparados a aquellos pacientes sin BIA33. Además, Tse G, et al.24 encontraron en un meta-análisis anterior que la presencia del BIA predijo un nuevo inicio de FA, y en el análisis de subgrupos se alcanzó una diferencia estadística significativa para el BIA avanzado, pero no para el BIA parcial24. Por otro lado, He J, et al.34) observaron que las anormalidades de la onda P también predijeron el accidente cerebrovascular independientemente de FA34. Dado su asociación con la dilatación auricular izquierda y con la disfunción auricular electromecánica, el BIA puede facilitar el sustrato anatómico-eléctrico para la formación de trombos intraauriculares y la embolia posterior. Lorbar M, et al.35 estudiaron en forma retrospectiva a 104 pacientes con accidentes cerebrovasculares embólicos y observaron que el BIA estaba presente en un 80% de estos pacientes que estaban en ritmo sinusal35. En otro estudio retrospectivo, Ariyarajah V, et al.36) compararon 85 pacientes con accidente cerebrovascular embólico con 208 pacientes con accidente cerebrovascular no embólico, y observaron que un 88% estaban en ritmo sinusal, pero la prevalencia de BIA fue significativamente mayor en la cohorte de accidente cerebrovascular embólico (60.6%) en comparación con la cohorte de accidente cerebrovascular no embólico (39.8%)36.
El BIA es un importante marcador para el desarrollo de la fibrilación auricular37-40. El sustrato anatómico para el BIA está producido por la remodelación auricular debido a cambios fibro-degenerativos que inducen una desincronización interauricular. La disfunción electromecánica de la aurícula izquierda (AI) desarrolla ciertos trastornos como activación anormal de la AI, aumento de presión de la AI, dilatación de la AI, disfunción endotelial, y fibrosis auricular41-50. Estas alteraciones fisiopatológicas favorecen el desarrollo de la FA con sus diferentes complicaciones trombo-embólicas cerebrales y sistémicas37-44.
CONCLUSIONES
El Bloqueo Interauricular se produce por un deterioro en la conducción auricular que implica un retraso en la conducción del estímulo eléctrico desde la aurícula derecha a la aurícula izquierda. Las causas probables de interrupción del haz de Bachmann incluyen isquemia, enfermedad degenerativa del envejecimiento, enfermedades infiltrativas, enfermedad coronaria difusa y afecciones inflamatorias. El remodelamiento auricular modifica la velocidad de conducción, la arquitectura cardiaca, los canales iónicos dependientes de voltaje, y los componentes de resistencia y capacitancia, como son el espacio extracelular y las uniones celulares. La alteración en estas propiedades afecta las propiedades electrofisiológicas de la conducción auricular y favorece el BIA, los trastornos auriculares y la génesis de FA. El Bloqueo Interauricular puede servir como un valioso e importante marcador electrocardiográfico para evaluar el riesgo del desarrollo de arritmias auriculares, y nueva aparición de fibrilación auricular.















