INTRODUCCIÓN
La sífilis es una infección bacteriana causada por Treponema pallidum, agente patológico que se transmite mayoritariamente por contacto sexual a través de ulceraciones presentes en los genitales, mediante transmisión vertical de la madre al feto durante el embarazo y en menor medida a través de transfusiones sanguíneas. En Paraguay se ha documentado un aumento en la tasa de incidencia, de 21 por cada 100.000 habitantes en el 2015 a 46 por cada 100.000 habitantes en el 2018, afectando principalmente a embarazadas con una prevalencia del 3%, y a grupos vulnerables por prácticas de riesgo con una prevalencia del 5,2 al 5,6%1-4.
Este microorganismo, posee lipoproteínas que cumplen la función de mediadores proinflamatorios, por ende, activan a células del sistema inmune. Pueden citarse como ejemplos la Tp17, Tp15 y Tp47. La Tp17 está presente en la membrana de T. pallidum, posee función de citoadhesina y una estructura de barril β conformada por 8 láminas; tiene la capacidad de unirse a distintos ligandos presentes en el hospedador como la biotina o el retinol. Es considerada una de las proteínas más inmunogénicas implicadas en la transmisión natural de la sífilis5-7.
El diagnóstico de la sífilis se basa en las características clínicas del paciente y en pruebas laboratoriales basadas en métodos directos e indirectos. No se recurre al cultivo de la bacteria, debido a la imposibilidad del microorganismo para crecer en medios acelulares. Los métodos directos se basan en la búsqueda de T. pallidum en lesiones, adenopatías, o LCR (líquido cefalorraquídeo) y se realizan mediante observación directa por microscopía de campo oscuro o a través de la detección del genoma por PCR (reacción en cadena de la polimerasa). Por otro lado, los métodos indirectos se basan en la búsqueda de anticuerpos en suero o plasma del paciente y se clasifican en pruebas treponémicas y no treponémicas. Las pruebas no treponémicas detectan anticuerpos generados en respuesta al daño celular generado por T. pallidum, ejemplos de estas pruebas son la VDRL (Venereal Disease Research Laboratory) y la RPR (Rapid Plasma Reagin). Las pruebas treponémicas incluyen TP-PA (Treponema pallidum-particle agglutination), TPHA (Treponema pallidum Haemagglutination), FTA-ABS (Fluorescent Treponemal Antibody-Absorption), Inmunoblot, ELISA (Enzyme-Linked ImmunoSorbent Assay) y CLIA (Chemiluminescence immunoassay) y son específicas para la detección de anticuerpos generados contra T. pallidum8-11.
Diversas pruebas treponémicas se valen de la utilización de proteínas recombinantes, debido a que las lipoproteínas de membrana de T. pallidum inducen una respuesta inmune fuerte, como es el caso de la Tp17, la misma tiene la capacidad de aumentar la expresión de moléculas de adhesión, inducir la actividad quimiotáctica de células THP-1 y aumentar la producción de TNF-α por parte de los macrófagos (10-16) .
En este contexto, se propuso el diseño y desarrollo de un prototipo de prueba treponémica, basada en la técnica de aglutinación sobre soporte de látex recubierto con estreptavidina; por lo tanto, el objetivo general de este trabajo fue evaluar un prototipo treponémico de ensayo de aglutinación para detección de anticuerpos anti-Treponema pallidum, estandarizando las condiciones óptimas de la preparación del reactivo así como la aplicación del mismo y determinando la concordancia entre el prototipo con una prueba no treponémica y una prueba treponémica.
MATERIALES Y MÉTODOS
El trabajo fue dividido en dos etapas; la primera consistió en el desarrollo del reactivo para el ensayo de aglutinación látex-estreptavidina-tp17, para lo cual se utilizó la proteína recombinante Tp17 expresada a partir de un cultivo de Escherichia coli BL21 pET22bTp17-His y purificada por cromatografía de afinidad de níquel, evaluando su funcionalidad por medio de un ELISA sensibilizando con 100 ng por pocillo, analizando con 2 muestras positivas y negativas para anticuerpos de tipo IgG anti Treponema pallidum. El siguiente paso fue la biotinilación utilizando dos protocolos distintos16,17 y verificándolos por ensayos de ELISA indirectos con placas recubiertas con estreptavidina. Por último, se sensibilizaron las micropartículas de látex recubiertas con estreptavidina de 0,5 µm de diámetro con la Tp17 biotinilada, probando soluciones del látex al 5 y 10%.
Para la prueba de funcionalidad se utilizaron muestras positivas y negativas y se determinaron las condiciones óptimas del prototipo diseñado en base a él volumen, tiempo y condiciones de muestras utilizadas en la reacción. Se estudió la estabilidad del reactivo de látex optimizado a los 30,60 y 90 días posteriores a la elaboración.
En una segunda etapa se analizó la concordancia con otras pruebas comerciales disponibles para el diagnóstico de sífilis, utilizándose muestras de suero y plasma obtenidas de la Seroteca del Departamento de Producción del Instituto de Investigaciones en Ciencias de la Salud - Universidad Nacional de Asunción (IICS-UNA) previamente codificadas y conservadas a -20°C entre los años 2020-2021; 44 evaluadas por quimioluminiscencia (CLIA) y 56 analizadas con la prueba de VDRL.
Se aplicó la estadística descriptiva. Se calcularon medidas de tendencia central: media y desvío estándar para las condiciones óptimas de reacción. Se analizó la frecuencia de resultados positivos y negativos de cada prueba aplicada, y se calculó la fuerza de concordancia entre métodos (VDRL versus Ensayo de aglutinación, CLIA versus Ensayo de aglutinación) por medio del índice kappa de Landis y Koch14, mediante el estadístico Z con un nivel de significancia menor a 0,05. Adicionalmente se determinó la sensibilidad y especificidad del prototipo con respecto a CLIA. El análisis se realizó mediante el programa estadístico EPIDAT 3.1 y 4.2.
El protocolo de este trabajo fue evaluado por el Comité de Ética en la Investigación de la Facultad de Ciencias Químicas de la Universidad Nacional de Asunción, con dictamen 810/21. Además, cuenta con la aceptación del Comité Científico y Comité de Ética en Investigación del IICS-UNA bajo el código P24/21.
RESULTADOS
La proteína recombinante Tp17 presentó la funcionalidad antigénica esperada ante muestras positivas y negativas (Figura 1).

Figura 1. Resultados obtenidos mediante sensibilización de microplacas de Elisa con Tp17 recombinante purificada. A) y C) Reacción obtenida mediante la no interacción de proteína recombinante Tp17 y anticuerpos ausentes en muestras negativas. B) y D) Reacción obtenida mediante interacción de proteína recombinante Tp17 y anticuerpos presentes en muestras positivas. En cuantoa la biotinilación de la proteína Tp17 el protocolo con relación de moles Proteína: Biotina 1:30, brindó una reacción de coloración más alta mediante la lectura de absorbancia. (Figura 2).

Figura 2. Resultados obtenidos mediante sensibilización de microplacas de titulación de ELISA recubiertas con estreptavidina, con Tp17 biotinilada mediante protocolo con relación Tp17: Biotina 1:30 y protocolo relación Tp17: Biotina 1:500. A) y H) Control negativo de PBS. B) y C) Reacción de Tp17 biotinilada mediante protocolo 1:30 adherida a pocillo con estreptavidina, con muestras positivas. D) Reacción de Tp17 biotinila mediante protocolo 1:30 adherida a pocillo con estreptavidina, con muestra negativa. E) y F) Reacción de Tp17 biotinilada mediante protocolo 1:500 adherida a pocillo con estreptavidina, con muestras positivas. G) Reacción de Tp17 biotinilada mediante protocolo 1:500 adherida a pocillo con estreptavidina, con muestra negativa.
En cuanto la sensibilización de las soluciones del látex al 5 y 10%, se observó mejor definición de la aglutinación con la dilución del látex al 10%. En la Tabla 1, se presenta un resumen de las condiciones finales de la preparación del reactivo de látex-estreptavidina-Tp17.
Tabla 1. Resumen de las condiciones finales de la preparación del reactivo de látex-estreptavidina-Tp17.
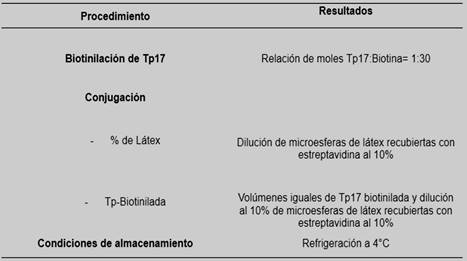
Respecto a las condiciones de las muestras para la reacción de aglutinación, el suero y plasma brindaron indistintamente buenos resultados, excepto si las mismas presentaban aspecto lipémico. La inactivación de las muestras a 56°C por 30 minutos brindó resultados definidos en cuanto a la observación de la aglutinación de muestras positivas y la no aglutinación de muestras negativas.
En cuanto al volumen, la proporción que brindó mejores resultados fue la proporción Muestra: Reactivo 2:1.
El tiempo de reacción promedio hallado para una lectura confiable fue de aproximadamente 3 minutos.
Las pruebas de estabilidad a los 30, 60 y 90 días con muestras seleccionadas al azar, arrojaron los resultados expresados en la Figura 3, donde se demuestra que la estabilidad fue conservada durante estos 3 periodos.
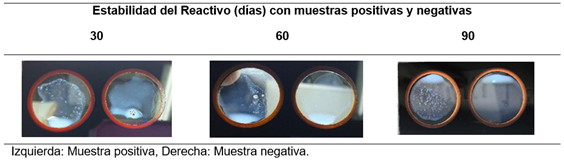
Figura 3: Prueba de Estabilidad del Reactivo de látex-estreptavidina-Tp17 a los 30, 60 y 90 días posteriores a su preparación.
En la segunda etapa del estudio se obtuvo la concordancia entre la prueba de aglutinación (prototipo) y la VDRL, brindó un valor de 0,48 IC95% (0,2375-0,7271), representando este valor una fuerza de concordancia moderada según la valoración del índice kappa de Landis y Koch. La determinación de concordancia entre la prueba de aglutinación y CLIA, brindó un valor de 0,81 IC95% (0,5525-1,000), lo cual indica una fuerza de concordancia casi perfecta. Adicionalmente se determinaron la sensibilidad y la especificidad teniendo como referencia a la prueba de CLIA, brindando un resultado de 94,87% y 100% respectivamente.
DISCUSIÓN
Este trabajo se propuso el objetivo general de evaluar un prototipo de ensayo de aglutinación de látex-estreptavidina-Tp17 para detección de anticuerpos anti-Treponema pallidum, el cual se logró mediante la realización de diferentes pruebas y ensayos. La utilización del antígeno Tp17 como agente sensibilizante para detección de anticuerpos específicos generados en respuesta a infecciones por T. pallidum, brinda un resultado congruente con lo demostrado por otros autores, los cuales aseguran que es una proteína que en contacto con suero de pacientes infectados demuestra elevada y persistente reactividad incluso post tratamiento15.
Se analizaron dos protocolos de biotinilación16,17. Uno de los protocolos brindó una proporción molar Tp17:Biotina 1:30, mientras que el otro protocolo una proporción molar de 1:500. Los mejores resultados se obtuvieron con la proporción 1:30, la cual respeta la regla sugerida por Kay et al., la cual indica que para muestras de proteína con concentraciones menores o iguales a 2 mg/mL, se debe agregar un exceso molar de biotina mayor o igual a 20 veces la cantidad de proteína presente18. Además, cabe destacar que el protocolo 1:30 estaba diseñado para la biotinilación de proteínas virales, cuyo tamaño molecular es pequeño, mientras que el protocolo 1:500 estaba dirigido a la biotinilación de anticuerpos, los cuales poseen mayor tamaño molecular. Para la conjugación o sensibilización de las micropartículas de látex recubiertas con estreptavidina, con la Tp17 biotinilada, se probaron dos concentraciones distintas del látex, al 5 y 10%, de las cuales la segunda concentración mencionada brindó resultados macroscópicamente más definidos en cuanto a la aglutinación de muestras positivas. Cabe destacar que la sensibilización propuesta por Shekarchi et al. utilizó una concentración de látex al 5%, teniendo las micropartículas de látex un diámetro de 0,6 a 0,9 µm; mientras que las micropartículas utilizadas en este ensayo tenían un diámetro de 0,5 µm. De por si, al disminuir el tamaño de la micropartícula la superficie de contacto sería mayor y aumentando la concentración del látex al 10%, es de esperarse que la Tp17 biotinilada recubra eficientemente todos los puntos de contacto de las macropartículas recubiertas con estreptavidina, brindando de este modo la posibilidad de formar una mayor cantidad de conglomerados inmunes al entrar en contacto con muestras positivas19,20.
Las muestras de suero y plasma brindaron indistintamente buenos resultados, excepto si las mismas presentaban aspecto ligeramente lipémico. Esto debido a que la presencia de lipoproteínas puede interferir con la reacción antígeno-anticuerpo, bloqueando los sitios de unión de anticuerpos, lo que puede causar resultados falsos positivos o falsos negativos. Esto sugeriría que las muestras adecuadas para el ensayo serían muestras de pacientes en ayunas, o como alternativa según Schiettecatte et al., realizar una ultracentrifugación de muestras lipémicas o tratamiento previo con lipasas21,22. La inactivación de las muestras a 56°C por 30 minutos brindó resultados definidos en cuanto a la observación macroscópica de la aglutinación de muestras positivas y la no aglutinación de muestras negativas, cuyos resultados estaban validados por la prueba de CLIA. Si bien la inactivación térmica podría llegar a producir falsos negativos debido a la inducción de agregados de proteínas séricas compuestas por IgA, IgM, IgG y albúmina; algunas pruebas diagnósticas proponen este tipo de inactivación, ya que, ante la presencia de un test de elevada sensibilidad, puede no verse afectada la reacción antígeno-anticuerpo ante estas agregaciones proteicas23,24. Hu et al., reportaron un aumento en el índice de IgM e IgG anti-SARS-CoV-2 en suero, tras previa inactivación térmica y posterior detección a través de un ELISA. Este tratamiento también podría inactivar el sistema del complemento, lo que podría evitar reacciones no específicas y disminuir el fondo en los ensayos inmunológicos24,25. El tiempo de reacción seleccionado para una lectura confiable fue de 3 minutos. Algunos trabajos proponen un tiempo máximo de lectura de 5 minutos, debido a que pasado este tiempo las muestras positivas podrían seguir brindando una aglutinación constante, sin embargo, las negativas podrían dar una señal inespecífica haciendo que no se pueda discriminar un resultado y posibilitando la lectura de falsos positivos26. En el presente trabajo, además de la señal inespecífica observada con algunas muestras negativas, pasados los 3 minutos también se observó sequedad de la reacción. La estabilidad del reactivo fue analizada hasta los 90 días posteriores a su elaboración. Luego de este periodo sería interesante seguir estudiando su reactividad en el tiempo, ya que estudios anteriores reportan incluso una estabilidad de 9 meses en este tipo de micropartículas sensibilizadas por afinidad16.
Respecto a la concordancia del prototipo de ensayo de aglutinación propuesto y otras pruebas realizadas para el diagnóstico de sífilis, se tuvieron en cuenta la prueba de VDRL y la prueba de CLIA. La determinación de concordancia entre el ensayo de aglutinación y la VDRL a través del índice kappa, brindó un valor de 0,48 (IC=95%, 0,2375-0,7271) el cual indica una fuerza de concordancia moderada entre estos métodos. Este resultado es de esperarse debido a que los fundamentos de las pruebas son distintos. La VDRL es una prueba no treponémica basada en la detección de anticuerpos denominados “reaginas” presentes en individuos infectados por T. pallidum. Si la muestra contiene reaginas, estas reaccionarán con una suspensión de antígenos de cardiolipina y lecitina purificados, produciéndose una floculación visible al microscopio; si bien esta prueba es reactiva en las primeras fases de la enfermedad haciéndola sumamente sensible, puede negativizarse cuando esta avanza o cuando ha sido tratada bajo antibioticoterapia, además pueden presentarse falsos positivos ante enfermedades autoinmunes o bien en enfermedades que involucran destrucción tisular, siendo necesaria la confirmación con pruebas treponémicas, las cuales se caracterizan por su elevada especificidad11,27. El prototipo de ensayo de aglutinación de látex-estreptavidina-Tp17 se fundamenta en la detección de anticuerpos anti-Tp17, al ser la Tp17 un antígeno específico de T. pallidum se propone que esta prueba sería clasificada como treponémica. Este tipo de prueba confirma la infección, ya sea reciente o pasada, generalmente una vez que se positivizan permanecen así de por vida, incluso si el paciente fue tratado11,28.
Por otro lado, la determinación de concordancia entre el ensayo de aglutinación y CLIA a través del índice kappa, brindó un valor de 0,81 (IC=95%, 0,5525-1,000), lo cual indica una fuerza de concordancia casi perfecta entre estos métodos. Este resultado es congruente con los fundamentos de ambos métodos. Ambas pruebas son de tipo treponémico, utilizan micropartículas sensibilizadas con antígenos recombinantes específicos de T. pallidum, y están orientadas a la detección de IgM e IgG específicas generadas durante la infección. No obstante, cabe resaltar que el método de CLIA utiliza tres antígenos recombinantes (Tp47, Tp15 y Tp17), además de ser un inmunoanálisis de dos pasos automatizado, por lo que presenta una elevada sensibilidad y especificidad29.
Adicionalmente se realizó el cálculo de sensibilidad y especificidad del prototipo de ensayo de aglutinación látex-estreptavidina-Tp17 con respecto a CLIA, obteniéndose una sensibilidad de 94,87% (IC=95%, 86,67-100,00) y una especificidad del 100% (IC=95%, 90,00-100,00). El valor de sensibilidad obtenido podría mejorarse sensibilizando a las micropartículas de látex con distintos antígenos recombinantes, y no utilizarse solo uno, ya que la tasa de positividad de inmunoglobulinas específicas para cada antígeno de T. pallidum puede aumentar o disminuir según la fase de la enfermedad6. Si bien el valor de especificidad fue del 100%, sería interesante ampliar el tamaño muestral y poder caracterizar a las muestras clínica y epidemiológicamente.
La concordancia entre el prototipo de ensayo de aglutinación y la prueba no treponémica VDRL fue moderada, por otro lado, la concordancia entre el prototipo de ensayo de aglutinación y la prueba treponémica de CLIA fue casi perfecta.
Los excelentes resultados de sensibilidad y especificidad con respecto a CLIA nos llevan a plantear como perspectivas el empleo del reactivo con un mayor número de muestras y comparar los resultados con un patrón de referencia, para poder obtener una evaluación de la performance orientada a una posible aplicación en la población general.