INTRODUCCIÓN
Desde antaño la enfermedad pulmonar obstructiva crónica (EPOC) representa el modelo paradigmático de patología consecutiva al hábito de fumar, pero dos nuevos fenómenos son actualmente perceptibles en la práctica clínica cotidiana. Por un lado, están las nuevas formas de consumo asociadas a una creciente diversidad de dolencias y por el otro una lista cada vez más numerosa de padecimientos respiratorios asociados al uso de cigarrillos convencionales.
Clasificada dentro del espectro de enfermedades pulmonares intersticiales difusas (EPID) asociadas a tabaquismo1, o mencionada tangencialmente dentro del grupo de patrones coexistentes en documentos referenciales2, el síndrome combinado de fibrosis pulmonar y enfisema (SCFPE) presenta algunas características llamativas que invitan a estudiarla con mayor profundidad.
Dos eventos inauguran una nueva era en el manejo de las EPID: la aprobación de la pirfenidona y al nintedanib para el tratamiento de la fibrosis pulmonar idiopática3 y la definición de consenso de la fibrosis pulmonar progresiva o FPP, que comprende a una EPID con evidencia radiológica de fibrosis pulmonar que cumpla al menos con dos de los siguientes criterios: empeoramiento de los síntomas respiratorios y evidencia fisiológica o radiológica de progresión de la enfermedad4.
En este reporte se describen algunas aristas de la experiencia diagnóstica y aspectos de la terapéutica antifibrótica en nuestro medio, en pacientes con una entidad nosológica peculiar.
PRESENTACION DE LOS CASOS
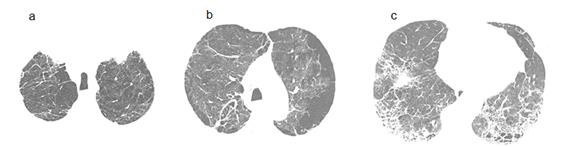
Caso 1. Varón de 63 años, comerciante, fumador de 86 caja/año. Portador de diabetes mellitus tratado con metformina desde hace 4 años, que refiere consultas previas en sanatorios por disnea de varios años de evolución, progresiva desde hace 6 meses hasta pequeños esfuerzos acompañada de palpitaciones ocasionales. Al examen físico presentaba frecuencia cardiaca 110xmin, frecuencia respiratoria 22xmin, saturación arterial de oxigeno (SatO2)90% y crepitantes finos bilaterales bibasales. Datos de laboratorio: leucocitos 8900/mm3, creatinina 1,9 mg/dl, PCR (), HIV no reactivo. Electrocardiograma: taquicardia sinusal y desvío del eje eléctrico a derecha. La tomografía de tórax de alta resolución (TACAR) muestra compromiso difuso del parénquima pulmonar (Figura 1). Espirometría: capacidad vital forzada (CVF) 48% previsto, volumen espiratorio forzado en el primer segundo (VEF1) 62% previsto y VEF1/CVF 74.Ecocardiograma: aumento de cavidades derechas y presión sistólica de arteria pulmonar (PSAP) 60 mmHg. Diagnóstico: SCFPE e hipertensión pulmonar. Se sugiere tratamiento con oxigenoterapia domiciliar, tiotropio y se consensua con familiares el uso de antifibróticos (pirfenidona). A los 6 meses el paciente queda internado por neumotórax del lado derecho y posterior fistula bronco pleural de alto debito que ocasiona óbito después de 18 días de internación.
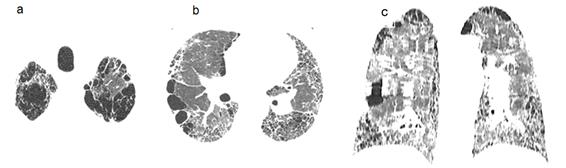
Figura 1. (a) TACAR tórax y vista transversal donde se observa enfisema paraseptal en región apical; (b) penalización periférica y áreas de agrandamiento de espacio aéreo (AEA) así como también bullas dispersas; (c) vista frontal de la TAC donde se aprecia la distribución del enfisema en regiones superiores y el patrón de quistes heterogéneos en regiones inferiores siendo notorio el aumento del tamaño de la rama descendente de la arteria pulmonar.
Caso 2. Varón de 77 años, agricultor, ex-fumador de 60 cajas/año hasta hace 5 años portador de hipertensión arterial y dislipidemia, tratado con losartán y rosuvastatina que consulta reiteradamente en varios hospitales y sanatorios por historia de disnea de 4 años que insidiosamente progresa hasta moderados esfuerzos sumada a tos seca desde hace 3 meses. Al examen físico se constata frecuencia respiratoria 22xmin, frecuencia cardiaca 86xmin, SatO2 92%y crepitantes “en velcro” en región posterior y basal de tórax. Laboratorio: ANA, AntiDNA y FR negativos. Los hallazgos en la TACAR de tórax se describen en la Figura 2. La espirometría mostró CVF 83% del previsto y la prueba de difusión de monóxido de carbono ajustada a hemoglobina (DLCOaj) =41% del previsto. La prueba de marcha de 6 minutos (TM6M) constata 85% de distancia recorrida prevista y disminución de 8% en la SatO2basal. La sintomatología va progresando con el transcurrir del tiempo y al año la disnea se hace a pequeños esfuerzos, los crepitantes son audibles hasta campo medio y la SatO2en reposo 89%. Los estudios funcionales de este lapso objetivan el declive respiratorio (CVF75% previsto, DLCOaj25% previsto), constatándose además una PSAP de 52mmHg a la ecocardiografía. Los controles tomográficos denotan ya un patrón franco de panalización que confirman el avance de la enfermedad. Al establecer el diagnóstico de SCFPE e hipertensión pulmonar se plantea tratamiento con tiotropio, oxigenoterapia y rehabilitación pulmonar más uso compasivo de pirfenidona (antifibrótico) consensuado con paciente y familiares. Se muestra clínicamente estable tolerando bien fármaco hasta el 9no. mes de tratamiento, tiempo en que sus actividades se tornan más limitadas progresando paulatinamente hasta la insuficiencia respiratoria refractaria.
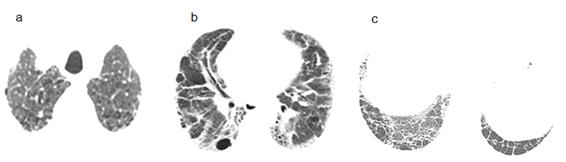
Figura 2. (a) TACAR de tórax que denota enfisema centrilobular en región apical; (b) espesamiento de septos interlobulares, bronquiectasia de tracción, bullas y panalización periférica en campo medio; (c) en las bases se hacen patentes las áreas de panalizaciòn, con vidrio esmerilado y evidente distorsión de la arquitectura.
Caso 3. Varón de 64 años, carpintero, ex fumador de 71cajas/año hasta hace 2 años que consulta por disnea a grandes esfuerzos de 6 meses de evolución. Signos vitales en rango normal. En la Figura 3 se muestran hallazgos en la TACAR. Espirometría: CVF 101% del valor previsto, VEF1 72% del previsto y VEF1/CVF 54; TM6M: 100% distancia prevista pero con disminución de 9% en la SatO2, y DLCOaj 39% del previsto. Medida de volúmenes pulmonares, volumen residual (VR) y capacidad pulmonar total (CPT) 119 % y 118 % del valor previsto respectivamente. El ecocardiograma informaba dilatación leve de aurícula izquierda y de raíz aórtica con PSAP normal. Al tratamiento convencional de EPOC el paciente asiente a tratamiento con pirfenidona que produce intolerancia gástrica manejada con omeprazol. Cumple 18 meses de estabilidad clínica y funcional pero con adherencia irregular al tratamiento (costes).
DISCUSIÓN
Fueron Auerbach et al. en 1974 los primeros en describir la asociación histopatológica de fibrosis pulmonar y enfisema al examinar pulmones de fumadores durante autopsias5. Posteriormente Wiggins et al. describieron las características sintomáticas, radiográficas y funcionales de 8 casos de alveolitis fibrosante criptogénica y dilatación distal de espacios aéreos en 19906, aunque recién desde el año 2005, Cottin propone el empleo del nombre CFPE7.
El SCFPE en conjunción con la bronquiolitis respiratoria asociada a enfermedad pulmonar intersticial, la neumonía intersticial descamativa, la histiocitosis pulmonar de células de Langerhans, la neumonía eosinofílica aguda, la lesión pulmonar aguda por cigarrillo electrónico (EVALI), la enfermedad pulmonar intersticial asociada a artritis reumatoide y los síndromes de hemorragia pulmonar conforman un grupo heterogéneo denominado enfermedades pulmonares difusas relacionadas con el tabaquismo8. No obstante se han publicado asociaciones del SCFPE con artritis reumatoide, esclerodermia, enfermedad relacionada a IgG4 y con trabajo en industria de neumáticos9-11.
Los hombres tienen 9 veces más probabilidades de padecer esta entidad y al parecer existe una relación tipo dosis-respuesta con el tabaquismo pues se cita una exposición media de 40 cajas/año12-13. La serie citada aquí se encuadra dentro de este perfil aunque es interesante mencionar que el síndrome puede verse también en no fumadores.
La disnea progresiva y la caída de la saturación de oxígeno al ejercicio en un paciente con crepitantes posterobasales a la auscultación constituyen el escenario clínico habitual, pese a que pueden coexistir tos productiva, dolor torácico, dedos en palillo de tambor y signos de insuficiencia cardiaca derecha14. Denominador común de los casos presentados aquí es la poli consulta y el tiempo prolongado entre el inicio de los síntomas y el diagnóstico. Cosgrove et al. encontraron que 58% de los pacientes con fibrosis pulmonar idiopática (FPI) consultan previamente con un mínimo de tres médicos y sufren un retraso de un año y medio para el diagnóstico apropiado15. Esta dilación ocurre en varios niveles pero es mayoritaria en la atención primaria y se debe a múltiples factores que las instituciones sanitarias deberían tener siempre en cuenta, ya que impacta definitivamente en el desenlace de ciertos grupos de EPID16.
La TACAR de tórax es pilar diagnóstico del SCFPE y se deben realizar las siguientes consideraciones en relación al componente enfisematoso: distintos tipos pueden observarse (paraseptal, centrilobular y panlobular) y se desconoce si algún subtipo morfológico proyecta significado pronostico per se o si se diferencian evolutivamente de la EPOC. Se propone el nombre de enfisema por tracción a espacios aéreos dilatados resultantes de la concomitancia de lesiones quísticas de paredes gruesas que predominan en regiones posterobasales y que son más prevalentes en esta entidad que en la FPI17. En lo que se refiere al componente intersticial, el patrón más frecuente es la conjunción de panalización, bronquiectasias de tracción y distorsión de la arquitectura en regiones basales (patrón de neumonía intersticial usual o NIU), pese a que áreas de vidrio esmerilado respetando o no zonas subpleurales (patrón de neumonía intersticial no específica o neumonía intersticial descamativa) también se relatan en la literatura. Resulta de sumo interés que el modelo clásico propuesto de enfisema en regiones superiores y fibrosis en segmentos declives es rebatido por el trabajo histológico de Kinoshita et al. que encontraron más bien una colisión de ambas patologías en todos los lóbulos18. En nuestro reporte se observan diferentes morfologías del componente enfisematoso y variable profusión y simetría de la panalizacion, encontrando áreas de vidrio esmerilado.
El contrapeso de la restricción fisiológica secundaria a la fibrosis pulmonar a los efectos del enfisema en las vías respiratorias podría explicar que los valores de CVF, CPT y VR estén preservados y superiores a los observados en la FPI (ajustando la extensión del compromiso orgánico). La relación VEF1/CVF está preservada en comparación con los pacientes con EPOC aislada. Por otro lado la reducción de la DLCO y la hipoxemia al ejercicio son más intensas en el SCFPE19. La diferenciada expresión de los datos espirométricos versus las pruebas de difusión se constató en dos de los pacientes aquí relatados que pudieron acceder a dichos exámenes. La presencia de vasculopatía y/o la variabilidad de medida en la DLCO pueden incidir en su utilidad como marcador de progresión. Hasta la fecha ningún parámetro funcional se considera óptimo para monitorear el curso del SCFPE.
Un grupo de expertos propone identificar a esta entidad como un síndrome, dado que la progresión y las complicaciones (hipertensión pulmonar, cáncer de pulmón exacerbación aguda y mortalidad) devienen de vías patogénicas símiles al enfisema y a la fibrosis pulmonar con quien comparte además el pronóstico sombrío20. La sospecha de hipertensión pulmonar debe ser siempre alta en este grupo de pacientes como se vio en dos de los casos relatados. Es llamativo que en un documento referencial no se cite al SCFPE como causa de FPP4. Es difícil confirmar que el segundo caso presentado aquí haya sido víctima de una FPP pues complicaciones tromboembolicas o mismo la exacerbación aguda pudieron haber sellado el desenlace.
Hasta la fecha, datos extrapolados de la terapéutica de la EPOC aislada y de ensayos en algunos subgrupos de pacientes con FPI construyen las bases del manejo del síndrome aquí presentado. Como parte de las medidas generales siempre hay que incluir la cesación tabáquica, la rehabilitación pulmonar, una adecuada y regular plataforma de vacunaciones (influenza, neumococo, SARS-CoV2), oxigenoterapia suplementaria y no perder siempre la posibilidad de contemplar el trasplante pulmonar pese a que este último aún está en el horizonte de la medicina paraguaya. En lo que atañe al componente enfisematoso podría analizarse el uso de broncodilatadores y corticoides inhalados según estén indicados, así como también los procedimientos broncoscópicos o quirúrgicos de reducción pulmonar. Existen experiencias sobre el tratamiento de la exacerbación aguda con corticoides con dispares resultados, al igual que el enfoque de la hipertensión pulmonar con vasodilatadores21.
La demostración de que la pirfenidona y del nintedanib retrasan la progresión en algunos pacientes con FPI leve a moderada y otros tipos de FPP ha marcado una nueva era en el enfoque de esta entidad que antes se consideraba intratable. Los resultados del tratamiento con pirfenidona en el SCFPE relatados en el presente trabajo son difíciles de evaluar ya sea por tratarse de entidades muy avanzadas o por la heterogeneidad de los estadíos y hasta por la irregularidad en la adherencia debido a coses suscitada en uno de los casos. Se debe recalcar que aún faltan trabajos sólidos para evaluar la efectividad de este nuevo grupo de fármacos en determinados subtipos de EPID22,23, quedando muchas respuestas que trabajar: ¿Es mejor la pirfenidona? ¿Se debería optar por el nintedanib?, ¿Mejorarán los desenlaces con ambas drogas utilizadas en conjunto?, ¿Los diferentes tipos de enfisema o las distintas enfermedad intersticiales que comprenden al síndrome, conllevan pronósticos disimiles?, ¿Es más eficaz la terapéutica en formas tempranas?.
En conclusión, presentamos la primera serie de casos de SCFPE y el uso terapéutico de pirfenidona en nuestro país. Es relevante mencionar que los casos relatados testimonian el largo proceso que atraviesan los pacientes antes de su diagnóstico y terapéutica, aspecto que debe cambiar radicalmente. Por último, se debería contemplar la inclusión de equipos multidisciplinares en diferentes hospitales así como la disponibilidad de nuevas drogas para mejorar el manejo del SCPFE y otros grupos de EPID.