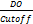INTRODUCCIÓN
La tripanosomiasis americana o enfermedad de Chagas (ECh), causada por el hematozoario Trypanosoma cruzi, es una zoonosis que existe en 21 países de América1. En Paraguay la enfermedad es endémica, siendo el número de personas infectadas de aproximadamente 165.000, y la población expuesta de 30 % en el 20122. Los números de casos y tasas de incidencia de las Enfermedades de Notificación Obligatoria (ENO), comparativo en el mismo periodo de la semana epidemiológica (SE) 1 a la 30 de los años 2017, 2018 y 2019 se han informado como 393, 395 y 339 casos respectivamente3.
La enfermedad puede transmitirse mediante transfusión sanguínea (5-20%), en países como Argentina, Brasil y Chile se observan de 1,4 - 18% de casos y en Bolivia alcanza un 48%4. En bancos de sangre de Paraguay la prevalencia de esta enfermedad en los años 2001 - 2005 fue del 2,8 - 4,5%, y el 14% en la región de Boquerón -Chaco en el 20124,5.
Como cita en la guía para el diagnóstico y tratamiento de la Enfermedad de Chagas en el 2018 por la OMS y OPS a los pacientes con sospecha diagnóstica de infección crónica por T. cruzi se sugiere utilizar el “estándar de diagnóstico”, es decir, la combinación de dos pruebas serológicas con diferentes antígenos , convencionales con antígenos crudos o extractos solubles y no convencionales que utilicen combinaciones de proteínas recombinantes que detecten anticuerpos contra T. cruzi como el Ensayo inmunoenzimático (ELISA), Hemoaglutinación indirecta (HAI) o Inmunofluorescencia indirecta (IFI), y una tercera si los resultados de dichas pruebas son discordantes6,7.
Entre las pruebas de diagnóstico serológico, el ELISA cuenta con muchas ventajas operativas de automatización, registro e interpretación de los resultados, además de ofrecer una alta sensibilidad y especificidad8,9.
Evaluaciones realizadas con pruebas de ELISA comerciales, así como técnicas ELISA “in house”, demostraron una sensibilidad del 100%. En cuanto a la especificidad, las técnicas convencionales que utilizan antígeno crudo son 100% específicas, no así las pruebas con antígenos recombinantes que pueden dar lugar a resultados falsos positivos8.
Asimismo, la mencionada guía menciona que el método de ELISA no solo es sensible sino también en la aplicación representa un menor costo frente a otros métodos por lo que existe una recomendación fuerte en utilizar el ELISA o el test inmunocromatográfico (ICT) para estudios poblacionales de prevalencia de la enfermedad de Chagas dando calidad de evidencia sobre la precisión diagnóstica de alta/moderada6,7.
Por lo mencionado anteriormente, también es recomendada la utilización del ELISA altamente sensibles o inmunoensayo quimioluminisciencia de micropartículas (CMIA) para el tamizaje de la enfermedad de Chagas en los servicios de Hemoterapia dando calidad de evidencia alta/moderada6,7.
Cabe mencionar que no todos los test comerciales emplean cepas de T. cruzi locales, por lo que es importante el desarrollo de pruebas de ELISA que utilicen estas cepas para mejorar la sensibilidad y especificidad. Por esta razón, el Instituto de Investigaciones en Ciencias de la Salud ha desarrollado un ELISA indirecto convencional que detecta IgG anti T.cruzi con el Chagas ELISA IICS v.1.0 que es utilizado en el sector privado y por el Programa Nacional de Control de la Enfermedad de Chagas del Paraguay (SENEPA-MSPyBS) desde sus inicios pensado para trabajos de campo por la ventaja que ofrece la lectura a la vista10.
Por las exigencias tecnológicas se ha desarrollado el ELISA indirecto Chagas ELISA IICS V.2.0 en el marco del proyecto 14-INV-Conacyt con alta sensibilidad y especificidad para cumplir con los estándares de calidad exigidos y ser adaptado a los autoanalizadores para mayor eficiencia del proceso e interpretación por medio de índice. Por ello, se ha evaluado el kit de Chagas test IICS V2.0 para tamizaje de la enfermedad de Chagas, en muestras de banco de sangre.
MATERIALES Y MÉTODOS
Se realizó un estudio de pruebas diagnósticas de tipo transversal. Fueron incluidas 775 muestras de suero, con serología positiva (n=352) y serología negativa (n=423) para la enfermedad de Chagas provenientes de donantes de sangre que acudieron al Banco de Sangre del Hospital de Clínicas de la Facultad de Ciencias Médicas, UNA y al Centro Nacional de Servicio de Sangre (CENSSA). La selección de las muestras de estos bancos de sangre se basó en los resultados positivos y negativos para la detección de anticuerpos IgG anti-T cruzi por métodos automatizados. Todas ellas fueron colectadas entre los años 2014-2015 y almacenadas a -20°C hasta su utilización para este estudio. De las 775 muestras, fueron seleccionadas 224 para determinar la concordancia y correlación respecto a un test similar de ELISA.
ELISA
La prueba convencional Chagas ELISA IICS V.2.0 es un ensayo semicuantitativo para detectar anticuerpos IgG anti-T. cruzi que utiliza antígeno crudo de epimastigotes de T. cruzi (ciclo completo Y) preparado en el Departamento de Medicina Tropical del IICS-UNA.
Las muestras y los controles fueron diluidos 50 veces, se agregaron 50 uL a los pocillos sensibilizados para luego incubar a 37º C durante 30 minutos. Pasado el tiempo se realizaron 3 lavados con un tampón de lavado. A continuación, se incubó con un segundo anticuerpo anti-IgG humano de cabra conjugado con enzima peroxidasa (IICS-UNA) a 37º C durante 30 minutos. Luego de tres lavados se agregó el sustrato ABTS (2,2'-azinobis [3-etilbenzotiazolina-6-ácido sulfónico]-sal de diamonio) en tampón citrato y se incubó a temperatura ambiente durante 20 minutos para leer la densidad óptica (DO) a 405 nm. Todos los pasos son identificados por colores diferentes.
Para interpretar los resultados se calculó el índice, dividiendo la DO obtenida por el cut off (I=
. El cut off se consideró como el promedio de dos o más controles negativos sumado 0,200.Se consideró como negativo un índice menor o igual a 1; indeterminado entre 1 y 1,3 positivo mayor o igual a 1,3.
Para determinar la concordancia con una prueba no convencional, se utilizó la prueba Chagatest v.4.0 (Wiener, Rosario, Argentina), que utiliza antígenos recombinantes específicos de los estadios epimastigote y tripomastigote ( SAPA , 1, 2, 13, 30 y 36) para la detección cualitativa de anticuerpos anti-T. cruzi en muestras de suero o plasma humano, de acuerdo con las instrucciones del fabricante.
Análisis estadístico: Toda la información fue colectada y recopilada en hojas de cálculo de Microsoft Excel. Para los cálculos de sensibilidad, especificidad, valor predictivo positivo (VPP), valor predictivo negativo (VPN), la curva ROC (Característica Operativa del Receptor) concordancia por índice kappa y el coeficiente de correlación de Pearson se utilizó el programa Epidat versiones 3.1 y 4.2. Se consideró para la significancia estadística una p<0,05 para todos los análisis y un nivel de confianza del 95%.
RESULTADOS
Respecto a las 775 muestras de bancos de sangre, se obtuvo para el ELISA Chagas test IICS V2.0 una sensibilidad del 99%, especificidad de 96%, VPP 96%, VPN 99% y una índice kappa igual a 0,95 (0,93-0,97) Error Estándar (EE) 0,01 y p>0,0001, el cual es considerado casi perfecto. En la Tabla 1 se observa la distribución de los sueros analizados.
Tabla 1: Evaluación del kit Chagas test IICS V2.0 vs Banco de Sangre.
| Sueros de banco de Sangre | |||
|---|---|---|---|
| ELISA IgG Chagas V2 | Positivos | Negativos | Total |
| Positivo | 348 | 14 | 362 |
| Negativo | 4 | 409 | 413 |
| Total | 352 | 423 | 775 |
Sensibilidad del 99% (97-100%), Especificidad de 96% (95-99%), VPP 96% (94-98%), VPN 99% (97- 100%).
Se determinó la curva ROC para evaluar el desempeño del ELISA IgG Chagas V2.0 con respecto a los resultados de los bancos de sangre, en base a la sensibilidad y especificidad obtenidas. Se observa una excelente capacidad discriminativa de la prueba ya que está muy próximo a 1, dando el área bajo la curva igual a 0,9835. Figura 1
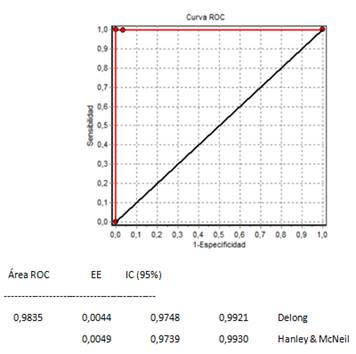
Figura 1: Curva ROC del ELISA IgG Chagas IICS V2.0 con respecto a los resultados de dos Bancos de Sangre Nacionales.
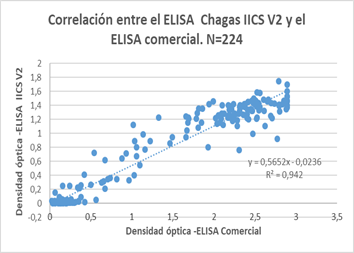
De 224 muestras positivas y negativas seleccionadas para determinar la concordancia con un test comercial (Wiener 4.0) para la enfermedad de Chagas, se obtuvo una índice kappa de 0,926 (0,888-0,976; error estandar de 0,0257) con una p=0,00001 y un coeficiente de correlación de Pearson r=0,971 (0,962-0,978) con una p=0,0001. En la Figura 2 se observa la correlación positiva entre ambos métodos de acuerdo con las densidades ópticas obtenidas.
DISCUSIÓN
De acuerdo con los resultados obtenidos, la sensibilidad del Chagas test IICS V2.0 es de 99%, al comparar los resultados con los de los bancos de sangre (FCM, UNA y CENSSA).
En estudios realizados sobre enfermedades más prevalentes en Banco de sangre en Paraguay, mencionan a la enfermedad de Chagas, al virus de la Hepatitis B y el Treponema pallidum11-13. Por esta razón se utilizan plataformas como ELISA o CLIA para las pruebas serológicas en bancos de sangre ya que deben ser de alta sensibilidad para descartar la mínima sospecha de reactividad6,13.
En nuestro estudio hemos comparado con las muestras procesadas en banco de sangre obteniendo una sensibilidad con respecto a los resultados del tamizaje igual al 99% indicando una alta sensibilidad capaz de identificar como positivo a los enfermos, tal como indican las recomendaciones para tamizaje en bancos de sangre 14, así mismo también es recomendado para la enfermedad de Chagas la utilización de dos pruebas sensibles y su confirmación posterior con otra prueba de fundamento diferente altamente específico15.
En cuanto la capacidad del ELISA IgG Chagas test IICS V2.0 de predecir la ausencia o la presencia de enfermedad, los valores predictivos representan la probabilidad de que el paciente tenga la enfermedad una vez que se conozca el resultado de la prueba. En nuestro estudio el VPP fue de 96% (94-98%) lo que significa alta probabilidad de que un individuo con prueba positiva tenga la enfermedad y el VPN 99% (97-100%) alta probabilidad de que un individuo con prueba negativa no tenga la enfermedad16.
Los valores predictivos cambian con la prevalencia de la enfermedad en la población. En el caso de la enfermedad de Chagas la prevalencia en la población expuesta se encuentra dentro del 2 al 14%4,5 por lo que se necesitan pruebas muy sensibles y de VPP elevado ya que es el parámetro de mayor relevancia para los programas de tamizaje, debido a que un valor bajo significa una prevalencia baja o que la prueba es poco específica o ambas cosas16.
El ELISA Chagas test IICS V2.0 cumple con los criterios de validez y seguridad, ya que se observaron altos valores de sensibilidad y especificidad, como también en los valores predictivos, siendo una prueba ideal para ser utilizado en el tamizaje de la enfermedad17.
En cuanto al desempeño del ELISA mediante la curva ROC se observó alta capacidad discriminativa, ya que los valores se aproximan a 1, esta capacidad es la que se considera óptima para una prueba a ser utilizada como método de tamizaje y podría ser aplicada en bancos de sangre18-20.
El ELISA Chagas test IICS V2.0 es una técnica muy sensible para el diagnóstico de la enfermedad en la etapa crónica, y puede ser utilizado en laboratorios de análisis clínicos y bancos de sangre para el diagnóstico de la enfermedad en conjunto con otras pruebas de fundamento diferente6-7. En comparación con el ELISA comercial de antígenos recombinantes, hemos obtenido una concordancia con índice kappa de 0,926 (0,888-0,976) estadísticamente significativa, considerada una concordancia casi perfecta según la escala de Landis y Kosh18.
Las concordancias obtenidas fueron muy buenas con respecto a la serología de las muestras de banco de sangre como la comparada con el test comercial, pudiendo utilizarse el kit de Chagas IICS V2.0 para el tamizaje de la enfermedad.