INTRODUCCIÓN
La leishmaniasis es una zoonosis, causado por parásitos flagelados del género Leishmania, y es trasmitida mediante la picadura de un flebótomo, dependiendo de la especie de Leishmania involucrada, pueden aparecer una variedad de manifestaciones clínicas en el ser humano. Las lesiones de esta enfermedad son causadas por distintas especies de protozoario del género Leishmania, y se han identificado a nivel mundial más de 20 especies; la mitad de ellas han sido encontradas en América. La forma en la que afecta la leishmaniasis en la salud, principalmente a las poblaciones más pobres, ha hecho que se encuentre dentro de las enfermedades tropicales desatendidas identificadas por la Organización Mundial de la Salud (OMS), con una estimación anual de 1 a 1,5 millones de casos de leishmaniasis cutánea y 500.000 casos de leishmaniasis visceral1. En la búsqueda de alternativas terapéuticas a esta problemática de salud se plantea el uso de las plantas, debido a que éstas han sido de mucha importancia para el hombre a través de los tiempos; además, algunas de ellas se utilizan en la medicina tradicional contra la leishmaniasis2. Las plantas medicinales han sido contempladas en el inicio del desarrollo de los fármacos, siguen contribuyendo al descubrimiento de nuevas moléculas con actividad biológica y son utilizadas para futuros fitofármacos. Gracias a los efectos benéficos que han tenido a lo largo de la historia, las plantas o productos botánicos siguen siendo utilizadas hasta hoy en forma de prevención o tratamientos3. Se estima que el 25% de medicamentos sintéticos están hechos a base de 11 plantas, para tratamientos de diferentes enfermedades. La OMS determina como medicamentos básicos y esenciales a 252 medicamentos de los cuales un 11% corresponde a medicamentos que tienen su origen en plantas obtenidas a partir de precursores naturales4. En el Paraguay, P. punctatum crece como maleza y no se aprovechan sus beneficios. Para este estudio fue elegida esta especie vegetal. El género Polygonum posee una distribución mundial, se encuentra desde Estados Unidos hasta el sur de la Argentina. Se desarrolla en los campos de terrenos bajos, inundables, húmedos, a orillas de ríos, arroyos, arrozales, aunque muchas veces forman malezales conocidos con el nombre de "cataysales”5. En estudios realizados experimentalmente se comprobaron las actividades antibacteriana y antifúngica de extractos diclorometánico, metanólico, hidroalcohólico y acuoso de P. punctatum 6). En el momento de evaluar un compuesto en busca de una actividad específica, como en este caso en busca de actividad leishmanicida, es fundamental llevar a cabo ensayos citotóxicos cuantificables como complemento a los ensayos in vitro sobre las diferentes formas parasitarias7. En la búsqueda de alternativas terapéuticas a esta problemática de salud se plantea el uso de las plantas, pues estas han sido de gran importancia para el hombre a través de los tiempos. Debido a que los tratamientos son escasos y poco eficientes, resulta clara la necesidad de la búsqueda de nuevas moléculas candidatas en base a productos naturales para tratamientos efectivos y no tóxicos de esta enfermedad, por ello en este estudio se determinó la actividad citotóxica y el efecto leishmanicida in vitro del extracto etanólico de P. punctatum, empleando macrófagos murinos y promastigotes de L. infantum, L. amazonensis y L. braziliensis, a modo de tamizaje para elucidar su potencial antileishmaniásico.
MATERIALES Y MÉTODOS
Material Vegetal
La especie vegetal fue colectada en la ciudad de Carapeguá, Municipio de Carapeguá Departamento de Paraguarí con coordenadas geográficas 25°44´40.2” S, 57°20´07.8” W. A fin de verificar la identidad de la especie vegetal colectada, fue identificada por personal del Laboratorio de Análisis de Recursos Vegetales (Dpto. de Biología) de la Facultad de Ciencias Exactas y Naturales (FACEN) en cuyo herbario se encuentran depositados los especímenes correspondientes con el Nro.4972, (Benítez Nro. FB 1).
Elaboración del extracto vegetal
Las hojas y tallos de P. punctatum Elliot fueron deshidratados a temperatura ambiente durante una semana, en un recinto cerrado. El material vegetal deshidratado obtenido fue transportado al laboratorio del departamento de Medicina Tropical del Instituto de Investigación en Ciencias de la Salud - (IICS-UNA), donde se procedió a la molienda (fragmentación de tallos y hojas en pequeñas partículas) con un molino mecánico hasta obtener una muestra fina homogénea para aumentar el área de superficie y facilitar la penetración del disolvente en las células, la cual fue sometida a un proceso de extracción por maceración continua durante cuatro días con etanol industrial al 98%. El extracto total fue filtrado y evaporado al vacío con un rotaevaporador, con agitación constante a 40 °C de 220V y 50Hz, de esta forma se obtuvo un concentrado, el cual se llevó hasta secar la muestra a baño María y así se obtuvo un extracto bruto crudo.
Ensayos de evaluación biológica
Los ensayos fueron realizados en el Departamento de Medicina Tropical del Instituto de Investigaciones en Ciencias de la Salud (IICS- UNA).
Cepas de Leishmania
Se utilizaron cepas de LEM 75 - Leishmania (Leishmania) (MHOM/FR/78/LEM 75), LEM 690 Leishmania (Leishmania) amazonensis (MHOM/BR/73/M2269), CUR 22 - Leishmania (Viannia) braziliensis(MHOM/BR/75/ M2903). Estos parásitos fueron mantenidos por pasajes sucesivos en medio Schneider enriquecido con 10% de suero fetal bovino e incubados en estufa a 28ºC. Los pasajes se realizaron cada cuatro días, o cada semana dependiendo de la cepa. Tanto para los pasajes como para los ensayos se realizaron en forma totalmente estéril, y se utilizó una cabina de flujo laminar (GELAIRE® BSB 4ª Flow Laboratories).
Evaluación de la actividad leishmanicida
Se pesó 100 µg del extracto y se disolvió utilizando DMSO (DimetilSulfóxido), más el medio Schneider hasta llegar a una concentración de 100 μg/ml. Los parásitos promastigotes en fase de crecimiento logarítmico de las tres cepas de parásitos de Leishmania mencionadas fueron distribuidos en una microplaca de 96 pocillos a una concentración de 106 parásitos/ml. Cada pozo fue tratado con las diferentes concentraciones del extracto (100, 75, 50, 25, 20 y 10, µg/ml) y la prueba fue realizada por triplicado. Se incubaron en estufa a 28ºC durante 72 horas, pasado dicho tiempo, se observaron los parásitos utilizando un microscopio invertido OLYMPUS IMT-2. Para el control se utilizó el mismo cultivo de parásitos en medio Schneider también por triplicado. La actividad se evaluó mediante conteo óptico en microscopio, comparándose con pocillos control positivo y negativo. Los resultados de la actividad leishmanicida también fueron expresados en valores de porcentajes en una tabla y gráficos en Excel (2016).
La determinación de la concentración inhibitoria 50% (IC50) se realizó mediante el análisis Probit, para ello se empleó un complemento Excel (Finney, 1952).
Ensayo de citotoxicidad en macrófagos
Para la realización de esta técnica se utilizaron 3 ratones Mus musculus albinos, machos sanos de 20 g de peso promedio y con 12 horas de ayuno. Se utilizaron macroplacas de titulación de 24 pocillos con laminillas de forma redondeadas. El procedimiento se realizó en condiciones de total esterilidad utilizando una cabina de flujo laminar GELAIRE ® BSB4A Flow Laboratories, las diluciones y los controles se realizaron por triplicado. Los ratones fueron sacrificados utilizando el método de eutanasia por agente químico inhalatorio, cuya especie química es el dióxido de carbono (CO2) (CIOMS- ICLAS, 2012).
La metodología utilizada fue la extracción del contenido del peritoneo de cada animal, se guardó en un tubo estéril hasta su utilización. Se centrifugó el preparado a 1600 rpm durante 10 minutos. Se resuspendió en medio RPMI y se contó en cámara de Neubauer (1.3.106 macrófagos / ml). Se utilizaron macroplacas de 24 pocillos a los cuales se le colocaron laminillas de forma redondeada previamente sumergidas en ácido nítrico al 3 %, esto para mejor adherencia de los macrófagos.
Se colocaron 100 (l del medio RPMI conteniendo los macrófagos (1.105 macrófagos /cubre) en cada pocillo. Se incubó a 37ºC -5% CO2 durante 3 horas. Se pesaron 2 mg del extracto y se disolvió con PBS. Para este ensayo se realizaron diluciones a concentraciones de producto de 100, 50 y 25 (g/ml. Se realizó un lavado de los pocillos con medio RPMI de manera a eliminar los macrófagos que no se adhirieron a las laminillas y se pusieron en contacto las diferentes diluciones de los productos con las células de macrófagos. Luego se incubaron nuevamente en estufa a 37ºC- 5% CO2 durante 48 horas.
Para la evaluación se utilizó microscopio invertido y la lectura se realiza con azul de tripán al 0.4%. Se contaron 100 macrófagos y se determinó la frecuencia de vivos y muertos. Se compararon los resultados de las concentraciones con el control. Todos los ensayos fueron realizados por triplicado.
Asuntos estadísticos: Se determinó la concentración inhibitoria media máxima (IC50- es una medida cuantitativa que indica la cantidad de una sustancia que se necesita para inhibir, in vitro, un proceso biológico dado o componente biológico en un 50%). Se utilizó la prueba de bondad de ajuste de Pearson para determinar si el modelo Probit se ajusta adecuadamente a los datos proporcionados por los experimentos. La IC50 y el límite de confianza del 95% correspondiente se determinaron a partir de una curva de regresión de mortalidad, usando el método de análisis de Probit.
Asuntos éticos: Se siguieron las recomendaciones de la Guía de Principios Internacionales para Investigaciones Biomédicas que envuelven animales, elaborados por el Consejo de Organizaciones Internacionales de Ciencias Médicas18. Se utilizó la cantidad mínima posible de animales y se tomaron todas las precauciones para evitarles sufrimientos innecesarios.
RESULTADOS
Se evaluó la actividad leishmanicida in vitro del extracto etanólico de P. punctatum Elliot. contra formas promastigotes de las cepas de Leishmania: L. infantum, L. amazonensis y L. braziliensis.
Actividad leishmanicida
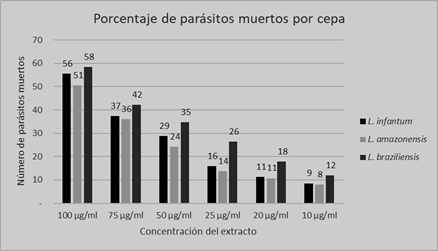
Se determinó que el extracto etanólico de P. punctatum Elliot. presentó mayor actividad frente a las cepas de L. infantum, L. braziliensis. A una concentración de 100 µg/ml produjo una lisis parasitaria de 56 y 58% de dichas cepas, a esa misma concentración disminuyó la actividad frente a L. amazonensis. A una concentración de 50 y 25 µg/ml la actividad fue mayor contra L. braziliensis, no así en L. amazonensis y L. infantum. De esta manera se comprobó que el extracto etanólico de P. punctatum presentó una mayor actividad frente a los parásitos de la cepa de L. braziliensis, en todas las concentraciones del extracto (Figura 1). Se observó que a medida que disminuía la concentración de extracto disminuía el porcentaje de parásitos muertos.
Con los datos obtenidos del ensayo se procedió a la construcción de curvas dosis-respuesta para cada cepa de parásitos de Leishmania, en donde se observó una inhibición del 50% de viabilidad de los parásitos que fueron tratados en los ensayos de efectividad sobre promastigotes y fue comparado con el control positivo anfotericina B, se observó que las concentraciones a las cuales alcanzarían su IC50 eran respectivamente: 107 µg/mL para L. infantum, 120 µg/mL para L. amazonensis; y102 µg/mL para L. braziliensis.
Citotoxicidad en macrófagos
En el presente estudio, se realizó un ensayo para evaluar los parámetros relacionados con la acción citotóxica de diferentes concentraciones del extracto etanólico de P. punctatum.
Para dicha evaluación se realizaron contajes de 100 células por pozo y de esta forma se determinó la frecuencia de vivos y muertos en todas las concentraciones, teniendo en cuenta que el colorante azul de tripán tiñe los macrófagos muertos. A una concentración de 100 µg/mL presentó un porcentaje de células vivas de 94% comparando con el control negativo que fue de 100%. Además, se pudo observar un comportamiento similar comparando con el control negativo en las concentraciones de 50 y 25 µg/mL con 84 y 91% de células vivas. Se pudo observar que todos los porcentajes de células vivas eran valores altos comparados con dicho control negativo aún con altas concentraciones del extracto (Tabla 1). Los resultados obtenidos con el ensayo de viabilidad celular no evidenciaron una acción citotóxica clara del extracto de P. punctatum frente a las células de macrófagos a las condiciones experimentales realizadas.
Tabla 1. Porcentaje de células vivas y muertas de cada concentración y control del extracto de P. punctatum Elliot y sus respectivas desviaciones estándar.
| Concentración de Compuestos | 100µg/ml | 50µg/ml | 25µg/ml | Control Negativo | Control Positivo |
| Números de Macrófagos | Extracto P. punctatum | Extracto P. punctatum | Extracto P. punctatum | Macrof. +RPMI | Macrof +DMSO |
| Vivos | 94,33±4,1633 | 84±1,7321 | 91,3±2,89 | 100±0 | 8,33±1,155 |
| Muertos | 5,66±4,163 | 16±1,7321 | 8,3±3,215 | 0 | 91,66±1,155 |
DISCUSIÓN
En este estudio de búsqueda de compuestos con actividad leishmanicida de plantas utilizadas en la medicina tradicional se ha demostrado que el extracto etanólico de P. punctatum presentó actividad leishmanicida in vitro cuando fueron evaluados contra formas promastigotes de tres cepas de parásitos, según se observó que las cepas de L. infantum y L. braziliensis presentaban mayor actividad que la de L. amazonensis. Esta diferencia observada en los resultados podría deberse a la gran variabilidad genética entre las cepas estudiadas8. El extracto etanólico ensayado es una mezcla de varias partes de la planta, de esta forma la actividad observada podría deberse también a un efecto sinérgico de todas las sustancias presentes en el extracto crudo de la planta, sería importante separar en fracciones y de esa forma obtener las moléculas aisladas9. Es importante mencionar que se debe tener en cuenta la parte de la planta utilizada, la época de colecta del material vegetal, la forma de utilización, así como la influencia de factores ambientales, ecológica, climática y geomorfológica que pueden influir en la producción de metabolitos secundarios. Esta variabilidad en la composición química de la planta puede ser un factor importante a la hora de obtener los resultados de ensayos in vitro que no confirmen la actividad para el uso tradicional de la planta10. Existen estudios en los que se utilizó partes aéreas de P. salicifolium, una planta del género Polygonum, la cual contenía metabolitos secundarios que presentaban actividad leishmanicida sobre L. mexicana y no presentó actividad citotóxica sobre una línea celular humana11.
Para el estudio de viabilidad celular es importante destacar que la tinción de azul tripán en las células expuestas a los extractos permite que se pueda visualizar y diferenciar entre células viables de las no viables, siendo la membrana celular la que deja atravesar color antes si presentan daños, de esta forma se predice la muerte celular, siendo este factor el que justifica los cambios que se seguirán realizando con los extractos para ser considerado un probable candidato a fármaco. El azul tripán mide la acción citotóxica de una sustancia desde el punto de vista metabólico y de viabilidad, en un periodo de tiempo corto, por lo cual puede ser reversible en determinadas circunstancias. Por otro lado, la evaluación de la supervivencia celular por medio de la eficiencia de clonación permite la evaluación de la capacidad proliferativa de la población celular12. Se ha observado que P. punctatum no presenta actividad citotóxica y tiene actividad antiproliferativa13.
En Paraguay P. punctatumse utiliza como medicina tradicional debido a sus propiedades antiinflamatorias, las partes aéreas o las hojas se utilizan habitualmente en preparaciones galénicas a partir de la propia planta y es posible que la propiedad antiinflamatoria de la planta se deba a la presencia de poligodios en las partes aéreas, sin embargo, este compuesto es en realidad responsable de la actividad antifúngica14. En Paraguay este es el primer estudio de evaluación leishmanicida de la planta P. punctatum. Se logró evaluar biológicamente el extracto etanólico obtenido de P. punctatum. De esta manera, este estudio revela que dicho extracto presenta una actividad leishmanicida en ensayos experimentales in vitro, frente a las formas promastigotes de L. infantum, L. amazonensis y L. braziliensis, y no presenta citotoxicidad en las células de macrófagos de ratones, en las concentraciones experimentales realizadas, por lo que se podría considerar a P. punctatum como candidato para completar con estudios biológicos tanto in vivo e in vitro sobre otros parásitos como T. cruzi.
Para estudios futuros se recomienda separar los metabolitos secundarios mayoritarios del extracto y determinar sus estructuras, realizar estudios de viabilidad celular de cada fracción con el fin de evaluar su potencial como candidato a fármacos.