INTRODUCCIÓN
En diciembre de 2019, surgió un brote de neumonía en Wuhan, China causado por un nuevo beta coronavirus1,2. La Organización Mundial de la Salud (OMS) nombró a este nuevo virus Severe acute respiratory syndrome coronavirus 2, SARS-CoV-2 y a la enfermedad COVID-193,4. La manifestación clínica de la enfermedad es variable, la mayoría de las personas que se contagian presentan síntomas de intensidad leve o moderada, y se recuperan sin necesidad de hospitalización, otros pueden desarrollar una neumonía severa con insuficiencia respiratoria aguda, distrés respiratorio agudo del adulto, sepsis y choque séptico que conduce a la muerte5. Alrededor del 20% padece una enfermedad grave que requiere suplementos de oxígeno y, en ocasiones, cuidados intensivos con asistencia respiratoria mecánica. La mala evolución del paciente con COVID-19 tiene múltiples causas; por el propio virus, por la inflamación inducida por el virus, por eventos trombóticos, como una embolia de pulmón, o por una sobreinfección. Cada uno de estos factores debe tratarse de manera diferente, de manera personalizada3.
La mortalidad por la COVID-19 varía en los diferentes estudios, Whang et al3 informaron 4,3 % en China, Gracelli et al6 26 % en Italia, Araujo et al7 18,4% en Chile, Rearte et al8 6 % en Argentina, Casas Rojo et al5 21 % en España, y en Estados Unidos, 40,4%(9) y 21 %10. En Paraguay, la mortalidad fue de 7,3 %11 en pacientes hospitalizados y ambulatorios en Alto Paraná entre el 12 de agosto y 20 de octubre del 2020, en el mismo estudio en los hospitalizados, fue 38,7%11. En Asunción, la mortalidad fue de 22 %12 en pacientes hospitalizados en un hospital de contingencia para COVID 19 entre el 30 de marzo al 15 de agosto del 2020. En el Hospital Nacional, se informó una mortalidad del 5%13 en los primeros 60 casos hospitalizados entre junio a agosto del 2020 y 30,3% entre mayo - octubre 202014.
Entre las pruebas comerciales disponibles de gran desempeño se encuentra Xpert® Xpress SARS-CoV-2 test de Cepheid, EE.UU que proporciona resultados en 45 minutos utilizando GenXpert benchtop system. En las muestras clínicas Xpert Xpress SARS-CoV-2 alcanzó una coincidencia del 100 % en comparación con otras RT-PCRs desarrolladas, y el ensayo superó las plataformas de diagnóstico utilizadas habitualmente en el panel de sensibilidad con un límite de detección de 8,26 x 101 copias/mL15.
Las mediciones de la carga viral de muestras de tejido son indicativas de la replicación activa del virus y se utilizan de forma rutinaria para monitorear infecciones virales graves del tracto respiratorio, incluida la progresión clínica, la respuesta al tratamiento, la curación y la recaída16-18. Se ha mostrado que el SARS-CoV-2 se transmite fácilmente en la etapa temprana de la infección, aún en pacientes asintomáticos, lo que sugiere una alta carga viral en esta etapa19-21. Un estudio informó que las cargas virales fueron similares entre los pacientes asintomáticos y aquellos con síntomas22. Además, se ha encontrado que las cargas virales se relacionan con una mala evolución de la enfermedad, un estudio encontró que en casos severos eran hasta 60 veces mayores que en casos leves23. Otro estudio identificó el virus durante el curso de la infección en muestras de vías respiratorias uno a dos días antes de los síntomas y persistir hasta dos semanas en casos severos24. También se ha detectado desprendimiento de ARN viral en las heces, exudado faríngeo, sangre, plasma, saliva y orina, desde cinco días después del inicio de los síntomas hasta cuatro a cinco semanas25-28.
Sin embargo, aún no se ha establecido claramente la dinámica de la carga viral en el tracto respiratorio inferior y otras muestras de tejido y la relación entre la carga viral y la gravedad de la enfermedad, información que es importante para la formulación de estrategias de control de enfermedades y tratamiento clínico.
El objetivo del estudio es determinar la relación entre la carga viral medida por Ct de los genes E y N2 SARS-CoV-2 y la severidad de la infección por el virus SARS-COV-2 en pacientes internados y ambulatorios en el Hospital Nacional en el periodo marzo -junio 2021.
MATERIALES Y MÉTODO
Diseño y área de estudio
Estudio observacional analítico retrospectivo de corte transversal de pacientes con COVID -19 internados en el Hospital Nacional en el periodo marzo-junio 2021. Fueron incluidos los pacientes adultos con diagnóstico de COVID-19 internados en el Hospital Nacional. Fueron excluidos los pacientes con diagnóstico de COVID -19 por otros métodos. El diagnóstico de COVID-19 fue realizado por el método Gene- expert.
Variables
Umbral de ciclos de PCR de SARS-CoV-2 (alta: Ct <25 y baja: Ct ≥25), edad dicotomizada en >60 y ≤ 60 años, sexo femenino/masculino, presencia o ausencia de co-morbilidad, tiempo de enfermedad (desde inicio de síntomas hasta hospitalización), óbito, gravedad de la enfermedad según clasificación de la OMS: Leve, moderado, grave, hospitalización. Todas las variables fueron registradas durante la internación.
PCR de SARS-CoV-2
El dispositivo utilizado (Xpert Xpress SARS-CoV-2 constituye una prueba de diagnóstico in vitro automatizada para la detección cualitativa de ácidos nucleicos del virus y se proyecta como método de prueba en el sitio de atención que tiene como objetivo abreviar el tiempo diagnóstico de la RT-PCR estándar. Tiene sensibilidad de 97,8% y especificidad del 95,6% (comparado a EUA RT-PCR como patrón oro en una muestra de 90 individuos) y un límite de detección de 0.0050 and 0.0200 ufp/mL (unidades formadoras de placa /mililitros) para dianas N2 y E, respectivamente (15.
Las muestras clínicas fueron analizadas en sistemas Cepheid GeneXpert utilizando Xpert Xpress SARS-CoV-2 siguiendo las instrucciones del fabricante. Brevemente, el blanco del ensayo Xpert Xpress SARS-CoV-2 son dos genes, el gen E (Específico de Sarbeco) y gen N2 (específico de SARS-CoV-2), la entrada en los cartuchos requiere 300 μl de muestra en medio de transporte de virus. La prueba Xpert Xpress SARS-CoV-2 proporciona resultados basados en la detección de dos dianas génicas, según los algoritmos mostrados en el Cuadro 1. El resultado se interpreta como positivo cuando la señal del SARS-CoV-2 para la diana de ácido nucleico N2 o para las dos dianas de ácidos nucleicos (N2 y E) tiene un valor de Ct dentro del intervalo válido y un punto extremo superior al valor mínimo establecido.
Análisis de datos
Los datos se registraron en una planilla electrónica Microsoft EXCEL, posteriormente fueron analizadas con EPIINFO 2007 utilizando estadística descriptiva y analítica. Los resultados se expresan en forma de proporciones para las variables cualitativas y como media y desviación estándar para las variables continuas. Para establecer asociaciones entre las variables, se elaboraron tablas de contingencia y la prueba del chi cuadrado para las variables cualitativas y para comparar dos medias la prueba t y más de dos ANOVA una vía, Para establecer si los factores de riesgo de gravedad se asociaron en forma independiente con óbito aquellos que fueron significativos en el análisis bivariado fueron analizados por regresión logística. En todos los casos a un nivel de significancia de 0,05.
RESULTADOS
Se estudiaron 517 pacientes entre 16 a 98 años de edad (media ± DE: 51,5±17,5), 268 varones (51,8%), 36,6% tenía más de 60 años de edad, 69,8% estuvieron hospitalizados, internados en sala (57,1%), y admitidos en cuidados intensivos (12,8%). Los datos sobre co-morbilidad estuvieron disponibles en 278 hospitalizados, de ellos 220 tuvieron al menos una enfermedad de base, la HTA fue la más frecuentes seguida de obesidad y diabetes mellitus. La mortalidad fue de 22,2%, de los 295 que estuvieron internados en sala 89 (30,2%) fallecieron y en UTI 26/66 (39,4%). Los datos sobre días de enfermedad estuvieron disponibles para 304 pacientes hospitalizados, la media ± DE fue de 8,48 ± 4,2 días. Los valores promedios de Ct para el gen E fue de 25,3 ±6,0 y para el gen N2 de 27,3 ±6,1. El 43,9% de los pacientes tenía valores de Ct ≤ 25 para el gen E y 32,7% para el gen N2. Tabla 1
Tabla 1: Características de los pacientes con COVID-19 hospitalizados y ambulatorios en el Hospital Nacional. n=517
| Características | Media ±DE (rango) | Frecuencia | Porcentaje |
| Sexo | |||
| Masculino | 268 | 51,8 | |
| Femenino | 249 | 48,2 | |
| Edad (media ±DE) | 51,5±17,5 | ||
| >60 | 188 | 36,6 | |
| ≤60 | 325 | 63,4 | |
| Días de enfermedad* (n=304) | 8,48 ± 4,2 (0-30) | ||
| Comorbilidad (n=278)** | 220 | 79,1 | |
| HTA | 77 | 21,7 | |
| Obesidad | 36 | 10,2 | |
| DM | 29 | 8,2 | |
| Fumador | 14 | 4,0 | |
| EPOC | 9 | 2,5 | |
| Cardiopatía crónica | 8 | 2,3 | |
| Hospitalizados | 361 | 69,8 | |
| Sala | 295 | 57,1 | |
| UCI | 66 | 12,8 | |
| Ambulatorio | 156 | 30,2 | |
| Óbito | 115 | 22,2 | |
| Ct gen E | 25,3 ±6,0 (0-42,7) | ||
| Ct gen N2 | 27,3 ±6,1 (0-41,1) | ||
| Ct gen E <25 | 227 | 43,9 | |
| Ct gen N2 <25 | 169 | 32,7 |
*Días desde inicio de síntomas hasta hospitalización. **Las comorbilidades corresponden solo a hospitalizados
En la Tabla 2, Figura 1 y 2 se muestran las comparaciones de los valores promedios de Ct para los genes E y N2 según lugar de hospitalización y óbito. Se encontró que los pacientes hospitalizados presentaron significativamente menor promedio de Ct para ambos genes que aquellos pacientes no hospitalizados. Al comparar los valores promedios de Ct para el gen E y N2 entre fallecidos y no, la diferencia fue significativa para el gen N2 pero no para el E (Tabla 2 y Figura 2).
Tabla 2: Comparación de los valores promedios de Ct según lugar de hospitalización de los pacientes con covid-19 en el Hospital Nacional. n=517
| Ct | n | Media | Desviación típica | IC95% | Mínimo | Máximo | Valor p | |
|---|---|---|---|---|---|---|---|---|
| Gen E | ||||||||
| UTI | 66 | 23,8 | 6,7 | 22,1 | 25,4 | 0 | 36,8 | 0,00006 |
| Sala | 295 | 24,7 | 5,8 | 24,0 | 25,4 | 0 | 42,7 | |
| Ambulatorio | 156 | 26,9 | 5,7 | 26,0 | 27,9 | 11,7 | 37,4 | |
| Gen N2 | ||||||||
| UTI | 66 | 26,6 | 5,6 | 25,2 | 28,0 | 14,4 | 38,9 | 0,001 |
| Sala | 295 | 26,6 | 6,0 | 25,9 | 27,3 | 0,0 | 38,9 | |
| Ambulatorio | 156 | 28,8 | 6,3 | 27,8 | 29,8 | 0,0 | 41,1 | |
| Gen E | 0,074 | |||||||
| Fallecidos | 115 | 24,38 | 6,03 | 23,26 | 25,49 | 0 | 42,7 | |
| Vivos | 402 | 25,5 | 5,97 | 24,93 | 26,10 | 0 | 38,2 | |
| Gen N2 | 0,045 | |||||||
| Fallecidos | 115 | 26,8 | 6,5 | 25,08 | 27,48 | 0 | 38,9 | |
| Vivos | 402 | 27,58 | 6,0 | 26,99 | 28,1 | 0 | 41,1 | |
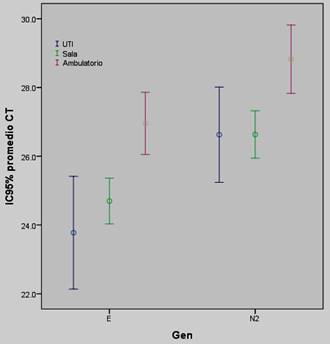
Figura 1: Comparación de los valores promedios de Ct de los genes E y N2 en los pacientes con COVID-19 según necesidad de hospitalización. Diferencia significativa en los valores promedios de Ct entre hospitalizados y ambulatorios, no hubo diferencia entre los internados en sala y UTI.
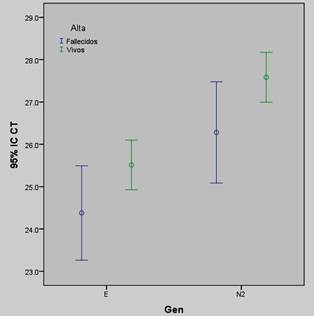
Figura 2: Comparación de los valores promedios de tde los genes E y N2 en los pacientes con COVID-19 según condición al alta. Diferencia significativa en los valores promedios de Ct del gen N2 pero no del gen E entre fallecidos y vivos.
En la Tabla 3 se muestra la asociación entre los valores de Ct y hospitalización. Se encontró mayor riesgo de hospitalizarse para los pacientes con los valores de Ct menor a 25 tanto el gen E (OR: 2,40; IC95%: 1,61- 3,59) como para el gen N2 (OR: 2,14; IC95%: 1,39-3,31).
Tabla 3: Asociación entre valores de Ct y hospitalización de los pacientes con covid-19 hospitalizados y ambulatorios en el Hospital Nacional. n=517
| Ct | Total | Hospitalizado | Ambulatorio | Valor p | OR (IC95%) |
|---|---|---|---|---|---|
| Gen E | |||||
| <25 | 227 | 181 (79,7%) | 46 (20,3%) | <0,001 | 2,40 (1,61- 3,59) |
| ≥25 | 290 | 180 (62,1%) | 110 (37,9%) | ||
| Gen N2 | |||||
| <25 | 169 | 135 (79,9%) | 34 (20,1%) | 0,001 | 2,14 (1,39-3,31) |
| ≥25 | 348 | 226 (64,9%) | 122 (35,1%) |
No se encontró asociación entre los valores de Ct < 25 e ingresar a UCI entre los hospitalizados. Tabla 4
Tabla 4: Asociación entre valores de Ct y lugar de hospitalización de los pacientes con covid-19 hospitalizados y ambulatorios en el Hospital Nacional. n=361
| Ct | Total | UCI (n=66) | Sala (n=295) | Valor p |
|---|---|---|---|---|
| Gen E | 0,06 | |||
| <25 | 181 | 40 (22,1%) | 141 (77,9%) | |
| ≥25 | 180 | 26 (14,4%) | 154 (85,6%) | |
| Gen N2 | 0,224 | |||
| <25 | 135 | 29 (21,5%) | 106 (62,7%) | |
| ≥25 | 226 | 37 (16,4%) | 189 (54,3%) |
En la Tabla 5 se muestra la asociación entre los factores de riesgo de gravedad con óbito. Se encontró mayor riesgo de fallecer para los pacientes con los valores de Ct menor a 25 tanto el gen E (OR: 1.61; IC95%: 1,06-2,44) como para el gen N2 (OR: 1.83; IC95%: 1,19-2,80). Los pacientes mayores de 60 años tuvieron significativamente mayor riesgo de fallecer que los de 60 años y menores (OR: 3,69; 2,39-5,68). Estos dos factores se mantuvieron asociados con el óbito en el análisis multivariado (Tabla 6). Los otros factores como sexo masculino, gravedad de ingreso de OMS, presencia de comorbilidad, tiempo de enfermedad menor a 7 días no se asociaron significativamente al óbito.
Tabla 5: Asociación entre factores de riesgo y óbito de los pacientes con covid-19 hospitalizados y ambulatorios en el Hospital Nacional. n=517
| Factores de riesgo | Óbito | sobrevida | Total | Valor p | OR (IC95%) |
|---|---|---|---|---|---|
| Sexo | 0,118 | 1,39 (0,918-2,12) | |||
| M | 67 (25%) | 201 (80,7%) | 268 | ||
| F | 48 (19,3%) | 201 (75%) | 249 | ||
| Gravedad ingreso OMS* | Fallecidos | 0,128 | NS | ||
| 3 | 3 (15,8%) | 16 (84,2%) | 19 | ||
| 4 | 69 (35,0%) | 128 (65%) | 197 | ||
| 5 | 14 (46,7%) | 16 (53,3%) | 30 | ||
| 6 | 7 (46,7%) | 8 (53,3%) | 15 | ||
| Edad | <0,0001 | 3,69 (2,39-5,68) | |||
| >60 | 70 (37,2%) | 118 (62,8%) | 188 | ||
| ≤60 | 45 (24,9%) | 280 (86,2%) | 325 | ||
| Comorbilidad* | 0,170 | 1,61 (0,85-3,04) | |||
| Presencia | 82 (37,4%) | 138 (62,7%) | 220 | ||
| Ausencia | 16 (27,1%) | 42 (72,4%) | 58 | ||
| Días de enfermedad* | |||||
| ≤7 | 54 (41,2%) | 77 (58,8%) | 131 | 0,06 | 1,57 (0,98-2,53) |
| >7 | 53 (30,8%) | 119 (69,2%) | 172 | ||
| Gen E | 0,025 | ||||
| <25 | 61 (26.9%) | 190 (83.7%) | 227 | 1.61 (1.06-2.44) | |
| ≥25 | 54 (18.6%) | 253 (87.2%) | 290 | ||
| Gen N2 | 0,005 | 1.83 (1.19-2.80) | |||
| <25 | 50 (29.6%) | 119 (70.4%) | 169 | ||
| ≥25 | 65 (18.7%) | 283 (81.3%) | 348 |
*Se tuvo datos solo para los hospitalizados
Tabla 6: Análisis multivariado por regresión logística de los factores de riesgo y óbito pacientes con COVID-19 hospitalizados y ambulatorios en el Hospital Nacional. n=517
| Variables en la ecuación | Valor p | OR | I.C. 95% OR | |
|---|---|---|---|---|
| Inferior | Superior | |||
| Ct N2 <25 | 0,002 | 2,041 | 1,303 | 3,197 |
| Edad ≥ 60 | 0,000 | 3,835 | 2,473 | 5,947 |
DISCUSIÓN
En el presente estudio se ha comparado los valores del Ct entre pacientes hospitalizados y ambulatorios, además de los pacientes que fallecieron y sobrevivieron. Se ha encontrado asociación entre los valores de Ct y la hospitalización, observándose significativamente que los pacientes con Ct menor a 25 tenían mayores probabilidades de sufrir desenlaces adversos comparados con los pacientes que no fueron hospitalizados o sobrevivieron. Existen varios estudios que han tratado de establecer la relación entre el número de ciclos (Ct) en las pruebas RT-qPCR positivas y la gravedad de la infección de manera a que pueda ayudar en la toma de decisiones cuando se interpretan en el contexto clínico de los pacientes23,28-32. Así en un estudio retrospectivo realizado en Nueva York se mostró la relación entre el valor del Ct y la mortalidad o la necesidad de intubación, asociándose de forma independiente el valor Ct <25 (en comparación con Ct >30) tanto con la mortalidad intrahospitalaria [ORajustado = 6,05 (IC 95%: 2,92-12,52)] como con la necesidad de intubación [ORajustado = 2,73 (1,68-4,44)28.
Una revisión sistemática evaluó el conocimiento disponible sobre las correlaciones entre los valores de Ct del SARS-COV-2 y los resultados relacionados con el paciente o la atención médica para determinar si los valores de Ct proporcionan información clínica útil29. En esta revisión se incluyeron estudios que informaron sobre la presencia o ausencia de una asociación entre los valores de Ct o las cargas virales determinadas mediante el valor de Ct y los resultados clínicos. Los autores llegaron a la conclusión en base al análisis de 18 estudios que existen evidencias que apoyan que la carga viral medida por los valores de Ct podría pronosticar la gravedad de la infección y ser útil en la predicción clínica.
En China, Huang et al30 encontraron en 308 pacientes adultos hospitalizados que los valores medios de Ct fueron menores en pacientes que murieron en comparación con los que se recuperaron o que todavía estaban hospitalizados al final del estudio (recuperado: mediana 37,43 [rango intercuartílico: 34,94-38,67]; todavía hospitalizados: mediana 36,97 [34,33-38,70]; fallecido: mediana 34,79 [24,46-37,65]; p< 0.001). Por su lado Yu et al encontraron una asociación positiva entre la carga viral del esputo y la gravedad de la enfermedad, así como el riesgo de progresión en 92 pacientes. Los pacientes con una carga viral basal más alta tuvieron más probabilidad de desarrollar una enfermedad más grave. Según los autores este hallazgo justificaría el concepto del tratamiento antiviral temprano, que, si es efectivo, reduciría el riesgo de progresión y por tanto la mortalidad, que se ha demostrado en la influenza31.
Zheng et al informaron que la mediana de duración del virus en las muestras respiratorias de pacientes con enfermedad grave (21 días, 14-30 días) fue significativamente más prolongada que en pacientes con enfermedad leve (14 días, 10-21 días; P = 0,04). En el grupo leve, la carga viral alcanzó su punto máximo en las muestras respiratorias en la segunda semana desde el inicio de la enfermedad, mientras que la carga viral continuó siendo alta durante la tercera semana en el grupo grave. La duración del virus fue mayor en pacientes mayores de 60 años y en pacientes varones32.
Otro estudio realizado en China encontró que las cargas virales en casos severos eran hasta 60 veces mayores que en los casos leves23. Los valores de Ct en los casos graves se mantuvieron significativamente más bajo durante los primeros 12 días después del inicio de la enfermedad que los correspondientes casos leves. Los casos leves tuvieron un aclaramiento viral temprano, el 90% de ellos pacientes dieron repetidamente prueba negativa en RT-PCR en el día 10, por el contrario, todos los casos graves siguieron positivos en o después del día 10.
Los otros factores de riesgo de gravedad como la edad de más de 60 años tuvieron significativamente mayor riesgo de fallecer que los de 60 años y menores (OR: 3,69; 2,39-5,68). Este hallazgo ha sido mencionado en varios estudios. Los dos factores de riesgo que se mantuvieron asociados con el óbito en el análisis multivariado fueron los valores de Ct menor a 25 tanto para el gen E (OR: 1.61; IC95%: 1,06-2,44) como para el gen N2 (OR: 1.83; IC95%: 1,19-2,80) y la edad de más de 60 años (OR: 3,69; 2,39-5,68). Los otros factores como sexo masculino, gravedad de ingreso de OMS, presencia de comorbilidad, tiempo de enfermedad menor a 7 días no se asociaron significativamente al óbito. A pesar de que el sexo masculino y la comorbilidad han sido asociados a gravedad en varios trabajos, en este estudio no se han relacionado con óbito11-14.
Existen algunas limitaciones al interpretar el valor Ct, como serían el no expresarse con unos valores lineales, la dependencia del resultado con el tipo y calidad de la toma, así como con el manejo de la muestra, o variaciones significativas inter- e intraprueba33. A todo ello hay que añadir que la máxima carga viral, alcanzada antes de manifestarse los síntomas, se mantiene hasta el tercer-quinto día tras la aparición de los mismos para, posteriormente, ir decayendo hasta hacerse indetectable (la duración media de la replicación viral suele ser de 17 días [IC95%:15,5-18,6)34,35, la existencia de un ciclo circadiano de la carga viral36) o la mayor duración de la infección en las nuevas variantes del SARS-CoV-2 (como la B.1.1.7)37. Por otra parte, el valor Ct no se debe utilizar en la cuantificación de la carga viral38, y la identificación de las dianas moleculares no implica la viabilidad del virus ni, por lo tanto, su contagiosidad39, por lo que la interpretación del valor Ct hay que tomarlo con precaución y siempre en el contexto clínico del paciente.
A pesar de las limitaciones mencionadas, los valores de Ct pueden estar asociados con peores resultados y los valores de Ct pueden ser útiles para predecir el curso clínico y el pronóstico de los pacientes con COVID-19; sin embargo, se necesitan más estudios para confirmar el valor clínico. Conocer el número indicativo del valor Ct, junto a su validación por el laboratorio responsable, mejorará la toma de decisiones con mayores garantías tanto en la predicción clínica como en la incorporación del paciente a sus actividades sociales.