INTRODUCCIÓN
La hipertensión arterial (HTA) constituye en la actualidad uno de los capítulos más interesantes en la patología cardiovascular por dos importantes aspectos: la morbilidad y mortalidad a que conducen sus consecuencias y complicaciones1. En el Paraguay es un serio problema de salud pública2.
El Losartán potásico es una droga de segunda elección en el tratamiento de la HTA para los pacientes en los cuales se requiere actuar sobre el eje renina-angiotensina-aldosterona, utilizados en pacientes intolerantes al Enalapril3.
El Losartán es un antagonista de los receptores de la angiotensina II (tipo AT1) sintético.
La calidad de los productos farmacéuticos es verificada en cada etapa del proceso productivo, a fin de garantizar que el efecto farmacológico del producto terminado sea eficaz4.
La fuerte batalla comercial entre medicamentos innovadores y multifuentes, que ha existido desde hace ya varias décadas en el mercado farmacéutico nacional, ha creado un ambiente de incertidumbre entre médicos y pacientes, que se cuestionan su calidad e intercambiabilidad5.
La evaluación de la disolución tiene aproximadamente un siglo de desarrollo. Sin embargo, en las últimas décadas ha suscitado mayor interés, especialmente por su aplicación al estudio de productos medicamentosos sólidos, relacionando este proceso con la caracterización de la calidad y biodisponibilidad de fármacos en el organismo, ya que a excepción de algunos casos, todo principio activo debe disolverse para poder absorberse6,7. Actualmente se usa además, con ciertas modificaciones, como subrogado de una prueba de equivalencia terapéutica para ciertas categorías de productos farmacéuticos de administración oral provenientes de múltiples fuentes de fabricación7.
Una alternativa que permite ofrecer elementos de juicio válidos para abordar este problema con datos experimentales consiste en desarrollar estudios biofarmacéuticos in vitro, cuya aplicación reúne evidencia importante sobre la calidad de los medicamentos con una mínima inversión.
La Food and Drug Administration (FDA) fue la primera administración sanitaria que regulo y obligo a la realización de estudios de bioequivalencia. Dichos documentos describen en qué situación son necesarios los estudios de biodisponibilidad y bioequivalencia, así como lo requerimientos en cuanto a diseño, realización y evaluación de los mismos.
No se cuentan en Paraguay, con estudios de perfiles de disolución de especialidades farmacéuticas de producción nacional e importados conteniendo Losartán potásico como principio activo, por lo cual, los resultados de estos estudios, serán beneficiosos para los pacientes debido a la intercambiabilidad de las diversas especialidades farmacéuticas analizadas en cuanto a la calidad y porcentaje de liberación del principio activo, y sobre todo, el acceso a un tratamiento más accesible sobre todo a la población de escasos recursos.
Con el fin de determinar el nivel de cumplimiento de calidad de Losartán de 100mg comprimidos, en este trabajo se describen los parámetros de conformidad oficiales de la Farmacopea americana-USP 388 y no oficiales, como el perfil de disolución5,8, comparando la calidad de los resultados de los comprimidos y los precios que diferencian a cada producto analizado, tanto de origen nacional como importados.
MATERIALES Y MÉTODOS
Materiales
Se analizaron productos de Losartán potásico de 100mg comprimidos, de producción nacional e importados, con registro sanitario vigentes en el 2017, comercializados en Paraguay.
Las muestras fueron codificadas tanto para los de producción nacional como importada, de la siguiente manera: PM, RM, CV, CM, SM, ML, MH y MA.
Los ensayos fueron realizados siguiendo los métodos de la Farmacopea de los Estados Unidos (USP 38)8.
Para el análisis realizado se utilizó un estándar secundario de Losartán potásico Lote BLTP 1405383, acetonitrilo (grado HPLC), agua para HPLC y fosfato monobásico de sodio (J.T. Baker).
Método
El sistema cromatográfico para la identificación y cuantificación de Losartán potásico, consiste en un HPLC Waters® con detector PDA 2998 con auto inyector, usando una columna Phenomenex Luna 5µ C8 100A (250 mm x 4,60 mm), elución a gradiente (de solución A: solución B (80:20) - tiempo 0; de solución A: solución B (40:60) - tiempo 11; a solución A: solución B (80:20) - tiempo 15 ) con fase móvil correspondiente a una solución A (mezcla de buffer fosfato de pH 7,0 ± 0,5-acetonitrilo (85:15)) y solución B (acetonitrilo). El flujo de 1 mL/min, una inyección de 10 µL, tiempo de retención de 5 min. La detección PDA fue a 250 nm y la temperatura de la columna a 30°C.
Preparación de la solución estándar: se pesó una cantidad aproximada de 25 mg del estándar y se disolvió con la solución A, hasta obtener una solución de concentración de 0,25 mg/mL.
Preparación de la solución muestra: se pesó 20 comprimidos al azar de los productos de producción nacional e importada por separado, se determinó el peso promedio y el coeficiente de variación de cada producto. Se pulverizó y se tomó una porción de polvo equivalente a 25mg de Losartán potásico que fue transferido a un matraz volumétrico de 10 mL. Se disolvió con la solución A y se sónico por 30 minutos, se diluyo a volumen y mezclo. Filtrar, tomar 1mL de la solución filtrada y transferir a un matraz aforado de 10mL, llevando a volumen con la solución A. Filtrar una porción por filtro de membrana de 0,45 µm (Millex LCR, membrana de PTFE modificada o similar).
Perfiles de disolución
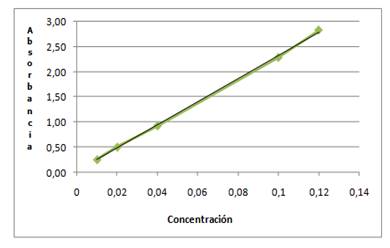
Curva de calibración: Se preparan concentraciones de Losartán potásico entre 0,12 mg/mL; 0,1 mg/mL; 0,04 mg/mL; 0,02 mg/mL y 0,01 mg/mL. Los estándares fueron preparados por duplicado y la determinación a una absorbancia de 256 nm.
La ecuación de la recta es estimada usando el análisis de la regresión lineal (y=ax+b) y el coeficiente de correlación.
Se evaluaron comprimidos de Losartán de 100 mg de cada marca comercial de producción nacional e importados, utilizando un equipo Erweka® DT 700 para 8 vasos, aparato 2 a 50 rpm, un volumen de 900 mL de agua destilada (a 37ºC±0,5ºC) como medio de disolución. Las muestras fueron tomadas a los 5, 10, 20, 30 y 40 minutos. Determinando la cantidad disuelta de Losartán potásico en cada tiempo (previa filtración), a una longitud de onda de 256 nm por espectrofotometría UV-V de la marca Agilent®
El procesamiento estadístico de la información se realizó utilizando planilla electrónica Microsoft® Office Excel, mediante la obtención de valores medios y coeficientes de variación de los datos obtenidos.
RESULTADOS Y DISCUSIÓN
Fueron incluidas en esta investigación todas las marcas comerciales (3 importados y 5 de producción nacional) de Losartan potásico 100mg comprimidos con registro sanitario vigente en el momento del estudio.
Los tiempos de desintegración obtenidos no superaron los 14 minutos en todas las marcas comerciales de Losartán analizadas, cumpliendo el criterio establecido por la USP8 para tabletas no recubiertas (< 30 minutos).
La determinación del porcentaje de humedad en los diferentes productos fue más bien informativa, en caso de verificarse algún tipo de desvío de calidad apreciable.
Los 8 productos analizados de Losartán potásico de 100mg comprimidos, dieron como resultados de cuantificación valores entre 98,0% y 104,0%, encontrándose todos dentro de los parámetros de cuantificación establecidos por la Farmacopea de los Estados Unidos (entre 95,0% y 105,0% de Losartán potásico) y el ensayo de disolución (no menos del 75% (Q) de la cantidad declarada disuelta a los 30 minutos). (Tabla 1).
En cuanto al precio de las marcas comerciales de producción nacional versus importados, esta última presenta costos que se encuentran entre 22 y 24 dólares, encontrándose una variación de precios de marcas nacionales e importadas, de 6 a 7 dólares, como se puede apreciar en la Tabla 1.
| ENSAYOS | ESPECIFICACIONES | PM | RM | CV | CM | SM | ML | MH | MA |
|---|---|---|---|---|---|---|---|---|---|
| Desintegración | No más de 30 minutos | 7m | 6m 49s | 9m 4s | 13m 8s | 7m 40s | 10m | 8m | 10m |
| Humedad | - | 4,2% | 2,9% | 3,8% | 4,2% | 3,2% | 4,6% | 3,8% | 3,5% |
| Valoración | No menos de 95,0% y no más de 105,0% de la cantidad declarada de losartan potásico | 104,0% | 98,7% | 100,0% | 98,3% | 104,0% | 99,7% | 101,4% | 102,9% |
| Ensayo de disolución | No menos de 75% (Q) de la cantidad declarada de losartan potásico | 105,7% | 101,5% | 103,0% | 103,4% | 99,8% | 97,0% | 95,0% | 97,0% |
| EF (%) | - | 82,1 | 81,3 | 71,2 | 71,3 | 68,2 | 69,3 | 80 | 68,7 |
| Precio (dólares) | - | 16,5 | 16 | 23,5 | 22,5 | 22 | 16 | 15,7 | 15 |
EF (%): Eficiencia de disolución
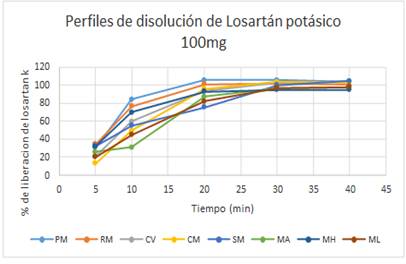
A diferencia del ensayo de disolución, el perfil de disolución se construye a partir de la liberación del principio activo a diferentes tiempos a lo largo del ensayo, utilizando el medio de disolución propuesto por la USP 388.
Para la curva de calibración del Losartán potásico, se obtiene una ecuación de la recta de y= 22,987x + 0,0255, con un coeficiente de correlación de 0,9992.
A partir de los 20 minutos, el porcentaje de liberación de Losartán potásico alcanza más del 70% en todos los productos ensayados (Figura 2).
El análisis estadístico de los resultados, demuestra que entre las marcas comerciales PM, RM, CV, CM, SM, ML, MH y MA, tanto de producción nacional como importadas, no existen diferencias significativas realizando un análisis de varianza (ANOVA) en el comportamiento de los perfiles de disolución (p= 0,94; se consideró una diferencia estadísticamente significativa si p ≤ 0,05). La eficiencia de disolución (EF) resulto ser mayor para el producto PM=82,1 (producción nacional) y menor para el producto SM=68,2 (importado) (Tabla 1).
El losartán corresponde a la clase III del Sistema de Clasificación Biofarmacéutica (alta solubilidad, baja permeabilidad)9,10). De acuerdo con las directrices originales propuestas por Amidon et al11, los fármacos de esta categoría pueden optar a la bioexención (exención de estudios de bioequivalencia), si muestran velocidades de disolución in vitro muy rápidas (85% en 15 minutos). Pero esta consideración aún es objeto de debate, por las múltiples variables que intervienen en el proceso de absorción, por lo que se propone que estas marcas comerciales de producción nacional e importada, sean objetos de estudios biofarmaceuticos utilizando los medios biorrelevantes de disolución propuestos por la Organización Mundial de la Salud (OMS)12 y la FDA13 y compararlos con el producto de referencia.
Por otro lado, cabe señalar que existe una marcada variación en el precio entre las diferentes marcas comercializadas de producción nacional y las importadas, esta variación no demuestra una diferencia en la calidad de las mismas, como así tampoco, se encuentra discrepancia en el porcentaje de liberación del principio activo en los perfiles de disolución, según los ensayos realizados de los productos en estudio, pero es interesante como elemento de juicio para tomar la decisión de compra y optar por uno u otro.
CONCLUSIÓN
Fueron analizadas cinco especialidades farmacéuticas de producción nacional con registro sanitario vigentes en el 2017, además de 3 especialidades farmacéuticas importadas, cumpliendo todas con los parámetros de calidad establecidos por la farmacopea, además de la notable similitud encontrada en los perfiles de disolución en todas las marcas comerciales según el análisis estadístico realizado y teniendo también en cuenta que la mayor eficiencia de disolución (EF) se obtuvo con un producto de producción nacional (PM) con respecto al importado.
Además, comparando el precio de los productos estudiados, se encontró una variación de 6 a 7 dólares en el costo entre los productos nacionales e importados, presentando un mayor costo, aquellos productos importados.