INTRODUCCIÓN
El mejor conocimiento de la fisiopatología y del manejo diagnóstico y terapéutico del síndrome coronario agudo (SCA) ha producido una impresionante evolución en el entendimiento de los mecanismos de reperfusión coronaria. Los cambios constantes en la metodología de reperfusión estimulan a tener un conocimiento detallado de los hallazgos recientes para realizar un mejor y adecuado manejo terapéutico en la práctica clínica contemporánea (1-5.
Una respuesta inflamatoria sistémica a menudo acompaña al SCA, y la documentación de esta inflamación ha sido ampliamente reconocida como un indicador de eventos coronarios a repetición (6-9. La evidencia basada en la medicina sugiere fuertemente la importancia de la etiología inflamatoria en el SCA. Los factores tradicionales de riesgo coronario terminan en un pasaje final común que desarrolla un proceso inflamatorio en la pared arterial (10-12. Los hallazgos recientes indican que los primeros pasos en la aterosclerosis son esencialmente inflamatorios. La presencia de macrófagos, linfocitos T, células dendríticas, y los mastocitos en las lesiones ateroscleróticas, además de los hallazgos de la secreción de varias citoquinas apuntan hacia un comprometimiento de mecanismos inmuno-inflamatorios en la patogénesis de la aterosclerosis (13-16. Los infartos microscópicos y multifocales asociados a microembolia plaquetaria han sido observados en el SCA y se describen como mecanismo de elevación de las troponinas en estos pacientes. Se ha descrito, además, una elevación sérica de varios marcadores de inflamación que fueron predictores de eventos adversos en pacientes con SCA17-20.
La relación existente entre los factores intrínsecos a la placa ateromatosa y los eventos extrínsecos que conducen a la trombosis coronaria no están claramente comprendidos. A pesar de que el desarrollo de la aterosclerosis es claramente multifactorial, se reconoce plenamente que la inflamación dentro de las lesiones contribuye de manera significativa al inicio, mantenimiento y progresión de la aterosclerosis. Estudios observacionales histopatológicos e inmuno-citoquímicos sugieren que los procesos inflamatorios activos pueden desestabilizar el tejido fibroso de la capa del ateroma desencadenando una ruptura de la placa ateromatosa aumentando así el riesgo de trombosis coronaria (21-28. Se ha demostrado una constante asociación entre las manifestaciones clínicas de la enfermedad aterosclerótica y los marcadores sistémicos de inflamación en estudios epidemiológicos prospectivos. Se denominan placas vulnerables a aquellas placas ateromatosas que tienen un alto riesgo de ruptura y trombosis. Varios estudios realizados han investigado estas placas vulnerables para conocerlas mejor y poder determinar y predecir cuales están en riesgo de trombosis y comprender los mecanismos que conducen a su formación (21-23. El síndrome coronario agudo conlleva a una importante carga de gastos de salud pública, por lo cual es importante conocer la prevalencia, epidemiología, fisiopatología y el manejo diagnóstico y terapéutico adecuado del SCA. Por lo tanto, es la intención de esta revisión analizar estos puntos necesarios para un mejor entendimiento y un mejor manejo diagnóstico y terapéutico de esta frecuente entidad nosológica.
Epidemiología e historia natural del síndrome coronario agudo
Las enfermedades cardiovasculares actualmente son la principal causa de mortalidad y entre ellas la enfermedad arterial coronaria es la manifestación más prevalente. Las enfermedades cardiovasculares constituyen uno de los problemas de salud más importantes de la medicina contemporánea, de ahí que sea un verdadero reto científico por su trascendencia biológica, psicológica, social y económica. Más de siete millones de personas mueren cada año como consecuencia de la cardiopatía isquémica, lo que corresponde a un 12,8% de todas las muertes. Este fenómeno seguirá en ascenso en los próximos años, de manera que para el 2020 se pronostican aproximadamente 20,5 millones de muertes anuales y 24,2 millones para el 2030. Además, se estima que uno de cada seis varones y una de cada siete mujeres en Europa mueren de infarto agudo de miocardio (IAM)29-31.
La identificación de los pacientes que tienen SCA dentro de la gran proporción de pacientes con sospecha de dolor cardiaco supone un reto diagnóstico, sobre todo en los casos en que no hay síntomas claros o hallazgos electrocardiográficos. A pesar de los tratamientos modernos, las tasas de muerte, infarto de miocardio y readmisiones de los pacientes con SCA siguen siendo altas. Está bien establecido que los pacientes con SCA en sus diferentes presentaciones clínicas comparten un sustrato fisiopatológico común. Las observaciones patológicas, angioscópicas y biológicas han demostrado que la rotura o la erosión de la placa aterosclerótica, con los distintos grados de complicaciones trombóticas y embolización distal que dan lugar a una hipoperfusión miocárdica, son el mecanismo fisiopatológico básico de la mayoría de los SCA. Como se trata de un estado de la enfermedad aterotrombótica que pone en riesgo la vida del paciente, se han desarrollado criterios para la estratificación del riesgo que permitan al clínico tomar las decisiones oportunas sobre el manejo farmacológico y sobre las estrategias de revascularización miocárdicas de manera individualizada para cada paciente.
Los datos de los registros coinciden en demostrar que el síndrome coronario agudo sin elevación del segmento ST (SCASEST) es más frecuente que el síndrome coronario agudo con elevación del segmento ST (SCACEST). La incidencia anual es de ~3/1.000 habitantes, pero esta cifra varía entre países. La mortalidad hospitalaria es más elevada en pacientes con SCACEST que entre los SCASEST (7 frente a un 3-5%, respectivamente), pero a los 6 meses las tasas de mortalidad son muy similares en las dos condiciones (el 12 y el 13%). El seguimiento a largo plazo ha demostrado que la tasa de muerte es 2 veces superior a los 4 años entre los pacientes con SCASEST que en los que tienen SCACEST. Esta diferencia en la evolución a medio y largo plazo puede deberse a diferencias en los perfiles de los pacientes, ya que los pacientes con SCASEST tienden a ser de más edad, con más comorbilidades, especialmente diabetes mellitus e insuficiencia renal29. En la Figura 1 observamos la incidencia de infarto de miocardio e injuria miocárdica estratificada por edad en hospitales consecutivos no seleccionados en pacientes con necrosis miocárdica.
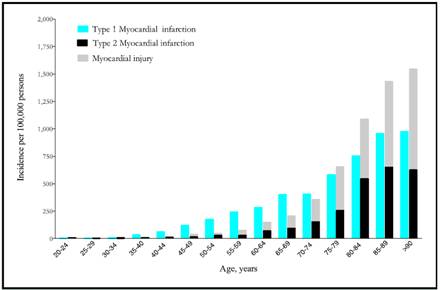
Figura 1: La incidencia de infarto de miocardio e injuria miocárdica estratificada por edad en hospitales consecutivos no seleccionados en pacientes con necrosis miocárdica. Reimpreso con permiso de Shah AS, McAllister DA, Mills R, et al. Sensitive troponin assay and the classification of myocardial infarction. Am J Med 2015;128:493-501.64
Datos de la Organización Mundial de la Salud indican que la principal causa de muerte en Latinoamérica es la enfermedad cardiovascular y que está en curso una epidemia de grandes proporciones, lo que se puede atribuir a cambios demográficos y de hábitos de vida inherentes a la transición epidemiológica. El incremento en la expectativa de vida trae como consecuencia periodos de exposición a factores de riesgo más largos, lo que resulta en mayor probabilidad de eventos adversos. Latinoamérica es una de las regiones del mundo con más alta carga de factores de riesgo cardiovascular, especialmente sobrepeso, dislipidemia y diabetes mellitus (30.
En un estudio realizado con 507 pacientes con SCA se observaron los siguientes hallazgos. Un promedio de edad de 65±11 años, el 54% tenía más de 65 años, el 56% era de sexo masculino y el 44% tenía al menos tres factores de riesgo coronario. El tipo de síndrome coronario fue de angina inestable en un 52% e infarto de miocardio sin elevación del segmento ST en un 48%30-32. Por otro lado, al estudiar las presentaciones del SCA hubo predominio de infarto agudo de miocardio con elevación del segmento ST. Además, hubo una asociación significativa entre la hipertensión arterial sistémica con la angina inestable y los altos valores de lipoproteína de baja densidad con infarto, sin influencia de ninguna característica socio-demográfica. Se llego a la conclusión que la hipertensión arterial y los niveles de lipoproteína de baja densidad elevados se asociaron a diferentes presentaciones del síndrome coronario (31.
Un registro de infarto agudo de miocardio con elevación del segmento ST (IAMCEST) menciona una incidencia de esta enfermedad de 66 casos por cada 100 000 habitantes al año 26. Se han recogido datos similares en República Checa, Bélgica y Estados Unidos30-37. En los Estados Unidos de América, las tasas de incidencia de IAMCEST disminuyeron entre 1997 y 2005, de 121 a 77 por 100.000 habitantes, mientras que las tasas de incidencia de Infarto Agudo del Miocardio Sin Elevación del Segmento ST (IAMSEST) aumentaron ligeramente de 126 a 132 casos. En España, a pesar de la tendencia decreciente de la mortalidad por cardiopatía isquémica en los últimos 25 años, continúa siendo la primera causa de muerte en varones y la segunda en mujeres, lo que constituye un 12% y 10 % de la mortalidad total, respectivamente. El IAM causa la muerte de aproximadamente un 8% de la población chilena, y afecta principalmente a los hombres a partir de los 45 años y a las mujeres desde los 60 años (35. En Brasil, se considera que uno de cada tres muertes al año corresponde a IAM, siendo la principal causa de muerte en este país (31. En Cuba la tasa de defunción por enfermedades isquémicas del corazón en el 2014 fue de 142,5 por 100.000 habitantes y en la Habana, se observó en el 2014 una tasa de mortalidad por enfermedades del corazón de 121,5 por 100.000 habitantes (32.
En un enfoque epidemiológico español en donde se evaluó tendencias del SCA donde el número de casos de síndrome coronario agudo entre 2005 y 2049 tenderá a estabilizarse en la población de 25 a 74 años y aumentar significativamente en la población mayor de 74 años. Los casos de SCA aumentarán hasta el año 2049 debido al envejecimiento de la población, aunque parece estabilizarse en la población menor de 75 años, en cuanto a la letalidad del SCA se ha reducido en pacientes hospitalarios, pero la proporción de muertes súbitas se mantiene sin cambios34.
En un estudio con 1210 pacientes se llegó a la conclusión de que la implantación del código infarto conllevó un incremento de pacientes ingresados por SCA con elevación del segmento ST y mayor score de GRACE. Se redujo la estancia hospitalaria, se generalizó la angioplastia primaria y se redujo la mortalidad hospitalaria de los pacientes de alto riesgo pero el pronóstico tras el alta fue igual antes y posterior a la implantación del código infarto (35. De las observaciones epidemiológicas se ha aprendido que las estrategias terapéuticas para el SCASEST no solo deben dirigirse a la fase aguda, sino también al manejo a más largo plazo con la misma intensidad.
Fisiopatología y correlación clínica en el síndrome coronario agudo
El SCA es una manifestación de la aterosclerosis que pone en riesgo la vida. Normalmente se precipita por una trombosis aguda inducida por rotura o erosión de una placa coronaria aterosclerótica, con o sin vasoconstricción concomitante, lo que causa una reducción brusca y crítica del flujo sanguíneo coronario. En el complejo proceso de rotura de una placa, la inflamación ha resultado ser un elemento fisiopatológico clave. En casos raros, el SCA puede tener una etiología no aterosclerótica, como arteritis, traumatismo, disección, tromboembolia, anomalías congénitas, adicción a la cocaína o complicaciones de un cateterismo cardiaco. Hay que comprender el significado de los principales conceptos fisiopatológicos, como placa vulnerable, trombosis coronaria, paciente vulnerable, disfunción endotelial, atero-trombosis acelerada, mecanismos secundarios del SCASEST y daño miocárdico, para hacer un uso correcto de las estrategias terapéuticas disponibles38-41.
El proceso inflamatorio ejerce ciertos cambios en la placa ateromatosa que termina desarrollando una placa vulnerable. Se produce un adelgazamiento de la capa fibrosa de la placa, un aumento en el influjo de lípidos hacia el centro de la placa expandiendo el tamaño de la misma, y una estimulación aumentada de la neo-angiogénesis. Además, estos cambios promueven la formación de un núcleo necrótico en el centro de la placa, el cual a su vez puede empeorar el proceso inflamatorio. Este núcleo necrótico contiene células muertas principalmente macrófagos y detritus, y el aumento en volumen del mismo contribuye a la ruptura de la placa y el desencadenamiento del SCA. Por lo tanto, la placa vulnerable posee un núcleo central lipídico, una capa fibrosa delgada, un infiltrado de macrófagos, zonas de calcificación y neo-vascularización42-44. Las lesiones predictoras de SCA suelen ser leves desde el punto de vista angiográfico, y se caracterizan por una cápsula fina de fibro-ateroma, una gran carga de placa, un área luminal pequeña o combinaciones de estas características. Dependiendo del grado de obstrucción al flujo coronario se han distinguido varias presentaciones clínicas con una variedad de síntomas: 1) Dolor anginoso prolongado (> 20 min) en reposo. 2) Angina de novo, de nueva aparición, clase II o III de la clasificación de la sociedad cardiovascular canadiense. 3) Desestabilización reciente de una angina previamente estable con características de angina como mínimo de clase III (angina in crescendo). 4) Angina post-IAM. El dolor prolongado se observa en el 80% de los pacientes, mientras que la angina de novo o acelerada se observa solo en el 20% de los casos (45-48.
La presentación clínica típica de los SCASEST es la opresión retroesternal que irradia hacia el brazo izquierdo, el cuello o la mandíbula, y que puede ser intermitente (normalmente dura varios minutos) o persistente. Este tipo de dolencia puede ir acompañada de otros síntomas como diaforesis, náuseas, dolor abdominal, disnea y síncope. No obstante, son frecuentes las presentaciones atípicas como: dolor epigástrico, indigestión, dolor torácico punzante, dolor torácico con características pleuríticas o disnea creciente. Los síntomas atípicos se observan más frecuentemente en los pacientes de más edad (> 75 años), en mujeres y en pacientes con diabetes mellitus, insuficiencia renal crónica o demencia. La ausencia de dolor torácico puede conducir a subestimar la enfermedad y a un tratamiento insuficiente. Los retos diagnósticos y terapéuticos se presentan sobre todo cuando el ECG es normal o casi normal o, por el contrario, cuando el ECG es anormal ya en condiciones basales debido a la existencia de enfermedades subyacentes, como defectos de la conducción intraventricular, bloqueos de rama, o hipertrofia ventricular izquierda45,46.
El síntoma principal que pone en marcha la cascada diagnóstica y terapéutica es la aparición de dolor torácico, pero la clasificación de los pacientes se basa primordialmente en el electrocardiograma (ECG). Por lo tanto, existen varias presentaciones clínicas de la cardiopatía isquémica las cuales incluyen la isquemia silente, la angina de pecho estable, la angina inestable, el infarto de miocardio, la insuficiencia cardiaca y la muerte súbita. En el SCA podemos encontrar dos categorías de pacientes, en primer lugar, pacientes con dolor retroesternal agudo y elevación persistente del segmento ST del ECG. Esto se denomina SCACEST y generalmente refleja una oclusión coronaria aguda total. La mayoría de estos pacientes sufrirá, en último término, un IAMCEST. El objetivo terapéutico es realizar una reperfusión rápida, completa y persistente mediante angioplastia primaria o tratamiento fibrinolítico. En segundo lugar, están los pacientes con dolor retroesternal agudo, pero sin elevación persistente del segmento ST del ECG (SCASEST). Estos pacientes suelen tener una depresión persistente o transitoria del segmento ST o una inversión de las ondas T, ondas T planas, pseudo-normalización de las ondas T o ausencia de cambios en el ECG cuando se presentan los síntomas. La estrategia inicial en estos pacientes es aliviar la isquemia y los síntomas, monitorizar al paciente con ECG seriados y repetir las determinaciones de los marcadores de necrosis miocárdica. En el momento de la aparición de los síntomas, el diagnóstico del SCASEST se concretará, según el resultado obtenido a partir de la determinación de las troponinas, en infarto agudo de miocardio sin elevación del segmento ST (IAMSEST) o angina inestable (47,48. En algunos pacientes, se excluirá una cardiopatía isquémica como causa de los síntomas.
Algunas características relacionadas con los síntomas pueden apuntar al diagnóstico de enfermedad arterial coronaria y guiar el manejo del paciente. La exacerbación de los síntomas por el ejercicio físico o su alivio en reposo o después de la administración de nitratos confirma el diagnóstico de isquemia. Es importante identificar las circunstancias clínicas que puedan exacerbar o precipitar la aparición de SCASEST, como anemia, infección, inflamación, fiebre o trastornos metabólicos o endocrinos. Cuando nos encontramos ante un paciente sintomático, hay varias características clínicas que aumentan la probabilidad de un diagnóstico de enfermedad arterial coronaria y, por lo tanto, de SCASEST. Estas incluyen la edad avanzada, el sexo masculino, una historia familiar positiva y la existencia de aterosclerosis conocida en territorios no coronarios, como en el caso de la enfermedad periférica o la enfermedad arterial carotidea. La presencia de factores de riesgo, en especial diabetes mellitus e insuficiencia renal, así como manifestaciones previas de enfermedad arterial coronaria también aumenta la probabilidad de SCASEST (46.
Manejo diagnóstico y terapéutico del síndrome coronario agudo
La evaluación física suele ser normal. La presencia de signos de insuficiencia cardiaca o inestabilidad hemodinámica deben instar al cardiólogo a acelerar el diagnóstico y el tratamiento de estos pacientes, y más aún al observarse características clínicas de mal pronóstico (Tabla 1). Un objetivo importante de la evaluación física es excluir las causas no cardiacas del dolor torácico y los trastornos cardiacos no isquémicos, como embolia pulmonar, disección aórtica, pericarditis, y valvulopatías. Además, es importante excluir las causas potenciales extra-cardiacas, como las enfermedades pulmonares agudas, neumotórax, neumonía, derrame pleural. En este sentido, las diferencias en la presión arterial entre las extremidades superiores y las inferiores o la existencia de pulso irregular, ruidos cardiacos, frote pericárdico, dolor a la palpación y masas abdominales son hallazgos físicos que pueden indicar un diagnóstico distinto del SCASEST. Otros hallazgos físicos como palidez, sudoración profusa o temblor deben orientar hacia condiciones precipitantes, como anemia o tirotoxicosis (45,46.
Tabla 1: Características clínicas como factores de mal pronóstico del IAM
| 1. Edad > 65 años |
| 2. Antecedentes de IAM previo o insuficiencia cardíaca |
| 3. Diabetes Mellitus |
| 4. Hipotensión al momento del ingreso. Se debe descartar hipotensión por vagotonía o hipovolemia |
| 5. Taquicardia > 100 latidos por minuto al ingreso |
| 6. Presencia de insuficiencia cardíaca aguda. Los pacientes con KILLIP > I tienen progresivamente peor pronóstico; aquellos en KILLIP IV (shock cardiogénico) tienen una mortalidad cercana al 70% en el sexo femenino |
| 7. Las mujeres tienen prácticamente el doble de la mortalidad que los hombres |
El ECG de 12 derivaciones en reposo es la principal herramienta diagnóstica para la evaluación de los pacientes con sospecha de SCASEST. Se debe realizar en los primeros 10 min tras el primer contacto médico, ya sea durante la llegada del paciente a urgencias o durante el primer contacto pre-hospitalario con los servicios para-médicos de urgencias, y debe ser interpretado inmediatamente por un médico calificado. Las anomalías del ECG características del SCASEST son la depresión del segmento ST o la elevación transitoria y cambios en la onda T. La presencia de elevación persistente del segmento ST (> 20 min) apunta a un IAMCEST, que requiere un tratamiento diferente y mucho más aún cuando existen signos electrocardiográficos agravantes (Tabla 2). Si el registro del ECG inicial es normal o no concluyente, se debe obtener registros adicionales cuando el paciente sufra síntomas y compararlos con los registros obtenidos en la fase asintomática. Puede tener valor la comparación con un ECG previo cuando esté disponible, sobre todo en pacientes con trastornos cardiacos concomitantes, como hipertrofia ventricular izquierda o infarto de miocardio previo. Los registros de ECG deben repetirse por lo menos a las 3, 6, 9 y 24 horas después de la primera presentación e inmediatamente en caso de recurrencia de dolor torácico o síntomas. Se recomienda realizar un ECG antes del alta. Hay que subrayar que la existencia de un ECG completamente normal no excluye la posibilidad de SCASEST. En particular, la isquemia en el territorio de la arteria circunfleja o la isquemia ventricular derecha aislada suelen pasar inadvertidas en un ECG ordinario de 12 derivaciones, pero pueden detectarse en las derivaciones V7 - V9 y V3r, respectivamente. Los episodios transitorios de bloqueo de rama ocurren ocasionalmente durante los ataques isquémicos. El ECG estándar en reposo no refleja adecuadamente la naturaleza dinámica de la trombosis coronaria y la isquemia miocárdica. Casi dos terceras partes de todos los episodios isquémicos en la fase de inestabilidad son clínicamente silentes y, por lo tanto, es poco probable que puedan ser detectados por un ECG convencional. Por ello, la monitorización continúa de 12 derivaciones del segmento ST asistida por ordenador es una herramienta diagnóstica útil (46.
Tabla 2: Criterios electrocardiográficos de gravedad de un IAM
| 1. IAM de cara anterior |
| 2. Aparición de bloqueo completo de la rama derecha o izquierda en el transcurso de un infarto de pared anterior |
| 3. Aparición de bloqueo auriculoventricular de segundo o tercer grado |
| 4. Compromiso del ventrículo derecho en un IAM de cara inferior |
Un paciente con sospecha de SCASEST tiene que ser evaluado en un hospital y debe ser evaluado inmediatamente por un especialista calificado. Las unidades de dolor torácico especializadas o las unidades coronarias son las que ofrecen una mejor y más rápida atención. El paso inicial es asignar sin demora al paciente a un proceso diagnóstico en el que debe basarse la estrategia terapéutica. Se debe extraer sangre en el momento en que el paciente llega al Hospital y los resultados deberían estar disponibles en un plazo de 60 min, el análisis sanguíneo inicial debe incluir por lo menos troponina T o I, creatinina, hemoglobina, glucosa sanguínea y recuento de células sanguíneas, además de las pruebas bioquímicas estándares. Si las evaluaciones ponen al paciente en la categoría de SCASEST, podemos pasarlo a la siguiente etapa.
Validación del Diagnóstico y Evaluación del Riesgo: Cuando se ha asignado al paciente al grupo SCASEST, se debe iniciar el tratamiento con anti-trombóticos orales y endovenosos48-50. El manejo posterior del paciente se va a basar en información y datos adicionales, tales como, la respuesta al tratamiento anti-anginoso, los análisis bioquímicos habituales, especialmente las troponinas (Figura 2). Además, se deben analizar otras enzimas plasmáticas y otros marcadores de pronóstico, y realizar una monitorización del segmento ST, la evaluación del riesgo isquémico (clasificación de GRACE), la ecocardiografía, y opcionalmente otros estudios auxiliares de diagnóstico como la radiografía de tórax, TC, RM o imagen nuclear. Además, es importante realizar una evaluación del riesgo hemorrágico (clasificación CRUSADE) (46.
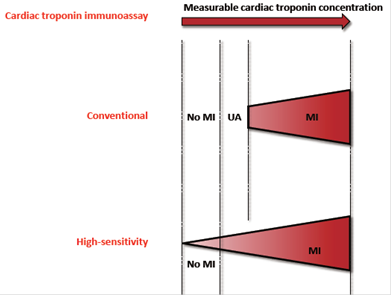
Figura 2: La sensibilidad analítica mejorada de los inmunoensayos de la troponina cardiaca y su relación con el diagnóstico del síndrome coronario agudo. MI: Infarto de miocardio. UA: Angina inestable. Reimpreso con permiso de Cervellin G, Mattiuzzi C, Bovo C, Lippi G. Diagnostic algorithms for acute coronary syndrome. Is one better than another? Ann Transl Med 2016;4(10):193. doi: 10.21037/atm.2016.05.16 65
Se ha demostrado que el cateterismo cardiaco seguido de revascularización previene la isquemia recurrente o mejora los resultados clínicos a largo plazo. Se han identificado varios factores de riesgo (elevación de las troponinas, diabetes, depresión del segmento ST, insuficiencia renal) capaces de predecir el beneficio a largo plazo de la estrategia invasiva. Dependiendo de lo agudo que sea el riesgo, se puede ajustar el momento óptimo de la coronariografía según cuatro categorías de riesgo, a saber, la invasiva urgente (< 120 min), la invasiva precoz (< 24 horas), la invasiva (< 72 horas), y la principalmente conservadora. El momento óptimo depende del perfil de riesgo del paciente individual y se puede calcular mediante diversas variables (46.
La estrategia invasiva urgente: (<120 min después del primer contacto médico) debe seguirse en pacientes de muy alto riesgo. Estos pacientes se caracterizan por tener:
1) angina refractaria, indicio de un IAM en curso sin anomalías del ST, 2) angina recurrente a pesar de tratamiento anti-anginoso intenso, asociada a depresión del segmento ST de 2 mm o más, u ondas T negativas profundas, 3) síntomas clínicos de insuficiencia cardiaca o inestabilidad hemodinámica o shock, 4) arritmias que ponen en riesgo la vida como la fibrilación ventricular o la taquicardia ventricular. Si no se puede realizar una angioplastia primaria de urgencia se puede considerar la administración de un inhibidor de los receptores de la glicoproteína (GP) IIB/IIIA (abxicimab, eptifibatida o tirofibán) a pacientes con estas características como estrategia de puente hasta la intervención coronaria percutánea51-55.
La estrategia invasiva precoz: (<24 h después del primer contacto médico). Muchos pacientes responden inicialmente al tratamiento anti-anginoso, pero se encuentran en una situación de riesgo aumentado y necesitan angiografía seguida de revascularización. Se debe someter en un plazo de 24 horas a evaluación invasiva a los pacientes de alto riesgo, identificados por una puntuación de riesgo según la clasificación GRACE >140 o con presencia de al menos un criterio principal de alto riesgo. La utilización de heparina no fraccionada, inhibidores de la glicoproteína IIb/IIIa, la bivalirudina y otros fármacos antitrombóticos son de mucha utilidad sobre todo en las complicaciones trombóticas de la angioplastia (56-60.
La estrategia invasiva: (<72 horas después del primer contacto médico). En pacientes con un riesgo menos agudo, y sin recurrencia de síntomas, la angiografía puede realizarse dentro de una ventana de tiempo de 72 horas, a este tipo de pacientes se los debe someter en la primera oportunidad a una evaluación invasiva electiva, dependiendo de las circunstancias locales. Estos pacientes se benefician con el implante de los nuevos stents con drogas y los biodegradables (61-63.
La estrategia conservadora: (sin angiografía o con angiografía electiva). Se puede considerar de bajo riesgo a los pacientes que cumplen todos los criterios siguientes, y no se debe someterlos sistemáticamente a evaluación invasiva precoz: 1) ausencia de recurrencia del dolor torácico. 2) ausencia de signos de insuficiencia cardiaca. 3) ausencia de anomalías en el ECG inicial o en el segundo ECG (a las 6 y a las 9 horas del ingreso). 4) ausencia de elevación de las troponinas (en el momento de llegar al hospital y a las 6 y a las 9 horas del ingreso). 5) ausencia de isquemia inducible. Son pilares del tratamiento médico conservador los anti-agregantes plaquetarios, la aspirina, el clopidogrel, también la atorvastatina, los beta-bloqueantes y vasodilatadores. En la Figura 3 observamos las proporciones de riesgo con 95% de intérvalo de confidencia de los resultados primarios (A) y de la hemorragia mayor (B) en pacientes de 7 ensayos clínicos randomizados, controlados, y tratados con terapia antiplaquetaria doble por corto tiempo (hasta 6 meses) comparado a largo tiempo (12 meses o más).
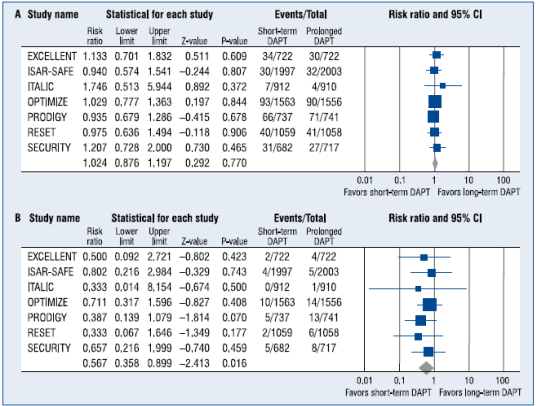
Figura 3: En este Forest plot se reportan las proporciones de riesgo con 95% de intervalo de confidencia (CI) de los resultados primarios (A) y de la hemorragia mayor (B) en pacientes de 7 ensayos randomizados, controlados, y tratados con terapia antiplaquetaria doble por corto tiempo (hasta 6 meses) comparado a largo tiempo (12 meses o más). Reimpreso con permiso de Sheyin O, Perez X, Louis BP, Kurian D. The optimal duration of dual antiplatelet therapy in patients receiving percutaneous coronary intervention with drug-eluting stents. Cardiology J 2016; 23(3): 307-316. 66
Hay que derivar a los pacientes a tratamiento médico cuando la coronariografía muestre carga ateromatosa pero ausencia de lesiones coronarias críticas. Antes del alta hospitalaria se debe reconsiderar el diagnóstico de SCASEST y prestar especial atención a otras causas posibles de los síntomas en el momento de la presentación. A pesar de ello, la ausencia de lesiones coronarias críticas no excluye el diagnóstico cuando la presentación inicial indicaba dolor torácico isquémico y los biomarcadores eran positivos. En esta situación, los pacientes deben recibir tratamiento de acuerdo con las recomendaciones para SCASEST. Las recomendaciones para la selección de la modalidad de revascularización en los SCASEST son similares a las de los procedimientos de revascularización electiva. En pacientes con enfermedad de un solo vaso, la angioplastia con stent de la lesión causal es la primera elección. En pacientes con enfermedad de múltiples vasos, la decisión de realizar angioplastia o cirugía debe ser individualizada, de acuerdo con los protocolos institucionales. En algunos pacientes puede ser ventajoso realizar un enfoque secuencial, que consiste en tratar la lesión causal con angioplastia seguida de cirugía electiva con prueba de isquemia o evaluación funcional de las lesiones distintas de la causal. En caso de que la angiografía no muestre ninguna opción de revascularización, debido a la extensión de las lesiones o a un flujo distal escaso por lechos vasculares distales finos, se debe alcanzar la resolución de la angina en reposo mediante tratamiento médico intensivo y se debe instaurar medidas preventivas secundarias.
Aunque en los SCASEST la mayor parte de los episodios adversos tienen lugar en la fase temprana, el riesgo de IAM o muerte se mantiene elevado durante meses. Los pacientes tratados con revascularización precoz tienen un riesgo bajo (2,5%) de sufrir arritmias que pongan en peligro la vida, y un 80% de los casos se producen durante las primeras 12 horas después del inicio de los síntomas. De acuerdo con esto, no es necesario monitorizar sistemáticamente a los pacientes más allá de las 24 a 48 horas. Se debe hospitalizar a los pacientes con SCASEST durante al menos 24 horas después de la implantación exitosa de un stent en la lesión causal. Es necesario realizar una modificación intensa de los factores de riesgo y cambios en el estilo de vida de todos los pacientes diagnosticados con SCASEST. La inclusión de un paciente en un programa de rehabilitación cardiaca puede mejorar su adherencia al régimen médico y puede ser de apoyo para la modificación de los factores de riesgo. Al respecto, es interesante que un estudio clínico determino que es importante introducir en la unidad de urgencias y centros de atención un programa de capacitación continua a través de la discusión de casos clínicos problematizados que favorezcan el desarrollo de capacidades complejas para optimizar el tratamiento.
CONCLUSIÓN
El entendimiento mejorado y la comprensión adecuada de la influencia de los procesos inflamatorios en el SCA pueden llevar no solo a una mejor utilización de la terapéutica actualmente disponible sino también al desarrollo de nuevas herramientas terapéuticas. Sin duda alguna, los refinamientos constantes en las diferentes estrategias terapéuticas del SCA, sumados a la combinación del entendimiento científico en el uso adecuado de los marcadores inflamatorios, los nuevos agentes farmacológicos y las nuevas técnicas de intervención coronaria percutánea con los nuevos stents van a aclarar nuestras dudas y mejorar nuestro manejo diagnóstico y terapéutico del síndrome coronario agudo basado en la evidencia científica.














