INTRODUCCIÓN
Escherichia coli productora de toxina Shiga (STEC) representa uno de los principales agentes causantes de Enfermedades Transmitidas por Alimentos (ETA) en el mundo1. Produce cuadros clínicos que pueden ir de diarreas acuosas leves a manifestaciones más severas como diarrea sanguinolenta, colitis hemorrágica y síndrome urémico hemolítico (SUH)2. E. coli O157:H7 ha sido el serotipo asociado con mayor frecuencia a grandes brotes y el implicado en la mayoría de los casos de SUH a nivel mundial3-6. Sin embargo, se han reportado serogrupos no-O157 en varios brotes importantes en los últimos años. Así por ejemplo, el serotipo O104:H4, en el año 2011, causó en Europa un brote con 3816 casos, de los cuales, 845 progresaron a SUH, siendo el brote más grande con casos de SUH a nivel mundial. Otros serogrupos no-O157 también han causado brotes importantes.
El Centro de Prevención y Control de Enfermedades (CDC) estima que aproximadamente 113.000 infecciones y 300 hospitalizaciones ocurren anualmente en EEUU, debido a la infección por seis principales serogrupos STEC, denominados “big six”: O26, O45, O103, O111, O121 y O145. Por lo que estos han sido declarados como adulterantes de alimentos por el Servicio de Inspección y Seguridad Alimentaria (FSIS) de EEUU7,8. Con base en esto, los principales mercados internacionales de compra de carne y derivados han establecido clasificaciones de riesgo para los mismos basados en evidencia epidemiológica de patologías graves como SUH, en relación a la incidencia de los mismos en brotes. Es así, que EEUU se centra en la identificación del serotipo, y categoriza a las O157 y las “big six” en las 2 categorías de mayor riesgo9 mientras que la Autoridad Europea de Seguridad Alimentaria (EFSA) considera que, además de los serogrupos, es necesario tener en cuenta la presencia de determinados factores de virulencia, como stx y eae o aaiC y aggR10. Teniendo en cuenta estos criterios de clasificación establecidos para los alimentos y considerando que el Paraguay constituye uno de los principales exportadores de carne vacuna a nivel mundial, es de suma importancia contar con capacidades instaladas a nivel nacional para realizar la detección de estos patógenos en los productos11.
La identificación de los serotipos de E. coli se realiza por métodos convencionales de aglutinación, utilizando antisueros de conejos dirigidos contra diferentes antígenos O y H de cepas de referencia12. Sin embargo, este método además de ser muy costoso y laborioso, no se encuentra disponible en el país para uso masivo. En consecuencia, se requieren métodos alternativos de serotipificación que se encuentren disponibles a nivel nacional e impliquen procesos específicos, sensibles, rápidos y con costos que permitan su escalado a niveles industriales.
Varios autores reportan el uso de métodos moleculares basados en la técnica de PCR para la detección de diversos serogrupos de STEC, con ventajas de alta especificidad y sensibilidad13,14. Por tanto, en este estudio, nos hemos centrado en la estandarización de una técnica de PCR múltiple para la detección de los serogrupos O157, O104 y las denominadas “big six”, a fin de contar con un sistema de detección de alta especificidad, sensibilidad y que, además permita el screening de un alto número de muestras con máxima relación costo/beneficio, que podría ser de interés para la industria cárnica nacional.
MATERIALES Y MÉTODOS
Cepas bacterianas. Para la estandarización del método se han utilizado cepas E. coli de referencia provenientes del Laboratorio de Referencia de Escherichia coli (Universidad de Santiago de Compostela, España) y que fueron gentilmente cedidas por la Dra. Nora Lía Padola del Laboratorio de Inmunoquímica y Biotecnología del Centro de Investigación Veterinaria de Tandil de la Facultad de Ciencias Veterinarias (Universidad Nacional del Centro de la Provincia de Buenos Aires, Argentina), correspondientes a los serogrupos O26, O45, O103, O111, O121, O104, O145 y O157.
Estas cepas fueron cultivadas en agar Luria Bertani (LB) a 37 °C en atmósfera con 5% de CO2 durante 24 horas, para su crecimiento y posterior extracción de ADN.
Extracción de ADN. La extracción de ADN de las cepas, se realizó mediante el método de ebullición descrito por Ennis et al. en 2012, con algunas modificaciones15. Consistió en la resuspensión de las colonias crecidas en un volumen de 300 µL de agua estéril y posterior ebullición en baño María durante 10 minutos. A continuación, se procedió a la centrifugación de las muestras durante 5 minutos a 13.000 rpm. El sobrenadante fue criopreservado a -20ºC hasta su utilización como molde en reacciones de PCR.
Amplificación por PCR del gen wzx. Para la detección de los serogrupos, se amplificaron secuencias específicas del gen wzx utilizando pares de primers específicos para cada uno de los serogrupos O26, O45, O103, O104, O111, O121, O145 y O157, según lo descrito por Sánchez et al. en 201513.
Las condiciones de reacción para la detección de los serogrupos en estudio son descritas a continuación: buffer 1x (Invitrogen, USA), dNTPs 0,2 mM (Invitrogen, EEUU), oligonucleótidos 0,5 µM (Macrogen, Corea), MgCl2 2 mM (Invitrogen, USA) y 1 Unidad de Taq Polimerasa por reacción (Invitrogen, EEUU). Para la reacción de PCR se utilizó un volumen de 1,5 µL de ADN molde, en un volumen total de reacción de 15 µL.
Las condiciones de ciclado fueron: desnaturalización inicial a 95°C por 3 minutos, 25 ciclos de desnaturalización (95°C por 30 segundos), anillamiento (50°C por 30 segundos) y extensión (72°C por 1 minuto), y una extensión final a 72°C por 5 minutos. Se empleó el termociclador Applied Biosystems-SimpliAmp Thermal Cycler (Singapur).
El tamaño de los productos de amplificación esperado para cada serogrupo, se detallan en la Tabla 1.
Tabla 1: Tamaño de productos de PCR esperados para cada serogrupo.
| Serogrupo | Tamaño de amplicon |
| O26 | 268 pb |
| O45 | 608 pb |
| O103 | 320 pb |
| O104 | 272 pb |
| O111 | 829 pb |
| O121 | 651 pb |
| O145 | 418 pb |
| O157 | 133 pb |
Separación de fragmentos de ADN mediante electroforesis en gel de agarosa. La visualización de los fragmentos amplificados por PCR se realizó mediante electroforesis en gel de agarosa al 2%, teñido con el agente intercalante SYBR safe al 10% del volumen de gel utilizado. Para dicho procedimiento, se sembraron 5 μL del producto amplificado, mezclado con loading buffer a una concentración final de 1x y se realizó la corrida en cuba electroforética con buffer TAE (Tris, acetato, EDTA) al 1x a 110 V durante 30 minutos, aproximadamente.
El marcador de peso molecular de 100 pb (Thermo Fisher Scientific, EEUU) fue utilizado para estimar el tamaño de los productos separados. Los resultados fueron registrados en formato de fotos digitales y analizados con el software de KODAK Digital Science DC 120 (EEUU).
RESULTADOS
Se realizó primeramente la estandarización en forma de reacciones individuales para verificar la correcta amplificación de cada uno de los serogrupos de interés. En la prueba con condiciones descritas por Sánchez et al. se obtuvieron productos de tamaño esperado para los sistemas O26, O103, O104, O145 y O157. Sin embargo, no hubo amplificación para los sistemas O45, O111 y O121. En éstos se procedió a variar la temperatura de anillamiento, obteniéndose mejores resultados con 50°C para estos sistemas. Bajo estas condiciones, se realizó una nueva reacción, observándose la amplificación de todos los sistemas con productos del tamaño esperado, sin mayores inconvenientes que la presencia de una débil banda secundaria de menor tamaño en el sistema O45 (Figura 1).
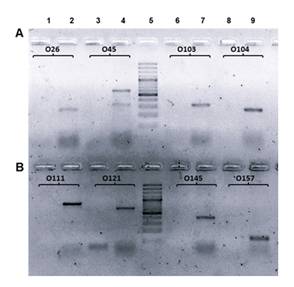
Figura 1: Amplificación de las variantes de genes wzx específicos para cada serogrupo. Electroforesis en gel de agarosa al 2% teñido con SYBR safe. A: carriles 1 y 2) control negativo y cepa O26 (268 pb); carriles 3 y 4) control negativo y cepa O45 (608 pb); carril 5) marcador de peso molecular de 100 pb; carriles 6 y 7) control negativo y cepa O103 (320 pb); carriles 8 y 9) control negativo y cepa O104 (272 pb). B: carriles 1 y 2) control negativo y cepa O111 (829 pb); carriles 3 y 4) control negativo y cepa O121 (651 pb); carril 5) marcador de peso molecular de 100 pb (Thermo Fisher Scientific, EEUU); carriles 6 y 7) control negativo y cepa O145 (418 pb); carriles 8 y 9) control negativo y cepa O157 (133 pb).
Posteriormente se hicieron pruebas de amplificación múltiple eligiendo 50°C como temperatura de anillamiento. Los resultados permitieron amplificar productos de tamaño esperado en cada sistema (Figura 2). No se observaron reacciones cruzadas o falsos positivos, tampoco bandas secundarias, siendo notoria la desaparición de la banda secundaria que se había observado en el sistema O45 cuando se amplificaba individualmente.
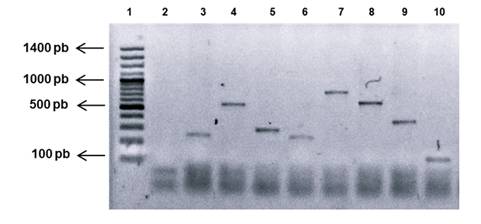
Figura 2: Amplificación en formato múltiple de variantes de genes wzx específicos para cada serogrupo. Electroforesis en gel de agarosa al 2% teñido con SYBR safe. Carril 1) marcador de peso molecular de 100 pb; carril 2) control negativo; carril 3) serogrupo O26 (268 pb); carril 4) serogrupo O45 (608 pb); carril 5) serogrupo O103 (320 pb); carril 6) serogrupo O104 (272 pb); carril 7) serogrupo O111 (829 pb); carril 8) serogrupo O121 (651 pb); carril 9) serogrupo O145 (418 pb); carril 10) serogrupo O157 (133 pb).
DISCUSIÓN
La industria de la carne es uno de los sectores económicos más dinámicos del país y representa uno de los ingresos más importantes por exportaciones en el Paraguay, ubicándose en el puesto número 7 como exportador de carne bovina a nivel mundial16,17. Actualmente, el sector representa el 12,1% del Producto Interno Bruto (PIB), aportando aproximadamente US$ 3.500 millones a la economía nacional11. Por esto, es fundamental el aseguramiento de la sanidad animal y de la calidad e inocuidad de sus productos, tanto para el consumo interno, como para las exportaciones y más, teniendo en cuenta que el intestino de los bovinos representa el principal reservorio de STEC y, por tanto, es un factor potencial de riesgo para la salud pública en situaciones como: la contaminación durante los procesos de faenado y despiece en la producción de carne, la contaminación del agua o alimentos por residuos de excreción fecal de los bovinos portadores18,19.
Los serogrupos O26, O45, O103, O104, O111, O11, O145 y O157 son los serogrupos STEC de mayor importancia clínica a nivel mundial, implicados en el mayor número de brotes y cuadros clínicos graves y, por tanto, se ha implementado la “tolerancia cero” de los mismos en alimentos bajo la Ley Federal de Inspección de la Carne (FMIA) de EEUU, la cual, declara como adulterada la presencia de los mismos en carne cruda y no apta para el consumo humano20. De esta manera, es importante realizar el screening de la presencia de los mismos en los alimentos, ya que son patógenos que han generado brotes con alto impacto en la salud pública a nivel mundial.
Los métodos actuales de identificación de serogrupos basados en técnicas serológicas son engorrosos, costosos y no se encuentran disponibles en el país para uso a gran escala. Además, con frecuencia aparecen reacciones cruzadas entre diferentes serogrupos, con lo cual, se generan resultados erróneos en la serotipificación, siendo ésta la principal limitación del método13.
En este contexto, el presente trabajo nos ha permitido estandarizar un método molecular basado en la amplificación de secuencias específicas del gen wzx, codificante de la flipasa de cada variante del antígeno O de los serogrupos O26, O45, O103, O104, O111, O121, O145 y O157, que son de interés reglamentario para mercados, tanto estadounidenses, como europeos.
Los resultados muestran una buena amplificación de cada gen, generando productos de tamaños diferentes y distintivos para cada uno. No se observaron amplificaciones cruzadas o falsos positivos en ninguno de los sistemas. El único inconveniente de amplificación inespecífica, fue de una banda de menor tamaño en el sistema individual O45, la cual desapareció al realizar la amplificación múltiple, posiblemente por competencia de los diferentes sistemas durante la PCR.
Es importante destacar que el hecho de amplificación múltiple reduce ampliamente costos y tiempos de análisis, hechos no menores desde el punto de vista industrial que requiere el screening de grandes y numerosos lotes de productos en simultáneo y que requiere resultados rápidos en corto tiempo debido a que los productos cárnicos son perecederos.
El costo de sistemas eficientes de screening, en contraste, pueden ahorrar cuantiosas pérdidas económicas por el rechazo de cargamentos contaminados. Un ejemplo es el caso del rechazo de 100 toneladas de carne de exportación por la contaminación con E. coli, que en el 2011 generó una pérdida de 450.000 dólares a la planta frigorífica responsable21.
Otra ventaja es que este método molecular puede aplicarse para el estudio de distintas matrices y, por tanto, permitirá la detección de estos serogrupos de STEC en ganado en pie, en agua de distintas fuentes, alimentos diversos o incluso, para la tipificación de aislamientos clínicos asociados a enfermedades en humanos y, por tanto, el método podría representar una herramienta útil para estudios epidemiológicos, así como para la vigilancia de STEC en casos de brotes.














