INTRODUCCIÓN
La toxoplasmosis es una zoonosis, cuya prevalencia mundial varía ampliamente entre regiones geográficas1. En Sudamérica, la prevalencia de anticuerpos de tipo IgG anti T. gondii varía ampliamente, por ejemplo es 55,9% en Chile2 )(2) , 70-81% en Brasil3, 21,2 % en Argentina4 y en Paraguay 63-84% en una población adulta5,6. Estas variaciones de prevalencias a nivel mundial están relacionadas con las condiciones ambientales, socio-económicas y culturales como los hábitos alimenticios y la higiene; así como la susceptibilidad del hospedador1,7.
La infección por T. gondii adquirida por individuos inmunocompetentes generalmente es benigna y asintomática, sin embargo, representa una causa importante de morbilidad y mortalidad en pacientes inmunocomprometidos8,9. Cuando una mujer adquiere la infección primaria durante la gestación los parásitos pueden transmitirse verticalmente (desde la placenta al feto); por lo que las mujeres gestantes que cursan con una infección aguda por T. gondii pueden dar a luz a bebes con toxoplasmosis congénita10-12.
La infección producida por T. gondii consta de dos fases: aguda y crónica. El control de la respuesta humoral del huésped permite realizar el diagnóstico diferencial, debido a que la producción de anticuerpos específicos anti-T. gondii se correlaciona con el curso de la infección13,14.
Los métodos serológicos son los más empleados en el diagnóstico de toxoplasmosis, empleándose una combinación de los mismos para la distinción entre la fase aguda y crónica. Actualmente, para la detección de anticuerpos de tipo IgM e IgG y/o la demostración de seroconversión (aumento del título de anticuerpos) se emplean los ensayos de ELISA (enzyme-linked immunosorbent assay o ensayo por inmunoabsorción ligado a enzimas), QLA (Quimioluminiscencia), IFI (Inmunofluorescencia Indirecta)7,15,16. Además se realizan ensayos de avidez de IgG, los cuales permiten diferenciar los anticuerpos IgG de baja avidez, producidos en una etapa temprana de la infección de aquellos con una mayor fuerza de unión (alta avidez) que reflejan una infección latente o crónica17.
En Paraguay se han realizado estudios de seroprevalencia y avidez de los anticuerpos en diferentes poblaciones, sin embargo sobre las proteínas antigénicas en nuestra población fue poco estudiada. El método de Western Blot (WB) es una técnica que se basa en inmunotransferencia de proteínas del parásito o virus que permite cuantificar proteínas específicas y comparar perfiles antigénicos. Se ha utilizado para el diagnóstico confirmatorio de muchas enfermedades, el más conocido el HIV18. En la toxoplasmosis esta técnica se ha empleado para demostrar la presencia de marcadores antigénicos que permiten distinguir entre la fase aguda y crónica de la toxoplasmosis19-21. En los últimos años se ha aplicado para confirmación de toxoplasmosis congénita, y se estimó una sensibilidad del WB del 72 al 85% al tercer mes de vida y al combinarlo con serología la sensibilidad aumentó a 94% con especificidad de 100%22. Es importante conocer las proteínas antigénicas más frecuentes de los pacientes con toxoplasmosis a nivel nacional, ya que podría ser factible para el desarrollo de otros métodos de diagnóstico que faciliten la confirmación de la enfermedad. Es por esto que este trabajo tuvo por objetivo identificar el perfil antigénico asociado a embarazadas con toxoplasmosis en fase aguda y crónica de la enfermedad.
MATERIALES Y MÉTODOS
Sueros humanos
Los 55 sueros de mujeres embarazadas empleados en este estudio fueron codificados y almacenados en la seroteca del Dpto. de Producción del Instituto de Investigaciones en Ciencias de la Salud, todos obtenidos con previo consentimiento informado y una encuesta de antecedentes serológicos de IgG e IgM en el momento de la toma de muestra. Se consideraron agudos los valores menores de 45% y crónicos a valores mayores de 50%, fueron diagnosticados por medio del ELISA de Avidez IgG (TOXOPLUS-IICS, Paraguay) relacionando los resultados con los antecedentes de cada paciente.
Se incluyeron 27 sueros de pacientes con toxoplasmosis aguda con avidez <45%; y datos de IgG e IgM positiva y 28 sueros de pacientes con toxoplasmosis crónica con avidez >50%, con IgG positiva e IgM negativa.
Controles
Se emplearon como control positivo y control negativo un pool de sueros de pacientes con diagnostico positivo y negativo para toxoplasmosis, respectivamente, los cuales fueron testados por medio de los métodos de diagnóstico de ELISA de Avidez IgG e Inmunofluorescencia Indirecta.
Producción de antígeno soluble de Toxoplasma gondii para el WB
Fueron inoculados por vía intraperitoneal 0,1 mL de una suspensión de 2x107 taquizoítos/mL a cuatro ratones hembras albinos tipo suizo de un mes de edad. A los cuatro días de la inoculación, se sacrificaron los ratones por el método de eutanasia con dióxido de carbono. Se inyectaron 3mL de solución fisiológica más gentamicina (400 mg/mL) en la cavidad intraperitoneal, se aspiró, se recogió el fluido intraperitoneal en tubos centrifuga de 50mL y se observó entre lámina y laminilla, con aumento de 40x en el microscopio óptico (Olympus). Luego se inoculó 0,1mL del líquido intraperitoneal realizando varios pasajes hasta obtener campo lleno de parásitos con aumento de 40x en el microscopio óptico.
Para la producción del antígeno se realizó un pool de los lavados intraperitoneales de todos los ratones infectados del último pasaje con campo lleno de parásitos, se centrifugó a 3500 rpm a 4 °C por 20 minutos, se eliminó el sobrenadante y el precipitado se resuspendió con 5 mL de solución fisiológica más gentamicina (400 mg/mL), posteriormente se adicionó un agente antiproteolítico para su conservación a -20 °C. La ruptura de los taquizoítos se realizó mediante doce ciclos de sonicación en baño de hielo. Se centrifugó a una velocidad de 3500 rpm por 20 minutos a 4ºC. La concentración de proteínas presentes en el sobrenadante se determinó por el método de Bradford23, empleando como patrón albúmina de suero bovino (ASB) para la obtención de una curva patrón y posterior cálculo de la concentración de las proteínas solubles del antígeno preparado.
Electroforesis en gel de poliacrilamida con dodecil sulfato de Sodio (SDS-PAGE) e inmunotransferencia.
Las proteínas solubles de taquizoítos de la cepa RH de T. gondii se separaron por de electroforesis (SDS-PAGE) descrita por Laemmli24 con algunas modificaciones. Se utilizó una concentración del gel de poliacrilamida de 5% en su fracción concentradora y 12% en la fracción separadora. La corrida electroforética se realizó probando tiempos de corrida de 90 minutos, y aplicando corriente constante de 40mA (miliamperios).
Se mezclaron 200uL de la suspensión de proteínas solubles (3,98ug/µL) con 100 μL de tampón de carga; la mezcla se incubó a 70ºC por 5 minutos. Los volúmenes de carga de la muestra variaron de 8-12 μL. Se cargaron las muestras y el marcador de peso molecular (Bio-Rad-USA) en el mismo gel para estimar el peso molecular de cada proteína antigénica. Posterior a la electroforesis, se realizó la tinción del gel con Coomasie blue.
Se realizó Western Blot según el protocolo de Towbin et al.25 con algunas modificaciones. Las fracciones proteicas separadas por SDS-PAGE se transfirieron a la membrana de polivinildifluoruro (PVDF) (Millipore, USA). La transferencia se realizó probando las siguientes condiciones: voltaje constante 59V (voltios) y tiempos de corrida de 120 minutos. Las membranas cortadas de 0,5mm de ancho fueron guardadas a -20°C hasta su utilización.
Inmunoblotting
Se emplearon sueros controles positivos y negativos de un Kit de ELISA indirecto IgG (TOXO TEST IICS, Paraguay) y para determinación del perfil 55 muestras de suero siguiendo la técnica. Los sueros fueron diluidos (1/20) con solución salina tamponada con TRIS (TBS)-leche descremada al 3% .Se incubaron las membranas en agitación durante 1 h 30 min. Se realizaron 3 lavados de 5 minutos cada uno con tampón TBS, Se incubó 1 h con 1mL de anticuerpo secundario anti IgG humana de cabra conjugado con peroxidasa (IICS-UNA), diluido 1/1000 con TBS-leche descremada al 3%. Se realizaron 3 lavados de 5 minutos cada uno con TBS-Tween 20 al 0,05%; posteriormente se adicionó 0,5 mg/mL del sustrato cromógeno 3,3' tetrahidrocloruro de diaminobencidina (DAB) (Sigma/Aldrich -USA) y peróxido de hidrógeno al 0,01% en tampón TBS. Una vez visualizadas las bandas, se detuvo la reacción con agua destilada.
Determinación del perfil antigénico
Para identificar el perfil de las proteínas antigénicas presentes en las membranas transferidas, de los 55 sueros pacientes con diagnóstico de toxoplasmosis positivo; diferenciados en agudos y crónicos por el test de Avidez IgG (TOXOPLUS-IICS, Paraguay) se utilizó el programa Image J Ccm (salud.ccm.net).
Obtención y análisis de datos
Para el análisis del registro fotográfico de los geles de poliacrilamida como de las membranas transferidas se utilizó el programa Image J Ccm (salud.ccm.net) para el análisis de las bandas con el fin de determinar los pesos moleculares con referencia al marcador (Bio-Rad-USA). Los datos fueron introducidos en una hoja de cálculo de Excel para expresar los resultados en forma de distribución de frecuencia y el cálculo de desviación estándar.
Consideraciones éticas
El trabajo de investigación fue un objetivo dentro del proyecto marco P17/2017 aprobado por el Comité Científico y Comité de Ética en la Investigación del IICS.
Si bien estos pacientes no fueron beneficiados directamente, los resultados obtenidos en cuanto al perfil antigénico servirán como base para nuevos estudios en el proyecto con beneficio directo a nuevos pacientes.
RESULTADOS
A partir de la metodología empleada se obtuvo una alta concentración de proteínas solubles de T. gondii de 3,98 mg/mL. Las proteínas solubles de taquizoítos de Toxoplasma gondii fueron utilizados para la prueba de Western Blot y detectar marcadores antigénicos. En las proteínas presentes en el extracto de T. gondii separadas por medio de SDS-PAGE, se observó el patrón de bandas con un rango de peso molecular comprendido entre 15kDa y mayor a 160 kDa (Figura 1).

Figura 1: Patrón de Proteínas del extracto T. gondii. (A) Patrón de proteínas de la cepa RH de T. gondii de separadas por SDS-PAGE. (B) Marcador de peso molecular. Estimación de peso molecular realizado mediante el software ImageJ. (kDa)(kiloDaltons).
En el Inmunoblotting se observó reacción positiva, evidenciada por el reconocimiento antigénico por parte de anticuerpos IgG, empleando un control positivo (A) al emplear el control negativo no se observó reacción (B). Figura 2

Figura 2: Inmunoblot de extractos proteicos de la Cepa RH de T. gondii. Se indican los pesos moleculares de las proteínas correspondientes a las bandas detectadas. A: reacción con control positivo. B: reacción con control negativo.
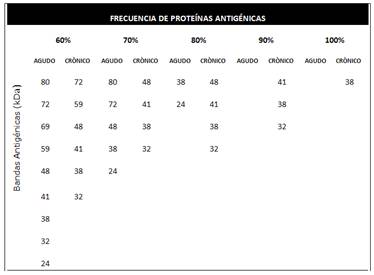
En cuanto al perfil de proteínas antigénicas del extracto proteico de la Cepa RH de T. gondii, los sueros de pacientes analizados reconocieron 29 bandas de proteínas antigénicas asociadas al perfil de infección aguda y 26 bandas de proteínas antigénicas asociadas al perfil de infección crónica. Los pesos moleculares de las bandas detectadas se encuentran dentro de un rango de 15 kDa a > 115 kDa.
De las proteínas antigénicas reconocidas por anticuerpos IgG anti- T. gondii presentes en muestras de suero de pacientes con infección aguda, del 20 al 60 % reconocieron seis bandas correspondientes a las proteínas p35, p43, p45, p56, p100 y p107 que no fueron observadas en el perfil de proteínas antigénicas de pacientes con infección crónica.
De las 26 bandas de proteínas antigénicas asociadas al perfil de infección crónica, las bandas correspondientes a las proteínas p65, p95, p98 y p113 fueron reconocidas por el 17-35% de los pacientes de manera específica. En la Figura 3 y Figura 4 se observan que las proteínas p32, p38, p41, p48, p59 y p72 fueron reconocidas por los anticuerpos tipo IgG anti T. gondii en más del 60% de los 55 sueros de pacientes tanto al inicio de la infección como en la etapa crónica.
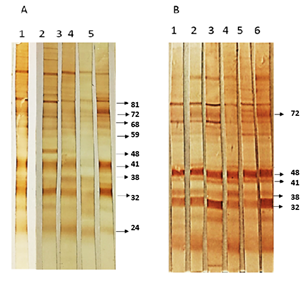
Figura 3: Perfil de proteínas antigénicas de T. gondii cepa RH. (A) Reacción positiva frente a sueros de pacientes con Toxoplasmosis aguda, (B) Reacción Positiva frente a sueros de pacientes con Toxoplasmosis crónica.
DISCUSIÓN
Para el diagnóstico confirmatorio de la toxoplasmosis, se han llevado a cabo estudios en relación al empleo del Western Blot en la detección de marcadores antigénicos específicos.
La utilización de la cepa RH de T. gondii en la fracción soluble para la determinación del perfil antigénico coincide con otros autores que utilizaron cepas también virulentas como GT1 obteniendo respuestas similares26,27. Otros autores informaron que los principales antígenos solubles estarían dentro de un rango de tamaño 20-120 kDa y así como también en un rango de <16 y >116 kDa y <15 y >190 kDa coincidiendo con el rango de proteína encontrado en nuestro estudio17,27-29.
Teniendo en cuenta la etapa de la infección, diversos estudios difieren con respecto a la presencia de proteínas antigénicas, las cuales varían de acuerdo al tipo de cepa utilizada para el diagnóstico. Se han reportado proteínas de fase aguda que van de 60 a 70kDa en cepas como RH, Ankara, Ts-4 y mayores a 85kDa en la cepa SUBI30, por lo que cada región debería estandarizar el perfil según la cepa de T. gondii utilizada.
En un estudio de marcadores moleculares de fase aguda y crónica de toxoplasmosis en humanos se obtuvieron resultados similares al nuestro, en el cual las proteínas p32, p41 y p72 también fueron reconocidas por anticuerpos IgG anti-T. gondii en muestras con las formas recientes y crónicas de toxoplasmosis, en tanto que p38 fue considerada como marcador de infección reciente21. Otros estudios han descrito proteínas detectadas por anticuerpos de tipo IgG anti-T. gondii de interés diagnóstico, cuyo peso molecular se encuentra comprendido entre 32-35 kDa y 40-45 kDa26,31,32.
En cuanto a proteínas marcadoras de infección encontradas en nuestro trabajo, se observó que las proteínas antigénicas correspondientes a p35, p43, p45, p56, p100 y p107 se asociaron al perfil antigénico de infección aguda; en tanto que las proteínas p65, p95, p98 y p113 se asociaron de manera específica al perfil de infección crónica. Las bandas que fueron visualizadas con mayor frecuencia en la población de estudio correspondieron a las proteínas con peso molecular entre 24-44, 48-60 y 69-72 kDa, de las cuales las proteínas antigénicas p32, p38, p41, p48, p59 y p72 fueron reconocidas por pacientes con infección aguda y crónica, las cuales se podrían considerar como bandas diagnósticas de la enfermedad.
Los métodos serológicos son muy utilizados para el diagnóstico y seguimiento de los pacientes con Toxoplasmosis, en especial en determinadas poblaciones como las mujeres embarazadas y los niños con sospecha de Toxoplasmosis congénita. En algunas ocasiones, las determinaciones de anticuerpos anti-Toxoplasma gondii podrían dar resultados dudosos por lo que es necesario contar con un método confirmatorio como el Western Blot, que emplea proteínas específicas y permite determinar perfiles antigénicos que evidencian la presencia de una infección reciente o la transmisión congénita en los hijos de madres que adquirieron la infección durante la gestación, por lo cual puede ser aplicado en métodos de diagnóstico complementarios aún poco utilizados a nivel nacional.