INTRODUCCIÓN
La enfermedad de Chagas es causada por el parásito Trypanosoma cruzi cuyo vector principal en la Región del Cono Sur de América Latina es el Triatoma infestans. Esta vía de transmisión ha disminuido notablemente en la última década, gracias a las decisiones políticas y técnicas de los países que con actividades sostenidas de control vectorial han logrado el corte de la transmisión intradomiciliar de T. cruzi por esta especie1,2. En la actualidad existe un riesgo permanente de re-infestación de las viviendas desde focos residuales de T. infestans como también el riesgo de la invasión de viviendas por especies secundarias si no se llevan a cabo acciones de vigilancia entomológica sostenidas en el tiempo y espacio2,3. Muchas especies nativas adquieren importancia epidemiológica debido a la capacidad de intercambio entre hábitats selváticos y domésticos, así como por su potencialidad para reemplazar el nicho ecológico de triatominos estrictamente domiciliarios., Luego de la disminución de estas especies por la acciones de control y vigilancia vectorial, adquieren importancia epidemiológica las especies secundarias, entre éstas especies se destaca el T. sordida considerado como vector secundario en la transmisión de T. cruzi2,4. El gran Chaco es una eco-región que incluye Argentina, Bolivia y Paraguay donde la trasmisión vectorial de la enfermedad de Chagas por T. infestans (vector principal) constituye hasta la fecha un problema de salud pública. El Chaco paraguayo ocupa el 25% de esta región, caracterizada por una baja densidad poblacional y localidades dispersas. Según un estudio reciente realizado por nuestro grupo de trabajo se ha evidenciado que la especie T. sordida posee una capacidad adaptativa en el domicilio y se estima un 87% de riesgo de transmisión de T. cruzi intradomiciliar en la Región Occidental2. Existen otros estudios de nuestro grupo realizados sobre la capacidad vectorial de la especie T. sordida provenientes de áreas endémicas de la Región Oriental que reportaron en el departamento de Concepción 44% de colonización intradomiciliar y 10,6% de infección natural5 y en el departamento de Paraguarí 27% de colonización intradomiciliar y 12,5% de infección natural6. En la región del Chaco paraguayo, el control vectorial ha sido limitado por el aislamiento de las viviendas, la persistencia de la infestación doméstica, y las costumbres culturales de los habitantes (tribus indígenas). La detección de infección natural e identificación de la fuente de alimentación de triatominos permite conocer sus huéspedes e indagar sobre su comportamiento y riesgo para transmitir T. cruzi, razón por la cual se propuso realizar este estudio.
MATERIALES Y MÉTODOS
Área de estudio y población: Se analizaron 220 ejemplares de T. sordida capturados entre 2014 y 2016 en 67 viviendas de 24 localidades distribuidos en 8 distritos de los tres departamentos de la Región Occidental o Chaco. En el departamento de Pte. Hayes los ejemplares fueron capturados en 50 viviendas ubicadas en 18 localidades dispersas en 4 distritos; mientras que en Boquerón y Alto Paraguay, los ejemplares fueron capturados en 5 y 12 viviendas, situadas en 4 y 2 localidades de 2 distritos respectivamente. Fueron registrados los datos epidemiológicos como sitio de captura y estadío de los triatominos capturados en las viviendas.
Los ejemplares de T. sordida fueron clasificados taxonómicamente según Lent y Wygodzinsky7.
Disección de triatominos: Se realizó la disección de cada uno de los 220 ejemplares de T. sordida para la posterior extracción de ADN, cada ejemplar disectado fue colocado en tubos que contenían buffer de lisis compuesto por soluciones de Tris pH 7,4, EDTA, NaCl y SDS.
Extracción de ADN: Se realizó la incubación de cada tubo con 5 ul de proteinasa K (20 ug/ml) a 60°C por 60 minutos. La enzima fue inactivada por calentamiento a 95°C por 10 minutos. El ADN fue purificado por el método: fenol-cloroformo descrito por Sambrook et al8, se realizó la precipitación con etanol, previa adición de 20 ug de Glucógeno y Acetato de sodio 3M, pH5,4 en un 10% del volumen recuperado. El ADN se resuspendió en 100ul de agua destilada estéril.
Infección natural con T. cruzi: La identificación especie específica de T. cruzi fue por el método PCR empleando como blanco las secuencias repetitivas de ADN nuclear (microsatélites) de T. cruzi, con los cebadores TCZ1 y TCZ2 descrito por Moser et al9 y ADN kinetoplastídico con cebadores 121 y 122 descrito por Degrave et al.
Los productos amplificados fueron analizados en geles de agarosa al 2%, teñidos con bromuro de etidio y visualizados bajo un transiluminador UV.
Detección de fuente de alimentación: Para la identificación de la fuente de alimento se emplearon los métodos: PCR y RFLP. Se realizó primeramente un PCR que consistió en la amplificación del gen de citocromo b (Cyt b), ADN mitocondrial, se utilizaron los cebadores Cyt b 1 y Cyt b 2 descrito por Osnaghi et al10.
Posteriormente se realizó la digestión de los amplificados de Cyt b con 2 enzimas de restricción: Hae III y Mwo I para la determinación de los patrones de alimentación, se emplearon ADN de 4 especies como controles positivos: humano, ave (gallina), marsupial/roedor y perro según protocolo descrito por Chena et al11. Los productos amplificados fueron analizados en geles de agarosa al 2%, teñidos con bromuro de etidio y visualizados bajo un transiluminador UV.
RESULTADOS
Se analizaron un total de 220 ejemplares de T. sordida colectados de 67 viviendas del Chaco Paraguayo en el período 2014-2016. La captura de los ejemplares en cada vivienda corresponde a una actividad realizada dentro de la vigilancia entomológica del SENEPA (MSP y BS), en localidades previamente fumigadas por la presencia de T. infestans.
En cuanto al lugar de captura y estadío, se observó que el 91% (201/220) de los ejemplares fueron capturados en el peridomicilio de las viviendas y el 55% (111 de 201) eran ninfas. Tan solo 5 de las 67 viviendas infestadas (7,5%) tenían ejemplares de T. sordida en el intradomicilio y en las mismas se encontraron ninfas (colonización) (Tabla 1).
Identificación de T. cruzi: Un total de 38 de 220 ejemplares analizados (17,3%) dieron positivo por PCR para T. cruzi. En la Figura 1 se puede observar amplificados de ADN de T. cruzi con cebadores TCZ1 y TCZ2 con productos de 198pb.
Tabla 1. Distribución de las 67 viviendas infestadas con T. sordida según estadío y lugar de captura de los 220 ejemplares analizados.
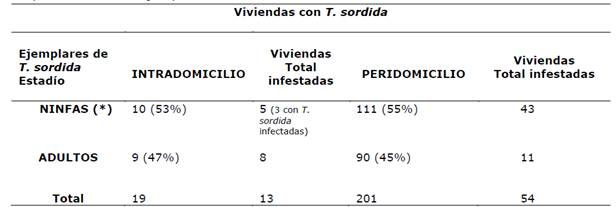
(*) La presencia de ninfas en el intradomicilio de las viviendas es un indicador de colonización.
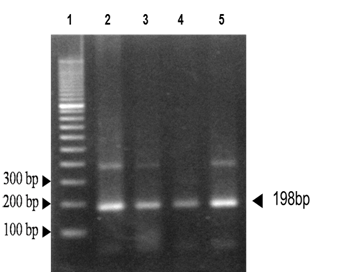
Figura 1. Amplificación de ADN de T. cruzi en T. sordida. Carril 1: Marcador de peso molecular. Carril 2: control positivo de reacción de PCR equivalente a 100 parásitos. Carril 3: control positivo de reacción equivalente a 10 parásitos. Carril 4: muestra de T. sordida con T. cruzi positivo correspondiente a 10 parásitos. Carril 5: muestra de T. sordida con T. cruzi positivo correspondiente a 100 parásitos.
Identificación de fuente de alimentación. La amplificación del gen cyt b fue posible detectar en 13 ejemplares de los 220 analizados (6%), siendo todos del peridomicilio. En la figura 2 se puede observar los amplificados del gen cyt b de los ejemplares de T. sordida con un tamaño correspondiente a 358 bp, posteriormente éstos amplificados dieron con las 2 enzimas de restricción un patrón de sangre de gallina como fuente de alimentación. En la figura 3 se pueden observar los patrones de sangre de gallina obtenidos con la enzima Hae III con productos de 74, 125 y 159 bp.

Figura 2. Amplificación del gen Cyt b en T. sordida. Carril 1: Marcador de peso molecular. Carril 2: muestra de T. sordida; cyt b positiva. Carril 3: control negativo de reacción. Carril 4: muestra de T. sordida positiva. Carril 5: control negativo de extracción de ADN. Carril 6: muestra de T. sordida sin producto amplificado (negativa). Carril 7: control positivo de ADN de la especie ave (gallina). Carril 8: control positivo de ADN humano.
DISCUSIÓN
Los índices de colonización intradomiciliar (38%) y de infección natural con T. cruzi (17,3%) detectados en este estudio son menores a lo constatado en la publicación de nuestro grupo sobre T. sordida del Chaco Paraguayo del 2016, donde se detectaron 52% y 21% respectivamente2, esto tal vez se atribuya al número de viviendas evaluadas. Sin embargo, el riesgo de transmisión intradomiciliar es elevado porque en las 5 viviendas ya se observó colonización de T. sordida, y en 3 de ellas se detectaron ejemplares infectados con T. cruzi, lo cual debe ser observado porque en las comunidades indígenas del Chaco la población humana infectada supera el 50% y las ninfas deben alimentarse para mudar de estadío. Por otro lado la preferencia de T. sordida en el peridomicilio sigue siendo mayor con respecto al domicilio, teniendo en cuenta que de las 67 viviendas infestadas 43 (64%) presentaban como sitio de captura el peridomicilio. Así mismo, la densidad de ejemplares de T. sordida en el peridomicilio es mucho mayor que en el domicilio, 201 triatominos en 54 viviendas y 19 triatominos en 13 viviendas respectivamente; lo que evidencia una adaptación aún muy fuerte de T. sordida al peridomicilio, como ocurre en regiones de Argentina, incluyendo el Chaco Argentino14,15.
La especie T. sordida representa un problema epidemiológico en numerosos países del Cono Sur debido a su amplia valencia ecológica, que se manifiesta en su hallazgo en biotopos silvestres, peridomésticos, así como dentro de la vivienda12-14,19. Con relación a la infección natural con T. cruzi, el índice detectado fue del 17,3%, superior a lo detectado en Argentina por ejemplo, donde se había reportado desde el 2% hasta el 12% de infección natural en ejemplares de T. sordida capturados en el peridomicilio15,16.
La detección de la fuente de alimentación realizada por el método PCR-RFLPC20 con patrón de sangre de gallina se encontró en un 6% de los ejemplares analizados. La detección de sangre de gallina en el peridomicilio y no de roedores silvestres, reduce el riesgo de infección natural en estos ejemplares. En Brasil ya se habían reportado datos similares en cuanto a hábitos alimenticios de ésta especie de triatomino en regiones de ese país18,20. En Paraguay nuestro grupo de trabajo ha realizado varios estudios con T. sordida en lo referente a fuente de alimentación por el método PCR-RFLP del gen cyt b en ejemplares de la Región Oriental, donde por ejemplo en un estudio sobre un total de 216 ejemplares capturados en el departamento de Concepción, 11 dieron cyt b positivos, de los cuales 8 dieron patrón de sangre humana y 1 ejemplar dio sangre de gallina como patrón alimenticio5. Otro estudio del mismo grupo reveló que en un total de 247 ejemplares de T. sordida procedentes del departamento de Paraguarí se detectaron 48 ejemplares cyt b positivos, de los cuales 3 dieron patrón de sangre humana y 45 dieron patrón de sangre de marsupial/roedor6. Recientemente, en un estudio con T. sordida de los departamentos de Paraguarí, San Pedro y Cordillera, se detectaron como fuente de alimentación sangre humana en 11%, 10% y 82% respectivamente17.
Los indicadores entomológicos obtenidos en el presente estudio concuerdan con resultados previos de nuestro equipo, y confirman la capacidad vectorial de este triatomino secundario en la transmisión de la enfermedad de Chagas.















