INTRODUCCIÓN
Las infecciones urinarias son una de las principales causas de consulta y de hospitalización a nivel mundial, reportándose alrededor de 150 millones de casos anualmente, con diferencias en las frecuencias de acuerdo a la edad1. En menores de un año, los porcentajes son de 3,7% en niños y 2% en niñas. En los adultos mayores, la prevalencia de bacteriuria asintomática oscila entre el 10% y el 50%, asociada frecuentemente a bacteriemia1,2.
Las infecciones urinarias varían entre mujeres y hombres, estimándose una razón de 30: 1, conforme se envejece esta razón tiende a igualarse, pero aún, con un ligero predominio del sexo femenino según un trabajo en Asunción en el 20073.
Las nuevas y avanzadas alternativas tecnológicas han permitido la mejora continua en la calidad de los resultados y el establecimiento de tratamientos farmacológicos eficientes para los pacientes. Así el equipo MicroScan AutoScan-4 constituye una herramienta de identificación microbiológica rápida y eficiente para el diagnóstico de las infecciones urinarias. El tiempo máximo para la emisión de resultados es de 72 horas lo que favorece al establecimiento de un tratamiento de manera oportuna evitando el surgimiento de cepas resistentes a los antibióticos empleados empíricamente4.
La frecuencia de aislamiento de patógenos y la resistencia bacteriana varían en grado amplio según sean las diferentes regiones geográficas, incluso entre hospitales del mismo país y ciudad5. Por eso es importante publicar y dar a conocer los patrones y tendencias de sensibilidad para aplicar o intensificar medidas estrictas de vigilancia, control del uso de los antibióticos y facilitar la elección del tratamiento empírico(6, 7).
El objetivo del estudio es identificar y determinar los perfiles de resistencia antimicrobiana de bacterias gran negativas y comparar estos de acuerdo a la especie y procedencia de la muestra.
MATERIALES Y MÉTODOS
Este estudio es de enfoque cuantitativo, con diseño epidemiológico transversal descriptivo. Las muestras fueron procesadas en el Laboratorio de Microbiología del Hospital Central del IPS, durante el período comprendido entre marzo de 2015 a agosto de 2016. Se estudiaron los aislados de enterobacterias de muestras de orina de pacientes ambulatorios y hospitalizados.
Las muestras que presentaron un recuento mayor a 100,000 UFC/mL se procesaron en los paneles del equipo MicroScan AutoScan-4 (Siemens Health care Diagnostics Ltd.), siguiendo las indicaciones del fabricante para su identificación y antibiograma.
Los resultados de la base de datos fueron exportados a una planilla de Excel para su análisis estadístico. Se utilizó estadística descriptiva para resumir los datos de sensibilidad y resistencia de cada antibiótico testado por microorganismo. Además se compararon los perfiles de resistencia de acuerdo al origen de los microorganismos (ambulatorio o internado). Para establecer diferencias entre los porcentajes de resistencia según origen de los aislados se utilizó la prueba chi cuadrado a un nivel de significancia de 0,05.
RESULTADOS
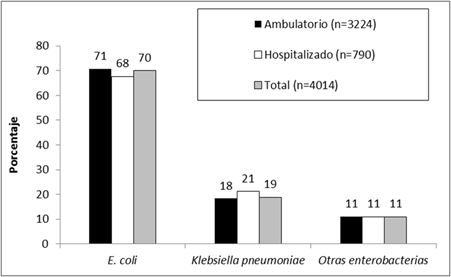
En el período de estudio fueron incluidos 4014 enterobacterias asociadas a infecciones urinarias, de los cuales 2814 (70,1%) aislados correspondieron a la especie E. coli, 759 (18,9%) a Klebsiella pneumoniae y Enterobacter cloacae 111 (2,8%), entre las más frecuentes. En relación al origen de las muestras, 3224 (80,3%) correspondieron a muestras de pacientes ambulatorios, 790 (19,7%) de pacientes internados (Tabla 1).
La distribución porcentual de las dos especies más frecuentes (E. coli y K. pneumoniae) fue similar en muestras provenientes de pacientes ambulatorios e internados (Figura 1).
Perfil de resistencia de los aislados de E. coli
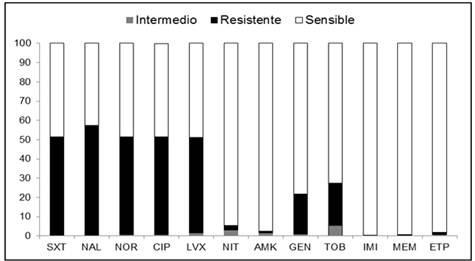
Los aislados de E. coli mostraron alta resistencia a las quinolonas, entre 49,5% a levofloxacina y 50,8% para ciprofloxacina y norfloxacina, el porcentaje de resistencia fue significativamente mayor (p<0,05) en los aislados de pacientes hospitalizados que los ambulatorios. El porcentaje de resistencia a los aminoglucosidos fue menor oscilando entre 0,9% para amikacina a 22,1% para tobramicina. La resistencia al trimetoprim-sulfametoxazol fue de 51,4%, y a la nitrofurantoina fue baja (2,2% de resistencia y 2,8% de intermedio). Los antibióticos a los cuales se encontraron los porcentajes más altos de sensibilidad (>95%) fueron los carbapenems, colistin y fosfomicina (Tabla 2 y Figura 2).
Tabla 2. Perfil de resistencia de E. coli en infecciones urinarias. n= 2814
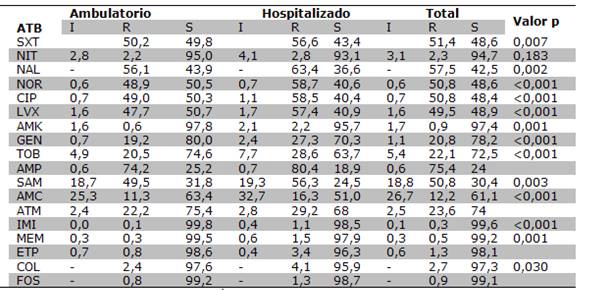
Amikacina (AMK), Gentamicina (GEN), Tobramicina (TOB), Ácido nalidixico (NAL), Norfloxacina (NOR), Ciprofloxacina (CIP), Levofloxacina (LVX), Cefalotina (CEP), Cefuroxima (CXM), Cefotaxima (CTX), Cefepime (FEP), Trimetoprim-sulfametoxazol (SXT), Nitrofurantoina(NIT), Ampicilina (AMP), Ampicilinasulbactam (SAM), Amoxicilina-Ac. Clavulánico (AMC), Aztreonam (ATM), Imipenem (IMI), Meropenem (MEM), Ertapenem (ETP), Colistín (COL), Fosfomicina (FOS)
Perfil de resistencia de los aislados de K. pneumoniae
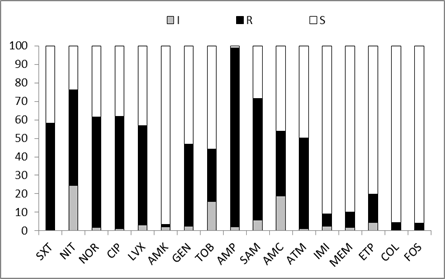
Los aislados de K. pneumoniaemostraron alta resistencia a las quinolonas, de 53,8% a levofloxacina a 60,7% a ciprofloxacina, no hubo diferencia significativa entre los aislados provenientes de pacientes hospitalizados y ambulatorios. El porcentaje de resistencia a los aminoglucosidos fue variable, baja para amikacina (96,7% fue sensible), mayor para tobramicina y gentamicina (55,9% y 53% de resistencia, respectivamente). La resistencia a trimetoprim-sulfametoxazol fue de 58,1%, y a la nitrofurantoina 51,9%. Los antibióticos a los cuales se encontraron los porcentajes más altos de sensibilidad fueron los carbapenems (entre 80% y 90,8%), colistin (95,7%) y fosfomicina (96%).Tabla 3 y Figura 3.
Tabla 3. Perfil de resistencia de los aislados de K. pneumoniae
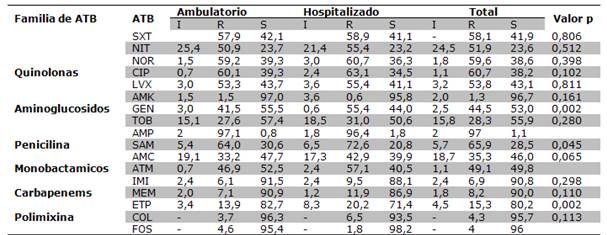
Amikacina (AMK), Gentamicina (GEN), Tobramicina (TOB), Ácido nalidixico (NAL), Norfloxacina (NOR), Ciprofloxacina (CIP), Levofloxacina (LVX), Cefepime (FEP), Trimetoprim-sulfametoxazol (SXT), Nitrofurantoina(NIT), Ampicilina (AMP), Ampicilinasulbactam (SAM), Amoxicilina-Ac. Clavulánico (AMC), Aztreonam (ATM), Imipenem (IMI), Meropenem (MEM), Ertapenem (ETP), Colistín (COL), Fosfomicina (FOS)
Perfil de resistencia de los aislados de otras enterobacterias
Los aislados de otras enterobacterias mostraron alta resistencia a los antibióticos testados. Los antibióticos a los cuales se encontraron los porcentajes más altos de sensibilidad fueron para amikacina 98%, para los carbapenems (MEM 95,9% y ETP 87,3%) y fosfomicina (89,1%)Tabla 4 y Figura 4.
Tabla 4. Perfil de resistencia de las otras enterobacterias
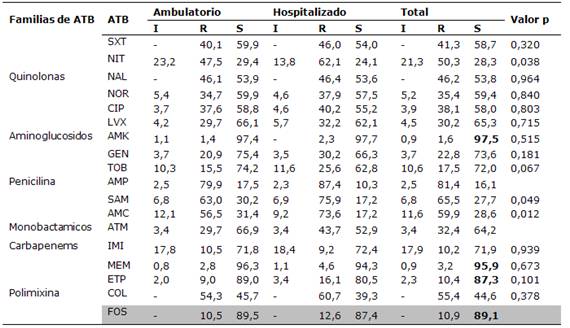
Amikacina (AMK), Gentamicina (GEN), Tobramicina (TOB), Ácido nalidixico (NAL), Norfloxacina (NOR), Ciprofloxacina (CIP), Levofloxacina (LVX), Trimetoprim-sulfametoxazol (SXT), Nitrofurantoina(NIT), Ampicilina (AMP), Ampicilinasulbactam (SAM), Amoxicilina-Ac. Clavulánico (AMC), Aztreonam (ATM), Imipenem (IMI), Meropenem (MEM), Ertapenem (ETP), Colistín (COL), Fosfomicina (FOS)
El perfil de resistencia a las cefalosporina de los uropatógenos estudiados por procedencia se muestra en la Tabla 5 y Figura 5.
Tabla 5. Perfil de resistencia a las cefalosporina de uropatogenos por procedencia de las muestras en porcentajes.
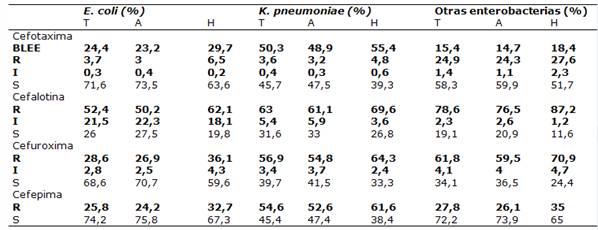
Total: T; Ambulatorio: A;Hospitalizado: H;Resistente pero BLEE negativo: R
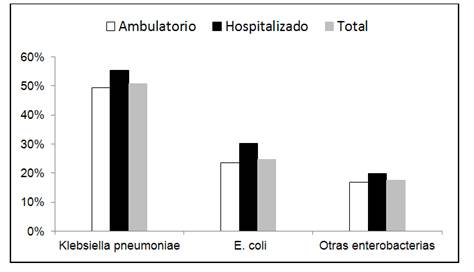
La frecuencia de BLEE en los uropatógenos estudiados se muestra en la Figura 5. La mitad de los aislados testados de K. pneumoniae presentaron BLEE, una cuarta parte de los E. coli.
DISCUSIÓN
Entre las infecciones más importantes del ser humano, la infección urinaria (ITU) constituye un importante problema de salud que afecta a millones de personas cada año. Es la segunda causa de infección más frecuente en los humanos, es solo superada por las infecciones del tracto respiratorio8. En más del 95% de los casos, un único microorganismo es el responsable de la ITU. El agente etiológico más frecuente en ambos sexos es la E. coli, responsable del 75% a 80% de casos; el 20% a 25% restante incluye microorganismos como: Staphylococcus saprophyticus, Proteus mirabilis, Proteus vulgaris, Klebsiella sp., Streptococcus faecalis, Pseudomonas aeruginosa9.
En el presente estudio se evaluaron el perfil de resistencia de las enterobacterias gramnegativas asociadas a infección urinaria, el 70% correspondió a E. coli, agente etiológico más frecuente de ITU. La progresiva disminución de la sensibilidad de E. coli a los antimicrobianos y la aparición y diseminación de resistencias motivan que el tratamiento de las ITU causadas por este microorganismo constituya, en algunos casos, un importante problema terapéutico10. Entre los criterios de elección es importante considerar que el antibiótico presente una baja prevalencia de resistencias bacterianas (<10-20%) y que sea de fácil cumplimiento terapéutico11. Las pautas cortas de tratamiento conllevan ventajas, como son mejorar el cumplimiento del paciente,menor alteración de la flora intestinal, presentar menor toxicidad y reducir el coste económico del tratamiento12. Los antibióticos habitualmente recomendados en las ITU son nitrofurantoína, fosfomicina, cefalosporinas de segunda generación y fluoroquinolonas.
En muchas guías para el manejo de las infecciones urinarias a E. coli, se considera la nitrofurantoína como un antibiótico de primera elección. A pesar de su elevado nivel de eficacia, su uso no está muy extendido para el tratamiento de las ITU13 debido a su toxicidad y su difícil cumplimiento terapéutico. En nuestro estudio, un 94,7% de las cepas de E. coli fueron sensibles a este antibiótico, no observándose diferencias significativas entre ambulatorios y hospitalizados (95% de los ambulatorios y 93,1% de los hospitalizados).
Por su alto porcentaje de sensibilidad, se considera a la fosfomicina como un antibiótico de primera línea en el tratamiento de las ITU. En un estudio realizado en España14 alcanzó el 98% similar a lo encontrado en nuestro estudio (99,1%) tanto para aislados de procedencia ambulatoria como hospitalizada. Además presenta características que favorece su indicación médica, es un bajo inductor de resistencias y una posología cómoda favoreciendo el cumplimiento terapéutico y evita abandonos, causa habitual de recidivas y selección de resistencia antibiótica14.
Las fluoroquinolonas suelen ser efectivas para el tratamiento de las ITU causadas por E. coli en pacientes adultos. Son los antibióticos de primera elección para el tratamiento de las pielonefritis, y se recomienda utilizarlos como medicamento alternativo en los casos de cistitis. Sin embargo, se han observado aumentos paulatinos de las resistencias a las fluoroquinolonas, tanto en el medio hospitalario como en la comunidad14, lo cual podría ser consecuencia de su elevado consumo humano y, probablemente, animal que favorece la diseminación de cepas resistentes entre la población. En el estudio realizado por Andreu et al14 se observaron porcentajes de resistencia a ciprofloxacino a escala nacional en España cercanos al 23% y en la Comunidad de Castilla y León superiores al 32%. Nuestros datos muestran porcentajes mucho más elevados (49% en ambulatorios y 58,5% en hospitalizados), por lo que se desaconseja su utilización como antibiótico de primera elección. La resistencia a las fluoroquinolonas en bacilos Gram negativos es preocupante, ya que se la relaciona con multirresistencia.
Con respecto a la presencia de BLEE, éstas fueron mucho más elevadas en nuestra serie que las encontradas en otros estudios, 25% de los aislados de E. coli en general, 30% de los hospitalarios y 24% de los ambulatorios. La prevalencia de los microorganismos productores de BLEE no ha dejado de aumentar y presenta amplia distribución mundial, aunque con grandes diferencias según las áreas geográficas. Estas cepas están circulando ampliamente entre la población y no están confinadas al ámbito hospitalario15. En nuestro estudio no se observaron diferencias significativas en cuanto a la procedencia hospitalaria o extrahospitalaria.
La asociación entre las cepas productoras de BLEE y la resistencia a otros antibióticos es un hecho constatado. Así, cepas productoras de esta enzima expresan con frecuencia resistencia a quinolonas, trimetoprima-sulfametoxazol y aminoglucósidos10,16,17. En nuestro estudio, un 79%de los aislamientos con BLEE fueron resistentes a ciprofloxacino y un 55,5%, a trimetoprima-sulfametoxazol, por lo que estos antibióticos tampoco estarían recomendados en el tratamiento de ITU por E. coli productor de BLEE. Sin embargo, gentamicina, fosfomicina y nitrofurantoína mostraron buenos porcentajes de sensibilidad y supondrían una alternativa.
Probablemente habrá que diseñar estudios prospectivos para determinar qué factores de riesgo influyen en el aumento de los microorganismos productores de BLEE causantes de ITU, para intentar prevenir su aparición. Ampicilina, quinolonas y trimetoprima-sulfametoxazol presentan altas tasas de resistencia en nuestro medio, por lo que no son recomendables para el tratamiento empírico de las ITU. Sin embargo, los inhibidores de las betalactamasas, las cefalosporinas de segunda generación, la nitrofurantoína y la fosfomicina suponen una buena alternativa.