INTRODUCCIÓN
La vigilancia integrada de patógenos entéricos causantes de enfermedades transmitidas por alimentos tanto para la caracterizacion de la dinámica epidemiológica como para el monitoreo de resistencia a los antibioticos es esencial para generar planes de control, intervenciones, estrategías y políticas de prevención. Asi mismo, es también de suma importancia para evaluar el impacto de programas de inocuidad de alimentos y generar evidencia cientifica para futuros estudios de investigacion de campo y mecanismos de resistencia1.
En 1996, un Comité del FDA recomendó la creación de un sistema de vigilancia para monitoreo de la resistencia a los antibióticos en patógenos transmitidos por alimentos, basado en la vigilancia humana, vigilancia de carnes en el mercado y la vigilancia en fincas y mataderos2.
La campilobacteriosis y la salmonelosis son dos de las enfermedades transmitidas por alimentos reportadas con más frecuencia en todo el mundo, y la carne de pollo es considerada uno de los vehículos alimentarios más importantes para ambas. La problemática de estas enfermedades y el costo de las medidas de control son altamente significativos en muchos países; por ello la contaminación con Campylobacter spp. y Salmonella spp. de origen animal tiene el potencial de afectar severamente el comercio entre los países. La cadena alimenticia es considerada una ruta importante para la aparición y propagación de resistencia entre animales y seres humanos1,3.
La infección por Campylobacter spp. en humanos ha sido catalogada como una zoonosis, teniendo como reservorio más importante a las aves de corral, en las que forma parte de la microbiota intestinal. Se encuentra en el intestino de animales domésticos como aves, bovinos, ovinos y porcinos y se describe que 90% de las aves de corral son portadoras de Campylobacter spp, que no afecta su crecimiento y es una de las principales fuentes de infección con C. jejuni/coli en humanos tanto en la manipulación como en el consumo de carne contaminada4. La portación como reservorio de esta bacteria en las aves de consumo genera uno de los eslabones epidemiológicos principales de contagio humano y vía de diseminación5-7. Se asocian los casos de diarreas en humanos con la ingesta de pollo o se deben a contaminación cruzada con otros alimentos; incluso se ha demostrado que Campylobacter spp. puede sobrevivir varias horas entre los surcos de las tablas utilizadas para picar y cortar alimentos8. En las últimas décadas, las especies termotolerantes de Campylobacter han adquirido gran importancia en salud pública, particularmente como agentes de diarrea infecciosa para el ser humano9.
El diagnóstico de Campylobacter spp. se basa normalmente en el análisis microbiológico, examen de las colonias, realización de pruebas bioquímicas, y confirmación de las especies predominantes por métodos moleculares estandarizados11. En nuestro país el aislamiento del Campylobacter spp. no es rutinario por ser un proceso engorroso, de alto valor monetario y por la falta de implementación de las técnicas de diagnóstico. La referencia Nro. 10 no se menciona antes de la 11.
Campylobacter spp. es sensible a diversas clases de antimicrobianos, incluido macrólidos como eritromicina y fluoroquinolonas como ciprofloxacina, siendo estos fármacos considerados de primera línea a la hora de aplicar el tratamiento clínico en casos graves, aunque en la mayoría de los casos no es necesaria la terapia con antibióticos12,13. En los años noventa aumentaron las resistencias antimicrobianas, especialmente las debidas a los mecanismos de resistencia plasmídicas a fluoroquinolonas del tipo qnrS dada por una mutación en el ADN girasa así como a la tetraciclina (droga utilizada anteriormente como de elección) que presenta una resistencia mediada principalmente por plásmidos13. Algunos estudios sugieren que las cepas de Campylobacter spp. resistentes a esta droga se seleccionan primero en animales y desde allí pueden ser transferidas al ser humano y su entorno, como se observa con el uso indiscriminado de antimicrobianos en aves con fines terapéuticos, profilácticos o lo que es peor como promotores del crecimiento pueden estar asociados con el incremento de cepas resistentes pudiendo conducir a fallos en el tratamiento de las diarreas producidas por estos microorganismos en el hombre13,14.
La salmonelosis se manifiesta en humanos como una gastroenteritis o enterocolitis aguda de inicio repentino, cuyos síntomas aparecen de 6 a 48 horas después de la ingestión de alimentos o agua contaminada y se transmite principalmente por el consumo de productos avícolas contaminados o por contaminación cruzada a través de manipuladores de alimentos o utensilios de cocina pudiendo ocasionar brotes que afectan a centenares de personas alrededor del mundo. Los brotes por Salmonella spp. asociados al consumo de alimentos elaborados con huevo crudo siguen siendo frecuentes a pesar de conocerse el riesgo que representa su consumo, de las medidas adoptadas y de los programas de educación sanitaria15.
La salmonelosis en animales de granja es un problema mundial importante, no sólo por las pérdidas económicas sustanciales que produce por mortalidad directa, de acuerdo con la serovariedad involucrada, sino también por la merma de ganancia de peso y los costos de prevención y control. Además, indirectamente por el estado de portador que lleva a la transmisión y ocurrencia de casos en humanos16,17.
En Salmonella spp. se han descrito mutaciones en los genes que codifican la ADN-girasa, y muy recientemente en el par C habiéndose comprobado la importancia de la hiperexpresión de bombas de expulsión activa. Aunque también se han detectado alteraciones en las proteínas de la membrana externa, aún no se ha podido demostrar la correlación directa entre la ausencia de ciertas porinas y la resistencia a fluoroquinolonas19. La resistencia a ampicilina se debe principalmente a la producción de las betalactamasas TEM-1, TEM-2, PSE-1, OXA-1 o SHV-1, habiéndose descrito una baja incidencia de betalactamasas de espectro extendido o de cefamicinasas plasmídicas20.
Con este trabajo queremos dar a conocer los primeros resultados obtenidos en el país de la vigilancia integrada de la resistencia antimicrobiana en cepas aisladas de muestras clínicas de humanos, heces cloacales de aves de corral y muestras alimenticias de pollos procesados y no procesados de Salmonella spp., y Campylobacter spp.
MATERIALES Y MÉTODOS
Las muestras de heces se obtuvieron de pacientes de todas las edades, con síndrome diarreico agudo, que concurrieron al Laboratorio Central de Salud Pública en el periodo de octubre 2011 a abril 2012. Para la recolección de las mismas, se procedió según el manual de Salmonella spp., y Campylobacter spp. del WHO Global 2007. Las muestras de heces cloacales fueron recolectadas para el estudio de aves de corral próximas al momento de sacrificio de distintos frigoríficos por la Sección Aves de la Facultad de Veterinaria de la Universidad Nacional de Asunción, y fueron remitidas al Laboratorio Central de Salud Pública para la identificación de especie y estudio de resistencia antimicrobiana en el periodo de octubre a diciembre de 2011, según el manual de Salmonella spp., y Campylobacter spp. del WHO Global 2007. Se recolectaron 60 muestras de carnes de pollo procesadas y no procesadas, y se procedió al aislamiento de Salmonella spp. según ISO/FDIS6579:2002 y para Campylobacter spp. según las normas ISO10272-1:2006 a cargo de Instituto Nacional de Alimentación y Nutrición (INAN). Posteriormente, las cepas aisladas fueron remitidas al Laboratorio Central de Salud Pública para la identificación de especie y estudio de resistencia antimicrobiana, en el periodo de octubre de 2011 a abril de 2012. Hay confusión respecto a las muestras de heces que fueron remitidas a LCSP de octubre a diciembre 2011 para identificación de especie y estudio de resistencia y luego dice nuevamente que las cepas aisladas fueron remitidas al LCSP de octubre 2011 a abril 2012
Caracterización fenotípica y genotípica de Campylobacter spp. Para la identificación de especie, se realizó la prueba de hidrólisis de hipurato y la hidrólisis de 2, 3,5 cloruro trifeniltetrazolio según el manual de Campylobacter spp. del WHO Global y la confirmación de especie por Reacción en Cadena de la Polimerasa de punto final múltiplex (PCR), previamente estandarizada. Se utilizaron primers diseñados específicamente para amplificar e identificar especies más predominantes como son C. jejuni/coli, según protocolo de Farace et al.11.
Prueba de resistencia antimicrobiana. La determinación de la concentración inhibitoria mínima (CIM) se realizó según las recomendaciones de estandarización dada por la CLSI en agar Mueller - Hinton sangre oveja para eritromicina y ciprofloxacina.
Caracterización de Salmonella spp.
Identificación de serotipos. Las cepas de Salmonella spp. fueron serotipificadas por aglutinación tanto de los antígenos somáticos y flagelares de la marca Denka Seiken, según el esquema de Kauffman y White.
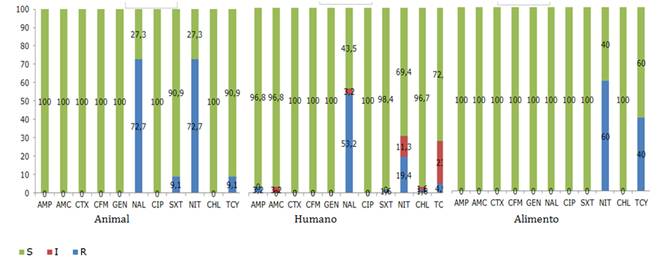
Prueba de resistencia antimicrobiana. La prueba de sensibilidad de Salmonella spp. se realizó según recomendaciones de estandarización dada por la CLSI para difusión en discos frente a los siguientes antimicrobianos: ácido nalídixico 30 ug. (NAL), amoxicilina-ácido clavulánico 20/10 ug. (AMC), ampicilina 10 ug. (AMP), cefixima 5 ug. (CFM), cefotaxima 30 ug. (CTX), ciprofloxacina 5 ug. (CIP), cloranfenicol 30 ug. (CHL), gentamicina 10 ug. (GEN), nitrofurantoina 300 ug. (NIT), tetraciclina 30 ug. (TCY), y trimetoprim-sulfametoxasol 0.125/23.75 ug. (SXT).
RESULTADOS
De 60 muestras de alimentos procesados y no procesados, el 13% fue positiva para Campylobacter spp., y 7% para Salmonella spp. De 488 muestras de heces de humanos procesadas por cultivo, 20% fue positiva para Campylobacter spp y 13% (n=62) para Salmonella spp. y en la población de aves de corral, de 350 muestras de cloaca de pollo, 55% fue positiva para Campylobacter spp y 3% para Salmonella spp. (Figura 1).
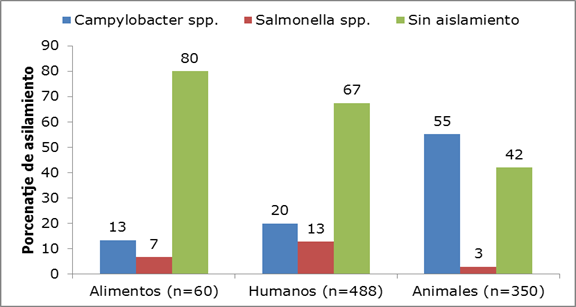
Figura 1. Prevalencia de Salmonella spp. y Campylobacter spp. en muestras clínicas (heces), alimentos (procesados y no procesados) y animales (heces cloacales)
La especie C. jejuni se presentó con mayor frecuencia en las tres poblaciones estudiadas. Con respecto a la Salmonella, el serotipo S. ser. Enteritidis fue el más frecuente en humanos y animales. Seguido del S. ser. Newport (Tabla 1).
Tabla 1. Especies de Campylobacter y serotipos de Salmonella spp.en muestras clínicas (heces), alimentos (procesados y no procesados) y animales (heces cloacales)
| Microorganismos | Alimento | Humano | Animal |
|---|---|---|---|
| Campylobacter spp. | |||
| Campylobacter jejuni | 6 (75%) | 88 (90,7%) | 188 (97,4%) |
| Campylobacter coli | 2 (25%) | 9 (9,3%) | 5 (2,6%) |
| Total | 8 | 97 | 193 |
| Salmonella serotipos | |||
| Salmonella ser. Enteritidis | - | 37 (59,7%) | 4 (40%) |
| Salmonella ser. Newport | - | 7 (11,3%) | 3 (30%) |
| Salmonella ser. Typhimurium | - | 3 (4,8%) | - |
| Salmonella ser. Agona | - | 1 (1,6%) | - |
| Salmonella ser. Anatum | - | 1 (1,6%) | - |
| Salmonella ser. Derby | - | 1 (1,6%) | - |
| Salmonella ser. Typhi | - | 3 (4,8%) | - |
| Salmonella ser. Sandiego | - | 1 (1,6%) | - |
| Salmonella ser. Saintpaul | - | 1 (1,6%) | 1 (10%) |
| Salmonella ser. Poona | - | 1 (1,6%) | - |
| Salmonella ser. Paratyphi | - | 1 (1,6%) | - |
| Salmonella ser. Mbandaka | 1 (25%) | 1 (1,6%) | - |
| Salmonella sp | 2 (50%) | 4 (6,4%) | - |
| Salmonella ser. Albany | 1 (25%) | - | - |
| Salmonella ser. Schwarzengrund | - | - | 2 (20%) |
| Total | 4 | 62 | 10 |
Con respecto a la resistencia antimicrobiana de Campylobacter spp., en todas las poblaciones se observó una alta resistencia a ciprofloxacina, seguida de una resistencia baja o nula a eritromicina que son las drogas de elección para el tratamiento (Figura 2).
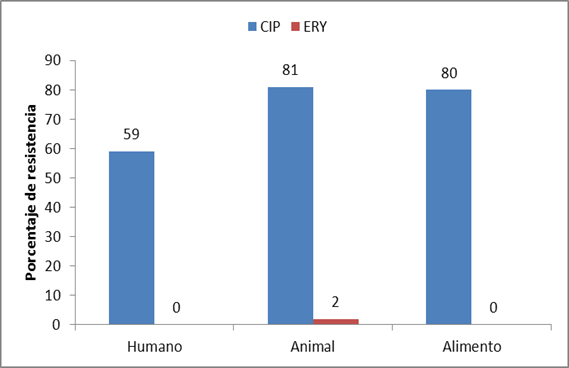
Figura 2. Frecuencia de resistencia a ciprofloxacina y eritromicina de Campylobacter spp., en humano, animal y alimento.
En cuanto a los perfiles de resistencia para los distintos serotipos de Salmonella, en las tres poblaciones en estudio se observaron resistencia a nitrofurantoina y tetraciclina variando nuevamente según serotipo. Así mismo se observó una alta resistencia a ácido nalidíxico en las poblaciones humana y animal, y resistencia a ampicilina, cloranfenicol, trimetoprim-sulfametoxasol y amoxicilina-ácido clavulánico solo en la población humana (Figura 3).
DISCUSION
En observación a los resultados obtenidos en cuanto a la diferenciación de especie existió una mayor prevalencia de C. jejuni que de C. coli en todas las poblaciones muestrales estudiadas, lo que coincide con los trabajos realizados por Garcia et al.21) y Tamborini et al.(22). En Salmonella spp., la tipificación arrojó una gran variedad de serotipos prevaleciendo S. ser. Enteritidis en dos de las poblaciones estudiadas (humanos y animales), coincidiendo con Quesada et al.23.
En cuanto a la resistencia antimicrobiana de Campylobacter spp. en las poblaciones muestrales frente a los antimicrobianos de elección en el tratamiento de síndrome diarreico agudo atribuido a la bacteria entérica en estudio, se observó un alto porcentaje de resistencia a la fluoroquinolona (ciprofloxacina) en todas las poblaciones estudiadas, lo que coincide con varios estudios como el realizado en Canadá por Gaudreau et al.24, y en Chile por Rivera et al.12 y Gonzalez et al.14. Así mismo en Grecia, Marinou et al.25 reportaron en cepas de Campylobacter spp. aisladas de muestras de animales un 2% de aislamiento y resistencia a eritromicina. Aquino et al.26 en Brasil reportaron una resistencia de 18,2% tanto de eritromicina y ciprofloxacina en muestras de animales y humanos. Tamborini et al.22 en Argentina en un estudio realizado en pacientes y animales domésticos detectaron resistencia a ciprofloxacina del 65%. Esto podemos atribuir a una acumulación de mutaciones debido al uso del ácido nalidíxico como antimicrobiano terapéutico y profiláctico utilizado en la producción de aves destinadas al consumo humano.
En Salmonella spp., la resistencia antimicrobiana reportada en varios estudios afecta a los diferentes grupos de antimicrobianos como betalactamicos, aminoglucosidos, fluoroquinolonas, entre otros, Camacho et al.20, reportaron que el 61% de las cepas estudiadas de Salmonella spp. presentó resistencia a al menos 1 antibiótico. Medeiros et al.27, en un estudio realizado en Brasil, en carcasas de aves encontraron una prevalencia de Salmonella spp. del 2,7%, donde el 53% fueron cepas multidroga resistentes. Donado et al.28 en Colombia reportaron en carne de pollos un 37% de Salmonella spp., y el 35,2% fueron resistentes a 1 a 5 antimicrobianos. Estos datos resultan preocupantes por el uso de los antibióticos en la crianza y vigilancia veterinaria de las aves de corral tanto domésticas como industriales que estaría limitando las alternativas terapéuticas en humanos. A diferencia de lo reportado en estos estudios en este se encontró sensibilidad de 100% frente a betalactámicos, aminoglucósido y fluoroquinolona, sin embargo, se obtuvo elevada resistencia al ácido nalidixico en aislados provenientes de animales y humanos. Ribeiro et al.29 encontraron una alta resistencia a tetraciclina y nitrofurantoína en la población aviar. Quesada et al.23, en su trabajo con alimentos de origen animal, reportaron alta resistencia a tetraciclina, así mismo, Rivera et al.30 en un trabajo realizado en carnes de aves importadas encontró alta resistencia a tetraciclina, coincidiendo con nuestro trabajo.
Debido a la resistencia a ácido nalidixico encontrada, se debería estar alerta y aumentar la vigilancia para evitar que pronto se registren resistencias a fluoroquinolonas, droga de elección para el tratamiento de las gastroenteritis en adultos en Paraguay
La resistencia antimicrobiana de Salmonella spp., encontrada en este estudio, concuerda con los trabajos de Camacho et al.20; Medeiros et al.27 y Donado et al.28.
Es importante fortalecer la vigilancia integrada de la resistencia antimicrobiana en estas tres poblaciones tanto animales, como en alimentos y humanos, además de incluir el ambiente como factor determinante, de manera a detectar en forma temprana y oportuna bacterias con mecanismos de resistencia que pudieran afectar al ser humano a través de la cadena alimentaria; y generar acciones de prevención y control ante el uso de los mismos.