INTRODUCCIÓN
La enfermedad de Chagas es una zoonosis causada por el hematozoario Trypanosoma cruzi. Es una endemia de muy amplia distribución afectando a 21 países de América especialmente a poblaciones rurales siendo un factor restrictivo para el pleno desarrollo económico de la región1.
Se transmite al humano y otros mamíferos a través de insectos triatomíneos infectados, transfusión de sangre infectada, por vía transplacentaria, trasplante de órganos, vía digestiva entre otras. Los reservorios del parásito son mamíferos domésticos y silvestres2-5. Se ha reportado ocasionalmente contagios por ingestión de sustancias contaminadas o infección accidental en el laboratorio6.
La Organización Mundial de la salud (OMS) en los Estándares de Trabajo para Servicios de Sangre indica como norma que los servicios de sangre examinen como mínimo cada donación determinando anticuerpos contra T.cruzi7,8.
Se recomienda que al menos, se realicen dos pruebas en paralelo que utilicen antígenos o principio distinto, debido a la diversidad inmunogénica de las diferentes cepas del parásito, la respuesta inmunitaria de los pacientes y la existencia de reacciones cruzadas con otros tripanosomatidos que coexisten en las áreas endémicas9.
En Paraguay, siguiendo con esta normase realiza el tamizaje de anticuerpos contra T.cruzi en todos los donantes en bancos de sangre, mediante la determinación de la presencia de anticuerpos IgG contra T. cruzi por varios métodos, entre ellos el ELISA10.
Debido a la alta prevalencia de la enfermedad de Chagas y el riesgo de adquirir una infección por T. cruzi a través de una transfusión de sangre de donantes infectados impulsó al desarrollo de un kit de ELISA para el diagnóstico de la enfermedad a nivel local en el Instituto de Investigaciones en Ciencias de la Salud de la Universidad Nacional de Asunción con el apoyo de la Cooperación Técnica Alemana (GTZ)11. Este kit es el único de producción nacional y se viene utilizando en el país desde 1987 inclusive a nivel nacional por el Programa de Control de la Enfermedad de Chagas para el tamizaje en áreas endémicas12 y también para el control de la transmisión congénita13. El Chagas test IICS fue evaluado junto con otros kits comerciales en 1994 en el banco de sangre de Chile demostrando una excelente especificidad y sensibilidad mencionando que el ELISA es eltest recomendado para la detección de Chagas.14
Para validar la calidad de los resultados obtenidos en el diagnostico serológico es esencial implementar controles tanto internos como externos, además el laboratorio debe realizar una elección adecuada de los test de diagnósticos antes de implementar su utilización en la rutina diagnóstica diaria15,16. El ELISA Chagas test IICS V.1 ha sido evaluado en el Programa de Control de Calidad Externo en Serología (PCECS)de la Fundação Pró-Sangue/Hemocentro de São Paulo Brasil donde se mide el desempeño de los laboratorios que hacen el tamizaje serológico en bancos de sangre desde el año 1996, con 2 evaluaciones al año. La herramienta de trabajo es un panel de sueros que se envía a todos los participantes del programa para ser procesado como si fuese un conjunto de muestras17.
Cuando el tamizaje serológico lo ejecutan de modo adecuado profesionales capacitados, siguiendo las buenas prácticas de laboratorio y utilizando pruebas diagnósticas de buena calidad e instrumentos bien calibrados, se obtienen resultados precisos y confiables, capaces de mantener el riesgo de transmisión de enfermedades dentro de límites aceptables17.
Entre las múltiples ventajas de la utilización del ELISA Chagas test IICS V.1 está su alta sensibilidad y especificidad 97% y 99% respectivamente evidenciado en un estudio realizado por la Fundação Pró-Sangue/Hemocentro de São Paulo, Brasil en donde se comparó varios kits provenientes de países de América Latina, con sueros caracterizados positivos y negativos por distintos métodos18, más la garantía de un suministro continúo dado que es de producción local, debemos destacar también que pueden ser utilizados en trabajos de campo, donde no necesita de instrumentación y las lecturas pueden realizarse a simple vista.
Dado la diversidad de kits empleados para el diagnóstico de la enfermedad de Chagas en los laboratorios públicos y privados del país, se realizó el presente trabajo que tuvo como objetivo comparar el ELISA Chagas test IICS V.1 con kits comerciales y analizar los resultados de la evaluación externa e interna del kit. ELISA Chagas test IICS V.1.
MATERIALES Y METODOS
Diseño del estudio: observacional de pruebas diagnósticas en el que se comparó el desempeño del Kit Chagas test-IICS V.1 con otros dos kits comerciales: BiosChile Test ELISA y Chagatest ELISA recombinante v 3.0 de Wiener.
Comparación con kit comerciales
Se seleccionaron 56 sueros de pacientes proveídos por el Centro Nacional de Trasfusión Sanguínea: 33 positivos y 23 negativos para T. cruzi, por el ELISA BiosChile para Chagas. Los sueros debidamente codificados se encontraban almacenados en la serotecadel departamento de Producción.
Los kits comerciales utilizados fueron ELISAs indirectos BiosChile Test ELISA para Chagas III(r) (Laboratorios BiosChile, Santiago-Chile y Chagatest ELISA recombinante v 3.0 (Laboratorios Wiener, Rosario-Argentina).Todos los ensayos se realizaron siguiendo las instrucciones de los fabricantes de cada kit. La reactividad de cada una de las muestras se determinó según las especificaciones técnicas de cada kit.
El kit Chagas test-IICS V.1 es un ELISA indirecto que detecta IgG anti-T. cruzi, utiliza placas de 96 pocillos, que consisten en 12 tiras individuales con 8 pocillos(NUNC(r)) sensibilizadas con antígeno soluble de epimastigote de T.cruzi de la cepa Ypsilon. Las muestras y controles se emplean en una dilución 1/50 tampón de incubación (PBS)y se incuban por 30 min. a temperatura ambiente (TA). Después se lavan dos veces con tampón de lavado (PBS-Tween) y se añade el conjugado anti IgG-POD y se vuelve a incubar 30 min. a TA. Posteriormente se lavan tres veces con tampón de lavado y se agrega el sustrato ABTS (2,2- azino-bis (3 ethylbenzothiazoline 6 sulfonicac) diammoniumsalt) incubándose por 20 min. a TA y se detiene la reacción con Teepol 610. La lectura de la densidad óptica se realiza en el lector de ELISA a 405 nm (BioRad 550) pero es posible discriminar mediante lectura visual11.
La concordancia entre el kit Chagas test-IICS V.1 de producción local y los kits comerciales, y, entre los dos kits comerciales, se estableció mediante los valores del índice kappa calculado con el paquete estadístico Epi-dat versión 3.1 para Windows. La interpretación de los valores del índice kappa se realizó según las recomendaciones de Landis y Koch: concordancia pobre =0, leve entre 0 y 0,20, baja entre 0,21 y 0,40, moderada entre 0,41 y 0,60, buena entre 0,61 y 0,80, casi perfecta entre 0,81 y 1,00.19
Evaluación externa
Con el apoyo de la OPS se desarrolló el Programas de control externo de la calidad en serología en América Latina desde 199417, donde el IICS participa desde 1996. Las 450 muestras utilizadas en este estudio provenían de multipaneles de sueros del "Programa de Evaluación Externa de Desempeño en Serología" de la Fundação Pró-Sangue/ Hemocentro de São Paulo de los años 2001 al 2012. Cada evaluación estaba compuesta por 24 muestras de sueros con diferentes reactividades a los marcadores obligatorios en el tamizaje serológico de donantes de sangre (Chagas, Sífilis, Hepatitis B y C, HIV, HTLV) incluyendo muestras negativas para estas patologías.
La producción de los multipaneles fue realizada en el Departamento de Control de la Calidad de la Superintendencia de Serología de la Fundação Pró-Sangue/Hemocentro de São Paulo, por recalcificación de plasma, utilizando Bronidox-L como conservante. Se utilizaron diversas pruebas de marcas diferentes, entre ellas pruebas de confirmación, de modo que el grado de seguridad para caracterizar cada muestra como positiva o negativa fuese lo mayor posible15.
El Programa de Evaluación Externa utilizó los siguientes criterios para la evaluación:
A: Resultados correctos, sin resultados Falsos Positivos y Falsos Negativos
B1: Fueron observados resultados "Falsos positivos" (<5% del total de determinaciones efectuadas)
B2: Fueron observados resultados "Falsos positivos" (>5% del total de determinaciones efectuadas)
C: Detección de resultados Falsos Negativos
Evaluación interna
El control interno evalúa la precisión del kits20. Se utilizó un suero control interno de baja reactividad que consiste en un pool de sueros pertenecientes a donantes que fueron testados como positivos para T. cruzi en el tamizaje serológico de los donantes y descartados por el banco de sangre del Centro Nacional de Transfusión Sanguínea, teniendo en cuenta los criterios de aceptación:
El índice de relación de positividad que es la relación entre la densidad óptica (DO) y el punto de corte (CO) debe presentar: DO/CO > 1 entre un rango recomendado de 2,0 a 4,521
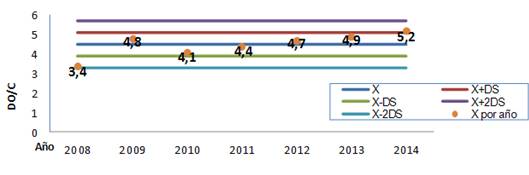
La carta control Levey-Jennings fue construida con los valores de DO de 20 corridas de diferentes días. Los valores de los resultados del suero control interno se incorporaron diariamente en la carta control. Los valores de DO obtenidos se promediaron por año y estos fueron marcados en la carta control para ser evaluados del 2008 al 2012.
Se analizaron los valores del promedio de DO obtenidos del suero control interno por las reglas de Shewhart que expresan que aproximadamente el 95% de los resultados tienen que encontrarse dentro del intervalo ± 2DS para decidir si se acepta la corrida22.
Para la precisión interensayo del kit Chagas test-IICS V.1 se determinó el CV (coeficiente de variación) por año, con el criterio de aceptación de que el mismo no debe superar el 20%23.
RESULTADOS
Se realizó la comparación del kits Chagas test IICS V.1 con los kits comerciales con 56 sueros positivos y negativos para la enfermedad de Chagas, obteniéndose una concordancia con el Chagastest ELISA (Wiener) de 0.89 con IC (intervalo de confianza) de 95% (0,76-1) y con el BiosChile Test ELISA para Chagas III de 0,92 con IC 95% (0,82-1), que indica una concordancia casi perfecta o excelente entre 0,81 y 1,00 según el Índice kappa de Landis y Koch, en cuanto a la concordancia entre BiosChile Test ELISA para Chagas III y el Chagastest ELISA (Wiener) es de 0.85 con IC 95%(0.6-1.1). En la Tabla 1 se observan las concordancias obtenidas entre los kits estudiados. En la Figura 1 se muestra las desviaciones ópticas (DO) obtenidas del Chagastest ELISA (Wiener), BiosChile Test ELISA para Chagas III y el kit Chagas test-IICS, se observa una DO de los sueros positivos, relativamente mayor en el Chagastest ELISA (Wiener) con respecto a BiosChile Test ELISA para Chagas III y el kit Chagas test-IICS V.1, en cambio los DO de los sueros negativos tienen un comportamiento similar en los tres kits, aunque se observan algunos discordantes.
Tabla 1 Comparación entre
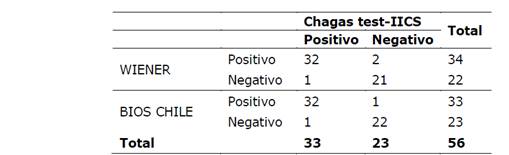
Concordancia: BiosChile-IICS: 0,92 IC 95% (0,82-1)
Wiener-IICS: 0,89 IC95% (0,76-1)
BiosChile-Wiener: 0,85 IC95% (0,6-1,1)
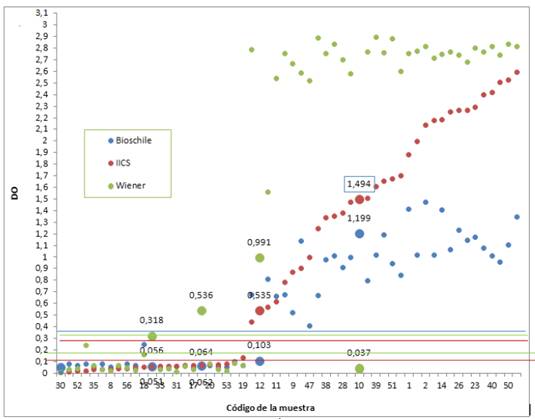
Figura 1 Distribución de la Desviación Óptica (DO) de las muestras por los tres kits utilizados en el estudio y sus respectivos puntos de corte (CO).
En cuanto a la evaluación externa de las 450 muestras analizadas, 372 fueron negativas y 78 positivas para la enfermedad de Chagas, obteniéndose una calificación "A", dentro del "Programa de Evaluación Externa de Desempeño en Serología" de la Fundação Pró-Sangue/Hemocentro de São Paulo.
En la evaluación interna, la media de los valores de la relación de positividad DO /CO del suero control interno fue de 4,5 +/- 0,59 y el CV de 13%. En la Figura 2 se observa la distribución de los valores de los promedio por año.
DISCUSIÓN
En este estudio se comparó la capacidad de detección de anticuerpos anti T. cruzi del Kit de Chagas test IICS V.1, con los kits comerciales Chagastest ELISA (Wiener) y con el Bios Chile Test ELISA para Chagas III y hemos encontrado excelente concordancia con estos kits, que son utilizados en laboratorios públicos y privados de nuestro país por su alta sensibilidad y especificidad mayor al 99%24. Los discordantes obtenidos en el estudio pudieran deberse a los distintos tipos de antígenos utilizados por los ELISAs,25 lo cual se debería ser confirmado por otro método.
El método ideal es aquel que alcanza exactitud en los análisis y la mantiene a través del tiempo26, los resultados obtenidos con el ELISA Chagas test en el "Programa de Evaluación Externa de Desempeño en Serología" de la Fundação Pró-Sangre/Hemocentro de São Paulo fueron óptimos, no presentando falsos positivos ni falsos negativos en más de 10 años de evaluación avalando como confiable para el diagnóstico. Los métodos basados en enzimo inmunoanálisis (ELISA) muestran un mejor desempeño que los métodos basados en técnicas de aglutinación o inmunofluorescencia dado que dependen de la destreza del operador y de la subjetividad en la lectura16. Además ha demostrado tener una muy buena concordancia con los demás métodos utilizados en el programa de evaluación externa en forma indirecta ya que este programa evaluó las muestras enviadas por varios métodos de diferentes fundamentos tales como hemaglutinación indirecta (HAI) o la inmunofluorescencia indirecta (IFI) y otros ELISAs para el diagnóstico de Chagas.
Con respecto a la evaluación del suero control interno, en el kit de Chagas test IICS V.1 presenta buena precisión y exactitud los valores promedios obtenidos cada año fue de un CV del 13%, muy por debajo del límite superior del 20% recomendado por el control de calidad en tamizajes de muestras de banco de sangre27 indicando una buena precisión del kit.
La participación en programas de evaluación externa de calidad e implementación de un control de calidad interno y buenas practicas del laboratorio ha permitido alcanzar un nivel optimo en el desempeño del Kit de Chagas test IICS V.1.
La implementación de un kit de diagnóstico en el laboratorio de análisis clínico requiere la evaluación previa del mismo, a fin de establecer su desempeño y, por ende su aptitud para ser utilizado de manera segura y confiable28,29.El Chagas test IICS V.1 ha demostrado reunir los requisitos necesarios para ser empleado en el diagnóstico de la enfermedad, además de ser el único test de fabricación Nacional que cuenta el país para esta enfermedad lo cual facilita la adquisición continua del mismo para los laboratorios a nivel nacional y de aplicación sencilla para todos los niveles de complejidad laboratorial tanto en el interior como en la capital del país, sin embargo se ha visto la necesidad de seguir implementando mejoras al kit para que este pueda ser también aplicados a sistemas automatizados.