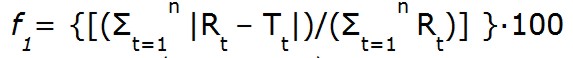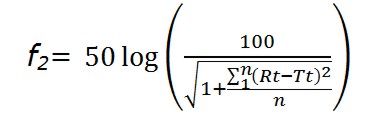Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Memorias del Instituto de Investigaciones en Ciencias de la Salud
versión On-line ISSN 1812-9528
Mem. Inst. Investig. Cienc. Salud vol.14 no.2 Asunción ago. 2016
https://doi.org/10.18004/Mem.iics/1812-9528/2016.014(02)53-060
Articulo Original/ Original Article
Evaluación comparativa entre los perfiles de disolución de comprimidos similares de Lamotrigina de 25mg y el fármaco innovador, comercializados en Paraguay
Evaluation comparative between dissolution profiles of tablets 25mg Lamotrigine similar and innovative drug, traded in Paraguay
Sonia Lorena Fretes de AquinoI*, Marta Vázquez MesaII, Gladys Beatriz Lugo RodríguezIII
I Facultad de Ciencias Químicas, Universidad Nacional de Asunción. Paraguay
II Departamento de Ciencias Farmacéuticas, Facultad de Química, Universidad de la República. Uruguay
III Cátedra de Farmacia Clínica y Atención Farmacéutica, Facultad de Ciencias Químicas, Universidad Nacional de Asunción. Paraguay
R E S U M E N
La epilepsia es la enfermedad neurológica más frecuente en el mundo, esta situación impulsó el desarrollo de nuevos fármacos anticonvulsivantes (FAE) como lamotrigina (LMT) que presenta un elevado costo económico para la población con crisis convulsivas. El propósito del estudio fue comparar los perfiles de disolución de comprimidos de LMT de 25 mg (Test) comercializados en Paraguay y la Referencia (Lamictal®). Se tomaron productos de LMT 25mg comprimidos, con registros sanitarios vigentes y comercializados en Paraguay, realizándose los controles de calidad acorde a criterios generales de las farmacopeas oficiales. Posteriormente, se determinó la cinética de disolución de los productos Test y Referencia, en los 3 medios de disolución recomendados (pHs 1,2 ; 4,5 y 6,8). Los perfiles de disolución de los productos evaluados de LMT, presentaron comportamientos similares a los diferentes pHs, liberando más del 85% a los 15 minutos en los 3 medios de disolución, no siendo necesario la comparación con la prueba f1 y f2. Se concluye que la cinética de disolución de los comprimidos de LMT de 25mg analizados, mostraron un comportamiento in vitro semejante entre las formulaciones. Estos resultados son orientadores, permitiendo tan sólo guiar prospectivamente la puesta en marcha del ensayo de bioequivalencia entre el medicamento Test y Referencia evaluado in vitro. Se pretende que estos ensayos llevadosa cabo con LMT, constituyan el paso inicial, para estudiar el comportamiento de las cinéticas de disolución de otros medicamentos Test y sus correspondientes Referencias del mercado paraguayo.
Palabras claves: Epilepsia, lamotrigina, ensayos de disolución in vitro
A B S T R A C T
Epilepsy is the most common neurologic disease in the world, this situation boosts the development of new anticonvulsant drugs (AEDs) as lamotrigine (LMT) having, the latter, a high economic cost for the population with seizures. The aim of the study was to compare the dissolution profiles of LMT tablets of 25 mg (Test) marketed in Paraguay and the Reference or innovator (Lamictal®). LMT 25mg tablets were chosen with the current health register sold in Paraguay and performing the quality controls according to general criteria of the official pharmacopoeia. Subsequently, the kinetics of dissolution of the Test and Reference products were determined in the three recommended dissolution media (pH 1,2 ; 4,5 and 6,8). The dissolution profiles of LMT products evaluated presented similar behavior at the three different pHs, releasing more than 85% within 15 minutes in the three dissolution media. No comparison with the f1 and f2 test was necessary. The kinetics of dissolution of the tablets of LMT 25 mg analyzed showed a similar in vitro behavior between the formulations. These results constitute only a guide for the implementation of bioequivalence studies between the Test and the Reference assayed in vitro. These tests carried out with LMT could emerge as an initial step in order to study the behavior of dissolution profiles of the Test product and the corresponding references in the Paraguayan market.
Keywords: Epilepsy, lamotrigine, in vitro dissolution tests.
INTRODUCCIÓN
La epilepsia es la enfermedad neurológica más frecuente en el mundo, que afecta a unos 50 millones de personas, 49 millones de las cuales residen en países en desarrollo (1). Según los datos aportados por el Ministerio de Salud Pública y Bienestar Social (MSP Y BS) - Departamento de Salud Mental de nuestro país, en el año 2014, se referenciaron 980 casos de epilepsia.
Al 70% de los sujetos con epilepsia se les controla con fármacos antiepilépticos (FAE), pero se considera que el 30% de ellos es resistente a dichos fármacos y sigue padeciendo crisis recurrentes (2-4). Una consecuencia de esta situación fue el impulso en el desarrollo de nuevos fármacos FAE con mecanismos de acción innovadores que buscan el aumento de la eficacia y tolerabilidad en los pacientes (5,6). Sin embargo, los FAE introducidos durante las últimas décadas, como la lamotrigina (LMT), tienen un elevado coste económico para la población con crisis convulsivas (7).
Los estudios de bioequivalencia (BE) tienen como objetivo demostrar la intercambiabilidad entre productos similares, es decir entre medicamentos equivalentes farmacéuticos (iguales formas farmacéuticas, conteniendo iguales dosis de iguales ingredientes activos) o entre alternativas farmacéuticas (dos medicamentos conteniendo similares dosis molares de la parte activa de sus respectivos ingredientes activos). Dicha intercambiabilidad significa que los productos bioequivalentes presentarán similares biodisponibilidades y serán por lo tanto equivalentes biofarmacéuticos (8). La equivalencia biofarmacéutica presupone que los productos también serán equivalentes terapéuticos (similar farmacodinamia entre los mismos).
En determinados casos se acepta que la equivalencia biofarmacéutica sea dirimida a través de estudios de disolución in vitro comparativos entre Test y Referencia de acuerdo al Sistema de Clasificación Biofarmacéutica (BCS). La OMS ha dado un fuerte respaldo a la bioexención, siguiendo ciertas pautas que han sido compiladas en el informe Nº40 del año 2006 (9) y en el informe Nº49 del año 2015 (10).
Las cinéticas de disolución in vitro del medicamento Test con relación al de Referencia se realiza en tres medios de disolución: pH 1,2; pH 4,5 y pH 6,8. Estos pHs pretenden simular el recorrido gastrointestinal al que se enfrentará el fármaco una vez ingerido (9-12). Por lo tanto, los ensayos de disolución in vitro pueden ser relevantes para predecir el comportamiento in vivo.
Para ello se evaluó la calidad de las distintas marcas de comprimidos de LMT (Clase II de acuerdo a la BCS o sea de alta permeabilidad y baja solubilidad) (13-19) de 25 mg comercializadas en el país comparándolas con la Referencia (Lamictal®). Suponiendo que si la disolución es el paso previo y determinante de la absorción, las diferencias que allí se constaten entre Test y Referencia tendrán directa consecuencia sobre la BE, que permitirá a la autoridad sanitaria presumir la intercambiabilidad o no del medicamento similar o copia elaborado en el país.
MATERIAL Y MÉTODOS
Control de calidad
Comprimidos de LMT de 25mg, correspondiente a 2 productos comercializados en Paraguay, adquiridos en una distribuidora de productos farmacéuticos de la ciudad de Asunción. Los estudios se realizaron con lotes con registro sanitario vigente, dentro del periodo de vida útil y se codificaron por marcas con letras mayúsculas MF, ML y RF, siendo RF el medicamento tomado como referencia (Lamictal®)
Los ensayos fueron realizados siguiendo los métodos descritos en la Farmacopea de la India (20) y la USP37 (21) previa validación de algunos parámetros.
Los análisis fueron realizados utilizando un estándar secundario de LMT Lote 805414.
Se analizaron las características fisicoquímicas de los productos Test y Referencia, en base a los criterios de la farmacopea de la India (20) y la USP37 (21).
Condiciones analíticas para la identificación, valoración y ensayo de disolución: el sistema consiste en un HPLC Waters® con detector PDA 2998 a 20µL con auto inyector, usando una columna Phenomenex Luna C18 (2)100A (150x4.60mm, 5mm), elución isocrática con fase móvil correspondiente a una mezcla de buffer fosfato de sodio 0,05M pH 4,0 ± 0,5-acetonitrilo (80:20). El flujo de 1,3mL/min, una inyección de 20 µL, tiempo de retención de LMT es de 5 min. La detección PDA fue a 277nm y la temperatura de la columna a 40°C.
Preparación del estándar: se pesaron una cantidad aproximada de LMT estándar y se disolvió con fase móvil, hasta obtener una solución de concentración 0,224mg/mL.
Preparación de la muestra: se pesaron 20comprimidos al azar de los productos Test y Referencia por separado, se determinó el peso promedio y el coeficiente de variación de cada lote. Se pulverizó y se tomó una porción de polvo equivalente a 28mg de LMT que fue transferido a un matraz volumétrico de 25mL. Se añaden 15mL de fase móvil, sonicar por 10minuto, diluir a volumen y mezclar. Filtrar, tomar 2mL de la solución filtrada y transferir a un matraz aforado de 10mL, llevando a volumen con fase móvil. Filtrar una porción por filtro de membrana de 0,45 µm (Millex LCR, membrana de PTFE modificada o similar).
Ensayo de disolución: se utilizó un equipo de disolución Erweka® DT 700, siguiendo los delineamientos de la USP 37 (22). Concentración de las muestras y estándar de 0,014mg/mL. Condiciones cromatográficas similar a la valoración.
Perfiles de disolución
Los medios se prepararon de acuerdo al capítulo general de soluciones buffer de USP 37(21). Las condiciones cromatográficas similar a la valoración. Se utilizó un equipo Erweka® DT 700 para 8 vasos en tres medios de disolución (pH 1,2; pH 4,5 buffer acetato y pH 6,8 buffer fosfato), analizados con 12 comprimidos para cada medio de disolución. Las muestras fueron tomadas a los 5, 10, 15, 20,30 y 40 minutos. Dos mL de las alícuotas tomadas se llevaron a volumen con fase móvil en un matraz aforado de 10mL. Las muestras Test y Referencia fueron filtrados a través de filtros 0,45 µm PTFE.
Curva de calibración: las soluciones estándar fueron preparados en 5 niveles de concentración, por duplicado para cada nivel en un rango de 0,0036mg/mL a 0,0164mg/mL.
Las condiciones analíticas de trabajo fueron los mismos a la utilizada en la valoración de LMT.
La ecuación de la recta es estimada usando el análisis de la regresión lineal (y=ax+b) y el coeficiente de correlación.
El procesamiento estadístico de la información se realizó utilizando planilla electrónica Microsoft® Office Excel, mediante la obtención de valores medios, desviaciones estándar, coeficientes de variación de las datos obtenidos.
Para analizar los productos Test y la Referencia, se contrasta la cinética de los perfiles de disolución utilizando un modelo simple de acercamiento dependiente, el factor de diferencia (f1) y el factor de similitud (f2) (23,24).
Debe tomarse en cuenta que cuando se comparen los productos en estudio (Test y Referencia), se debe confrontar los perfiles cinéticos de liberación-disolución usando el factor de similitud f2 (24-27).
RESULTADOS
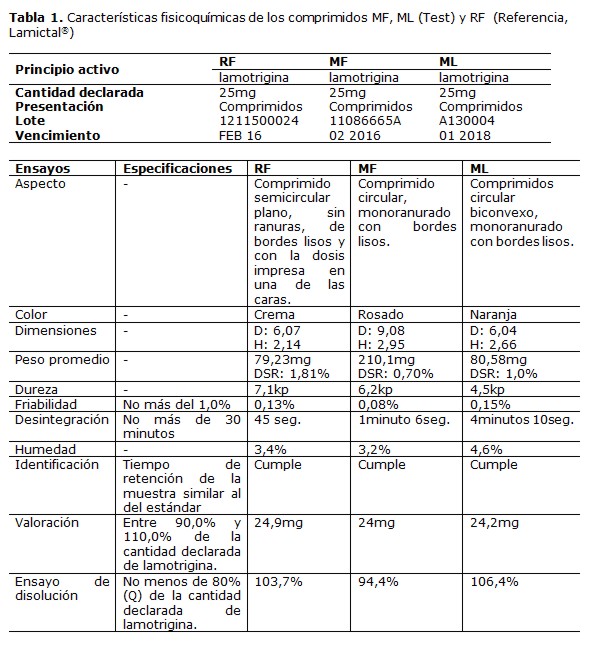
En la Tabla 1 se muestran las características fisicoquímicas de los productos ensayados.
Los resultados obtenidos en los ensayos físicoquímicos, en todos los casos satisfacen las especificaciones de la Farmacopea, con valores entre 96,0% y 99,6% para el contenido de principio activo, lo cual se ajusta correctamente a los límites de 90,0% a 110,0%. Para la identificación del principio activo se compararon los cromatogramas obtenidos en el ensayo de valoración, evidenciándose total correspondencia en los tiempos de retención de las muestras y el estándar de referencia.
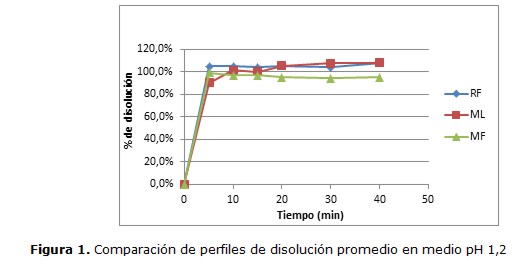
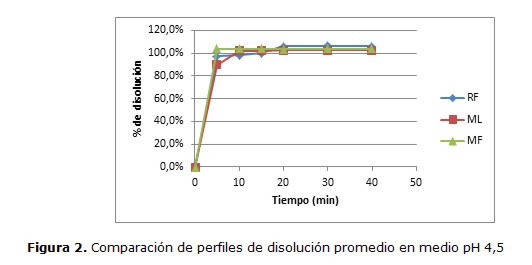
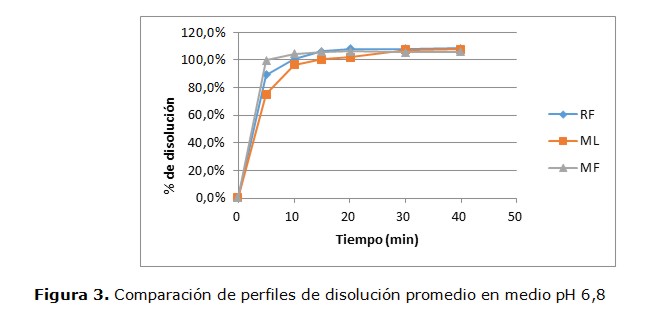
Los perfiles de disolución de los productos Test evaluados comparándolos con el de Referencia a pH 1,2; 4,5 y 6,8 se muestran en las Figuras 1, 2 y 3, respectivamente.
Se observan comportamientos de disolucion similares para la mayoria de los productos a los diferentes pHs, liberando aproximadamente más del 98% de lamotrigina a los 10 minutos.
DISCUSIÓN
Tanto la validación de la metodología utilizada y los controles de calidad realizados a los comprimidos estudiados estuvieron dentro de los límites fijados por la USP 37(21) y la Farmacopea de la India(20), en la cual no se encontraron diferencias significativas en los ensayos fisicoquímicos entre las diferentes marcas comerciales evaluadas.
Según el BCS, existen cuatro categorías: I (alta solubilidad y alta permeabilidad); II (baja solubilidad y alta permeabilidad); III (alta solubilidad y baja permeabilidad) y IV (baja solubilidad y baja permeabilidad). Para las categorías I y II, se esperan correlaciones importantes entre las pruebas in vitro e in vivo, para la clase III bajas o ausentes correlaciones, y para la clase IV, no se esperan correlaciones (9,10) LMT está clasificado en la categoría II por lo tanto se esperaría una correlación importante entre las pruebas in vitro e in vivo.
El perfil de disolución realizada a los dos productos de LMT de 25mg comercializados en nuestro país, mostraron marcadas semejanzas entre ellos (figura 1, 2 y 3), lo que indica una homogeneidad en cuanto a la liberación in vitro del principio activo, por lo cual pueden considerarse similares al producto de Referencia de acuerdo a los resultados obtenidos.
Asimismo, como se puede observar en las figuras, las tres marcas comerciales estudiadas liberan aproximadamente más del 98% de LMT a los 10 minutos. Cabe destacar, que cuando el principio activo contenido tanto en el producto farmacéutico Test como en el producto de Referencia, se disuelven en un porcentaje del 85% o más de la cantidad declarada del fármaco a los 15 minutos o menos, utilizando los 3 medios de disolución recomendados, no es necesario la comparación de perfiles con la prueba f1 y f2, pero ello no le exime de presentar los perfiles de disolución de los productos Test y la Referencia (25,26)
La evaluación de la disolución tiene aproximadamente un siglo de desarrollo. Sin embargo, en las últimas décadas ha suscitado mayor interés, especialmente por su aplicación al estudio de productos medicamentosos sólidos, relacionando este proceso con la biodisponibilidad de fármacos en el organismo, ya que a excepción de algunos casos, todo principio activo debe disolverse para poder absorberse. Por lo tanto, el estudio de la cinética de disolución de LMT se convierte en el ensayo in vitro de elección para poder emitir un juicio sobre el comportamiento que podría tener el medicamento in vivo, por más que el mismo no se encuentra en la lista de medicamentos bioeximibles.
Es importante resaltar el beneficio que tienen los estudios de cinética de disolución en productos que afectan el sistema nervioso central en la prescripción con el fin de garantizar que al intercambiar una formulación por otra, se mantenga la calidad biofarmacéutica.
El presente trabajo constituye uno de los primeros estudios preliminares en Paraguay que analiza el comportamiento de disolución in vitro de diferentes marcas comerciales de comprimidos de LMT.
Se pretende que estos ensayos in vitro que se llevaron a cabo con LMT, constituyan el paso inicial, para estudiar el comportamiento de las cinéticas de disolución de otros medicamentos Test y sus correspondientes Referencias del mercado paraguayo. Si bien estos estudios no sustituyen en muchos casos los estudios in vivo, pueden ser relevantes para predecir una posible bioequivalencia o bioinequivalencia in vivo integrando políticas nacionales de salud como la farmacovigilancia.
Agradecimientos
Al Dr. Esteban Ferro, Decano de la Facultad de Ciencias Químicas, por darme la oportunidad de realizar mi tesis doctoral en esta casa de estudios.
Fuente de Financiación:
El presente trabajo ha sido financiado con recursos propios, como requisito para la obtención del título de Doctor en Ciencias Farmacéuticas.
No ha sido presentado en ningún congreso, reunión científica u otros en ninguna modalidad.
Asimismo, declaramos la inexistencia de conflictos de intereses.
REFERENCIAS BIBLIOGRÁFICAS
1. Burneo JG, Tellez-Zenteno J, Wiebe S. Understanding the burden of epilepsy in Latin America: a systematic review of its prevalence and incidence. Epilepsy Res 2005; 66: 63-74. [ Links ]
2. Ibanez V. Epilepsia intratable o fármaco resistente: concepto y tratamiento. Rev Neurol 1994; 23: 1214-9. [ Links ]
3. Alvariza S, Fagiolino P, Vazquez M, Feria-Romero I. Chronic administration of phenytoin induces efflux transporter overexpression in rats. Pharmacol Rep 2014; 66: 946-51. [ Links ]
4. Mauri-Llerda JA, Tejero C, Espada F, Iniguez C, Morales F. Lamotrigina en epilepsia parcial y generalizada refractarias. Rev Neurol 2001; 32: 42-5. [ Links ]
5. Beyenburg S, Bauer J, Reuber M. Review. New drugs for the treatment of epilepsy: a practical approach. Postgrad Med J 2004; 80:581-7. [ Links ]
6. Johannessen SI, Landmark CJ. Antiepileptic drug interactions-principles and clinical implications. Curr Neuropharmacol 2010; 8:254-67. [ Links ]
7. Girolineto BMP, Alexandre VJr, Queiroz RHC, Feletti F, Sakamoto AC, Pereira LR. Intercambiabilidad entre equivalentes terapéuticos de lamotrigina en pacientes con epilepsia refractaria: riesgos y beneficios. Rev Neurol 2010; 52(6): 330-36. [ Links ]
8. Fagiolino P, Vázquez M, Ibarra M. Biodisponibilidad y bioequivalencia de medicamentos. En: Beas C, Ureña ME, Rivera MC, Pallas M, Camins A, editores. Tópicos de actualización en Neurología. Guadalajara: Universidad de Guadalajara; 2010. [ Links ]
9. Fortieth Report of the World Health Organization. Technical Report series No 937, Annex 7: Multisource (generic) pharmaceutical products: guideline on registration requirements to establish interchangeability. Geneva: WHO; 2006. [ Links ]
10. Forty-ninth Report of the World Health Organization. Technical Report series No 992, Annex 8: Guidance on the selection of comparator pharmaceutical products for equivalence assessment of interchangeable multisource (generic) product. Geneva: WHO; 2015. [ Links ]
11. Dressman JB, Amidon GL, Reppas C, Shah VP. Dissolution testing as a prognostic tool for oral drug absorption: Immediate release dosage forms. Pharm Res 1998; 15: 11-22. [ Links ]
12. Guidance for Industry. Dissolution testing of immediate release solid oral dosage forms. Rockville (MD): U.S. Department of Health and Human Services, Food and Drug Administration, Center for Drug Evaluation and Research; 1997. [ Links ]
13. Lalic M, Pilipovic A, Golocorbin-Kon S, Gebaver-Bukurov K, Bozic K, Mikov M, et al. Comparison of dissolution profiles and serum concentrations of two Lamotrigine tablet formulations. Drugs R D 2011; 11(1):53-60. [ Links ]
14. Mali L, Nighute B, Deshmukh V, Gonjari D, Bhise B. Microcrystals: for improvement of solubility and dissolution rate of Lamotrigine. Int J Ph Sci 2010; 2(2):515-21. [ Links ]
15. Mohan A, Gundamaraju R. In vitro and in vivo evaluation of fast-dissolving tablets containing solid dispersion of lamotrigine. Int J Pharma Investig 2015; 5:57-64. [ Links ]
16. Ramírez E, Laosa O, Guerra P, Duque B, Mosquera B, Borobia A, et al. Acceptability and characteristics of 124 human bioequivalence studies with active substances classified according to the Biopharmaceutic Classification System. Br J Clin Pharmacol 2010; 70(5): 694-702. [ Links ].
17. Huma Pharmaceutical. Estudio del perfil de disolución de tabletas de Imipramine 25mg de laboratorio Humax Pharmaceutical S.A comparadas con tabletas de Tofranil 25 mg del laboratorio innovador. Colombia:. 2005. www.cohan.org.co. [ Links ]
18. Saavedra I, Itarriaga V, Avila L, Quiñones L. Estudios de bioexención (in vitro) para establecer equivalencia de medicamentos. Cuad Méd Soc (Chile) 2011; 51(2): 66-76. [ Links ]
19. Indian Pharmacopoeia 2014. Govt. of India, Ministry of Health and Family Welfare, Delhi, Ghaziabad, 2014. Vol. II: 2066. [ Links ]
20. Farmacopea de los Estados Unidos, USP 37. US, Rockville, MD 20852. 2014, Vol. III: 4026-4027. [ Links ]
21. Farmacopea de los Estados Unidos, USP 37. Soluciones/Soluciones Amortiguadoras. US, Rockville, MD 20852. 2014. [ Links ]
22. Martins M, Paim C, Steppe M. LC and UV methods for lamotrigine determination in pharmaceutical formulation. Chromatography Research International. 2011; 8. [ Links ]
23. Moore JW, Flanner HH. Mathematical Comparison of curves with an emphasis on in vitro dissolution profiles. Pharm Tech 1996; 20(6): 64-74. [ Links ]
24. Shah VP, Tsong Y, Sathe P. In vitro dissolution profile comparison - statistics and analysis of the similarity factor, f2. Pharm Res 1998; 15: 889-96. [ Links ]
25. CooK H, Jáuregui G, Carrasco K, Cruz L. Comparación de perfiles de disolución. Impacto de los criterios de diferentes agencias regulatorias en el cálculo de f2. Rev Mex Cienc Farm. 2012; 43:67-71. [ Links ]
26. Instituto de Salud Pública. Guía técnica G-BIOF 02: Bioexención de los estudios de biodisponibilidad/bioequivalencia para establecer Equivalencia Terapéutica de formas farmacéuticas solidad orales. Departamento de control nacional/Sub-departamento de seguridad/Sección Biofarmacia. 2007; 4-53. [ Links ]
Fecha de recepción: junio 2016. Fecha de aceptación: agosto 2016Autor correspondiente: Sonia Fretes*. Facultad de Ciencias Químicas UNA
E-mail: soniafretescom@yahoo.com.ar