Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO
Related links
-
 Similars in
SciELO
Similars in
SciELO
Share
Memorias del Instituto de Investigaciones en Ciencias de la Salud
On-line version ISSN 1812-9528
Mem. Inst. Investig. Cienc. Salud vol.14 no.1 Asunción Apr. 2016
https://doi.org/10.18004/Mem.iics/1812-9528/2016.014(01)08-016
Articulo Original/ Original Article
Detección molecular de belactamasas de espectro extendido (BLEE) en enterobacterias aisladas en Asunción
Molecular detection of extended spectrum beta-lactamase (esbl) in enterobacteria isolated in Asunción
*Rosa GuillénI, Gladys VelázquezII,III, Graciela Lird III, Carmen EspínolaII, Marcela Laconich II,III, LetiziaCarpinelli I, Carmen MenachoII, Juana OrtelladoIII, Norma FariñaI, Laura FrancoI, Fátima RodríguezI, Graciela RussomandoI
I Dpto. de Biología Molecular y Biotecnología y Laboratorio de Microbiología. Instituto de Investigaciones en Ciencias de la Salud. Universidad Nacional de Asunción. San Lorenzo, Paraguay
II Servicio de Microbiología. Instituto de Previsión Social. Asunción, Paraguay
III Servicio de Microbiología. Hospital de Clínicas. San Lorenzo, Paraguay
R E S U M E N
Las betalactamasas de espectro extendido (BLEE), son enzimas responsables de la hidrólisis del anillo betalactámico de penicilinas y cefalosporinas, excepto carbapemenes, inhibiendo así su actividad terapéutica. Si bien es posible la detección fenotípica de este mecanismo de resistencia por métodos convencionales, sólo los métodos moleculares permiten la identificación del gen responsable de dicha resistencia. El objetivo de este estudio descriptivo retrospectivo fue identificar los genes blaCTX-M2, blaPER-2, blaSHV y blaTEM, en aislamientos de enterobacterias productoras de BLEE,; de muestras clínicas colectadas entre julio 2007 y abril 2008, provenientes de dos hospitales de referencia de Asunción, Paraguay. La detección molecular de los genes se realizó por reacción en cadena de la polimerasa empleando oligonucleótidos específicos. De los 232 aislados BLEE analizados, el 83% (n=192) portó al menos un gen bla, en el 17% (n=40) restante no fue detectado ninguno de los genes incluido en el estudio. Se observaron las siguientes frecuencias: 49% (94/192) blaCTX-M2, 45% (86/192) blaSHV, 40% (77/192) blaTEM y 7% (13/192) blaPER-2. En el 47% (90/192) se detectó más de un gen, siendo la combinación blaCTX-M2+blaTEM+blaSHV, la más frecuente observada en 32 aislados. El blaCTX-M2 como el gen más frecuente en este estudio; concuerda con lo reportado en nuestro país y en Argentina. Este es el primer reporte de la presencia de blaTEM y blaSHV en Paraguay. Es de gran importancia el estudio de otros genes codificantes de resistencia, considerando la emergencia de otras BLEE en la región como blaCTX-M15 con actividad predominantemente ceftazidimasa.
Palabras clave: betalactamasa de espectro extendido (BLEE), resistencia a cefalosporina, enterobacteria, reacción en cadena de la polimerasa (PCR).
A B S T R A C T
Extended spectrum beta-lactamases (ESBLs), are enzymes responsible for the hydrolysis of the beta-lactam ring and resistance to both cephalosporins and penicillins, except carbapenems, therefore inhibiting its therapeutics activity. Even though, detection of the phenotypic resistance mechanism by conventional methods is possible, only molecular methods allow identification of the gene responsible for the resistance. The objective of this retrospective study was to identify the blaCTX-M2, blaPER-2, blaSHV, blaTEM genes in ESBL-producing enterobacteriaceae isolates, recovered from clinical samples collected between July 2007 and April 2008, from two reference hospitals in Asunción, Paraguay. Molecular gene detection was performed by polymerase chain reaction using specifics oligonucleotides. Out of the tested 232 ESBL-producing isolates, 83% (n=192) carried at least one of the bla genes as follows; 49% (94/192) blaCTX-M2, 45% (86/192) blaSHV, 40% (77/192) blaTEM and 7% (13/192) blaPER-2. In the rest 17% (n=40) none of the genes included in this study was detected; in 47% (90/192) more than one gene was detected, resulting blaCTX-M2 + blaTEM + blaSHV as the most frequent combination in 32 isolates. The presence of blaCTX-M2, as the most frequent codifying genes of BLEE is in agreement with previous reports in Paraguay and Argentina. This is the first report of the presence of blaTEM and blaSHV circulating in Paraguay. It is of much importance the study of others codifying resistance genes, taking into account the emergence of other BLEE in the region, such as blaCTX-M15, predominantly with ceftazidimase activity.
Key Words: Extended-Spectrum Beta-Lactamase (ESBL), cephalosporin resistance, enterobacterias, Polymerase Chain Reaction (PCR).
INTRODUCCIÓN
Los bacilos gram negativos de la familia Enterobacteriaceae (anaerobios facultativos, miembros de la flora intestinal normal) son los microorganismos aislados con mayor frecuencia a partir de muestras clínicas humanas en el laboratorio de microbiología. Los antibióticos betalactámicos son un grupo ampliamente utilizado, tanto a nivel hospitalario como comunitario para tratar infecciones causadas por bacterias gram positivas como gram negativas. En el proceso evolutivo, los bacilos gram negativos son los microorganismos que más mecanismos de resistencia contra antibióticos betalactámicos han generado. Dentro de estos mecanismos de resistencia se describen la producción de betalactamasas, alteraciones de la permeabilidad, alteraciones de los sitios dianas y presumiblemente expresión de bombas de eliminación activa (1).
Los antibióticos betalactámicos son ampliamente utilizados, tanto a nivel hospitalario como en la comunidad, favoreciendo la selección de bacterias productoras de enzimas betalactamasas, que son responsables de la resistencia por hidrólisis del anillo betalactámico de las penicilinas y cefalosporinas, inhibiendo así su actividad terapéutica (2-4). El mecanismo más común de resistencia a cefalosporinas de tercera generación es la producción de enzimas betalactamasas de espectro extendido (BLEE), pertenecientes a la clase A de la clasificación de Ambler y al grupo 2be de Bush et al (5,6). En su mayoría las enterobacterias productoras de BLEE y, en particular Klebsiella pneumoniae y Escherichia coli, son capaces de hidrolizar las cefalosporinas de amplio espectro y los monobactámicos, pero no las cefamicinas ni los carbapenémicos y las combinaciones de betalactámicos con inhibidores de betalactamasas como ácido clavulánico, el sulbactam y tazobactam (7).La mayoría de estas betalactamasas están codificadas en plásmidos conjugativos, lo que permite la diseminación de este mecanismo de resistencia no sólo entre distintas cepas de la misma especie, sino también entre distintas especies bacterianas. Además de su codificación plasmídica, las BLEE forman parte frecuentemente de trasposones o integrones lo cual determina su asociación con otros determinantes genéticos de resistencia transferibles, como los que confieren resistencia a los aminoglucósidos o al cotrimoxazol. Por lo que son un motivo de preocupación a nivel mundial por su fácil y rápido mecanismo de diseminación (8-10).
La detección de estas enzimas se facilita demostrando sinergia entre uno o más sustratos (cefalosporinas) y un inhibidor enzimático (ácido clavulánico). En microorganismos que, además, producen betalactamasas cromosómicas resistentes a inhibidores, la detección es aún más difícil, requiriéndose técnicas bioquímicas o genéticas (11).
A nivel nacional la emergencia de enterobacterias resistentes a betalactámicos con una sospecha fenotípica de la presencia de BLEE ha sido un grave problema en centros hospitalarios, sin embargo se desconocían de forma precisa el tipo de enzimas circulantes en estos aislados multirresistentes.; En este contexto se realizó en el año 2007 un estudio multicéntrico orientado a caracterizar molecularmente los aislamientos de enterobacterias productoras de BLEE e identificar las familias génicas codificantes de estas enzimas que predominan en centros hospitalarios del área metropolitana. Los primeros hallazgos sobre este punto fueron publicados en el año 2009 por Guillén y colaboradores (12), en el que se reporta como más frecuente al gen blaCTX-M2 (41%),; en enterobacterias con fenotipo BLEE de hospitales de Asunción. A raíz de los datos publicados, se decidió ampliar tanto el número de muestras estudiadas como el espectro de genes identificados, implementando la detección de los genes blaTEM y blaSHV, además de la detección de los genes blaCTX-M2 y blaPER-2 ya estudiados anteriormente.
MATERIALES Y MÉTODOS
El presente es un estudio observacional descriptivo de corte transverso, con muestreo no probabilístico, de casos consecutivos. Se colectaron enterobacterias productoras de betalactamasas de espectro extendido aisladas a partir de materiales biológicos de pacientes, ambulatorios u hospitalizados, que concurrieron al Instituto de Previsión Social (IPS) y al Hospital de Clínicas (HCL) en el periodo comprendido entre julio 2007 a abril 2008, y cuyas muestras biológicas fueron; cultivadas en sus respectivos servicios de microbiología. La identificación bacteriana fenotípica a partir del cultivo, fue llevada a cabo empleando pruebas bioquímicas convencionales. Todas las muestras fueron codificadas para respetar la confidencialidad de los pacientes de los cuáles fueron aisladas.
Test de susceptibilidad y detección de productores de BLEE: Para el aislamiento de las cepas de enterobacterias se siguieron los procedimientos estandarizados que constan en los manuales de procedimientos de cada laboratorio microbiológico participante del estudio. La prueba de susceptibilidad in vitro a diversos antimicrobianos se realizó por el método de difusión de Kirby-Bauer, empleando discos de la marca Oxoid/BBI (Unipath Ltd., UK) siguiendo los criterios del NCCLS/CLSI. Para detectar cepas con fenotipo BLEE se utilizó el método de doble disco colocando en el antibiograma los discos de cefalosporinas de tercera generación (cefotaxima y ceftazidima) próximos a un disco de amoxicilina-clavulánico.; La deformación del halo producido por la cefalosporina, conocida ;como “efecto huevo”, indicó la presencia de cepa productora de BLEE.
Los aislados que presentaron características fenotípicas de producción de BLEE fueron seleccionadas para el estudio molecular.
Detección molecular de los genes bla: La extracción de ADN se realizó por el método de ebullición, siguiendo las indicaciones descritas por Zhang y col., 2004 (13). Se empleó como molde para la PCR 2,5 µL del sobrenadante obtenido en la extracción de ADN. Se emplearon como oligonucleótidos 4 parejas denominadas: blaCTX-M2 (F y R), blaPER-2 (F y R), blaTEM (F y R) y blaSHV (F y R) (14). Las condiciones empleadas en las distintas reacciones de PCR fueron las siguientes: 5 min a 95°C, 30 ciclos de 1 minuto a 94°C, anillamiento 1 minuto a 55°C (a excepción del gen blaSHV que requirió 57°C para el anillamiento), extensión 1 minuto a 72°C, seguido de 10 minutos a 72°C de extensión final. Los productos de PCR fueron visualizados en geles de agarosa (Merck, Alemania) al 1%, con tinción de bromuro de etidio. Se empleó un marcador de peso molecular de 100 bp DNA (Bioline, EEUU). El tamaño de los productos amplificados fue determinado mediante el uso del software Kodak Digital Science.
RESULTADOS
En el presente estudio se analizaron 232 enterobacterias productoras de BLEE según criterio fenotípico, que fueron aisladas en los servicios de microbiología de los centros hospitalarios participantes, en el periodo de julio 2007 a abril 2008. Del total de aislados, 125 (54%) provenían del Instituto de Previsión Social (IPS) y 107 (46%) del Hospital de Clínicas (HCL). Los aislados fueron obtenidos mayoritariamente a partir de muestras biológicas, como orina, secreción purulenta y sangre en frecuencias del 50%, 16% y 11% respectivamente y en menor proporción muestras como: secreción traqueal, catéteres, secreción abdominal, esputo, hueso, líquido cefalorraquídeo y líquido vesicular.
Los aislados BLEE positivos analizados también presentaron resistencia a otros grupos de antibióticos testados en el antibiograma, como las quinolonas y los aminoglucósidos. No se detectó resistencia a carbapenemes (Tabla 1).
La especie de enterobacteria productora de BLEE más frecuente fue K. pneumoniae (61%), seguida de E. coli (21%) y Enterobacter (11%), entre las cuáles están incluidas especies de Enterobacter aerogenes, agglomerans y cloacae). Otras especies representaron el 7% del total de muestras analizadas (Figura 1).
De los 232 aislados BLEE analizados, el 83% (n=192) portó al menos un gen bla y el 17% (n=40) restante no portó ninguno de los genes incluidos en este estudio, todos ellos presentaron fenotipo característico de cepas productoras de BLEE. De los aislados portadores de genes bla incluidos en este estudio, el 53% (n=102) portó un solo gen, mientras que el 47% (n=90) portó más de uno.
Si se tiene en cuenta el total de aislados BLEE portadores de genes bla (n=192), se observan las siguientes frecuencias de genes: 49% (94/192) blaCTX-M2, 45% (86/192) blaSHV, 40% (77/192) blaTEM y 7% (13/192) blaPER-2, la frecuencia observada es mayor a 100%, debido a que algunos aislados portan más de 1 gen de manera simultánea. Si analizamos por separado los aislados que portaron sólo uno de los genes en estudio se observó que el 41% (42/102) portó el gen blaCTX-M2, 30% (31/102) blaSHV, 22% (23/102) blaTEM y 6% (6/102) blaPER-2. En ambos casos, el orden de frecuencia de la portación de genes bla de mayor a menor sigue siendo el mismo: blaCTX-M2, blaSHV, blaTEM y blaPER-2 (Figura 2).
Mientras que en los aislados que portaron más de un gen combinado 47% (90/192), se observó que la combinación más frecuente fue blaCTX-M2 + blaTEM + blaSHV, observada en 32 aislados.
Al analizar la distribución por hospital de las enterobacterias productoras de BLEE, se pudo comprobar que existe una diferencia estadísticamente significativa en las frecuencias de los genes blaCTX-M2 y blaSHV detectadas por hospital (Tabla 2), observándose mayores frecuencias de estos dos genes en el Instituto de Previsión Social (p<0,05).
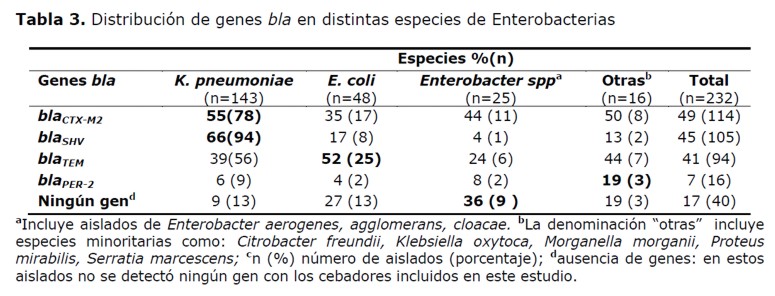
También se observaron diferencias en la distribución de los genes codificantes de betalactamasas en las distintas enterobacterias estudiadas (Tabla 3). Los genes blaCTX-M2 y blaSHV se encontraron en mayor porcentaje en aislados de K. pneumoniae, 55% y 66% respectivamente. El gen blaTEM se encontró en mayor porcentaje en E. coli (52%) y el gen blaPER-2 fue más frecuente en otras especies analizadas (19%) como: Citrobacter freundii, Klebsiella oxytoca, Morganella morganii, Proteus mirabilis, Serratia marcescens.
En los aislados que portaron más de un gen codificante de la resistencia a betalactámicos, el mayor porcentaje de combinación se registró en cepas de K. pneumoniae (54%, 77/143) y las combinaciones observadas fueron: genes blaCTX-M2+blaTEM+blaSHV, blaCTX-M2+blaSHV, blaTEM+blaSHV, blaCTX-M2+blaTEM, blaCTX-M2+blaPER-2, blaPER-2+blaSHV, blaCTX-M2+blaPER-2+blaSHV; y; blaPER-2+blaTEM+blaSHV observadas en el 35%, 27%, 19%, 9%, 4%, 3%, 1,5% y 1,5% de los aislados.
DISCUSIÓN
En el presente estudio fueron identificados los genes responsables de la producción de BLEE en 232 aislados provenientes de pacientes hospitalizados, de los cuáles K. pneumoniae fue el más frecuente, lo que coincide con estudios realizados en Latinoamérica, en donde esta enterobacteria es la que produce BLEE con mayor frecuencia (15,16). Entre los genes codificantes de BLEE el más frecuente en este estudio fue blaCTX-M2 (49%), en segundo lugar estuvieron las blaSHV (45%), seguidas de blaTEM (40%) y por último blaPER-2 (7%). La frecuencia del gen blaCTX-M2 concuerda con lo ya reportado por nuestro grupo (41%) (12) y con estudios realizados en Argentina como el de Quinteros et al. en el año 2005, quienes mostraron que CTX-M2 fue la BLEE más prevalente en hospitales de Buenos Aires (14). En dicho estudio, de 39 aislados BLEE positivos el gen blaCTX-M2 fue identificado en 26, seguido del; tipo PER-2 en 9 aislados y los relacionados a SHV en 4 aislados. En general en Sudamérica predominan las BLEE de tipo CTX-M, PER-2 y SHV a diferencia de lo reportado en Europa y Estados Unidos donde las derivadas de blaSHV y de blaTEM son las más comúnmente halladas en enterobacterias (14, 15, 17-19).
Un gran porcentaje de las enterobacterias estudiadas portó; más de un gen de manera simultánea y todos los tipos de betalactamasas analizados pudieron ser detectados en las tres bacterias más frecuentemente aisladas: K. pneumoniae, E. coli y Enterobacter spp. En el estudio de Quinteros et al, el gen blaCTX-M2 fue detectada en todas las enterobacterias estudiadas: E. coli, Enterobacter aerogenes, Serratia marcescens, Proteus mirabilis, y Providencia stuartii,; el gen blaPER-2 fue identificado; en Enterobacter spp y; Klebsiella pneumoniae; y blaSHV solo en K. pneumoniae (14), lo cual se podría explicar por el número limitado de muestras.
Es importante resaltar la amplia distribución de los genes responsables de la resistencia a antibióticos betalactámicos en las distintas enterobacterias, así como la portación simultánea de varios genes, al igual que se observa en otros estudios regionales, debido a la alta transmisión de plásmidos conjugativos y la promiscuidad en el proceso de transferencia de la información (20-22). En los aislados estudiados se evidenció una gran variabilidad genética, lo cual sugiere la aparición de cepas resistentes específicas más que la circulación y transmisión de un aislado habitual entre pacientes. La alta variabilidad fenotípica y genotípica observada en los aislados de cada especie sugiere que durante el tiempo del estudio no se demostró la presencia de cepas endémicas en las instituciones ni tampoco la asociación con brotes epidémicos (23).
En el estudio realizado por Bertona et al. (24), en Argentina, en 12 aislados; de Enterobacter spp; resistentes a cefalosporinas de tercera generación detectaron un alto nivel de producción de cefalosporinasa cromosómica como era de esperar y ;BLEE fue detectado en 9 aislados de los cuales 8 fueron de tipo PER-2 y solo uno de tipo CTX-M2.; Es importante destacar que ;en dicho trabajo, un gran porcentaje de las BLEE de tipo PER-2 no fue detectado por la prueba de sinergia del doble disco (cefotaxima y ceftazidima) y la detección de este tipo de BLEE mejoró notablemente con el agregado de cefepima. En este estudio hemos utilizado para el tamizaje solamente la prueba ;del doble disco, por lo que probablemente algunos aislamientos de Enterobacter sp con BLEE de tipo PER-2 quedó excluido del estudio.
En cuanto a la resistencia a antibióticos no betalactámicos asociada, en el presente estudio se observó elevada resistencia a quinolonas y aminoglucósidos, sobre todo a gentamicina, resultados que concuerdan con trabajos realizados en Latinoamérica donde un gran porcentaje de los aislados productores de BLEE fueron resistentes a los aminoglucósidos y fluoroquinolonas (25-27). Si bien, no hallamos resistencia a carbapenemes en enterobacterias, durante el periodo del estudio, tan sólo unos años después se reportó en el país la emergencia de enterobacterias resistentes a carbapenemes tipo KPC en varios hospitales de Asunción y del Departamento Central, las mismas además portaban simultáneamente ;otros genes de resistencia a betalactámicos y quinolonas como: blaCTX-M, blaPER-2 y qnr(28).
Probablemente la diseminación de enterobacterias BLEE positivas con escasas opciones terapéuticas, obligó al uso indiscriminado de carbapenemes, factor importante en la generación y selección de bacterias productoras de carbapenemasas, forzando la selección de aislados multirresistentes portadores de mecanismos de resistencia a carbapenemes como KPC y las metalobetalactamasas como OXA y NDM1 (29). ;
Estudios recientes en Argentina, indican que la CTX-M2 ha disminuido, pero aún permanecen como; predominante, y están emergiendo otras CTX-M,; como CTX-M15 con mayor actividad ceftazidimasa en relación a CTX-M2, de acción fuertemente cefotaximasa(14, 15). Los aislados fenotípicamente productores de enzimas betalactamasas del estudio, en los cuáles no se pudieron detectar ninguno de los genes analizados, podría ser debido a la presencia de otras enzimas cuyos genes codificantes no fueron incluidos en el estudio, como otras CTX-M, o genes de tipo GES, que podrían estar presentes en enterobacterias (30).
Sería de mucha importancia continuar estudiando los ;genes de resistencia circulantes, por la; emergencia en la región de otros genes de tipo CTX-M,; que tienen predilección por substratos distintos y por lo que afectan de manera diferente la actividad de los antibióticos. Conociendo los genes codificantes de las BLEE se podrá contribuir con la elección de los esquemas terapéuticos a ser utilizado en el tratamiento empírico de las infecciones.
Financiación
Premio LabCiencia otorgado por el Congreso Paraguayo de Química en el año 2008.
REFERENCIAS BIBLIOGRÁFICAS
1. Rivera JM, Rodríguez C, Huayán G, Mercado P. Susceptibilidad a betalactámicos y resistencia por betalactamasas de espectro extendido (BLEE) en Enterobacteriaceae aisladas de reservorios ambientales de un hospital general en Cajamarca, Perú. Rev Med Hered. 2011; 22(2):69-75. [ Links ]
2. Torres L, Gagliotta V, Torres O, Benítez M, Domínguez M, Pedroza R. b-Lactamasas de Espectro Expandido en Enterobacterias aisladas en Centros de Salud de Caracas. Rev. Soc. Ven. Microbiol. 2006; 26(2):365-78. [ Links ]
3. Paterson DL, Bonomo RA. Extended-spectrum b-lactamases: a clinical update. Clin Microbiol Rev. 2005; 18(4):657-86. [ Links ]
4. Godínez AR, Pedroso WH, Hernández RN, Sánchez AP, Alonso ED, Cruz LD. Detección precoz de enterobacterias productoras de betalactamasas de espectro extendido en pacientes graves. Rev Cub Med Int Emerg. 2006; 5(1):294-301. [ Links ]
5. Ambler RP. The structure of Beta-lactamases. Philos Trans R Soc Lond B Biol Sci. 1980; 289(1036):321-31. [ Links ]
6. Bush K, Jacoby GA, Medeiros AA. A functional classification scheme for beta-lactamases and its correlation with molecular structure. Antimicrob Agents Chemother. 1995; 39(6):1211. [ Links ]
7. Tafur JD, Torres JA, Villegas MV. Mechanisms of antibiotic resistance in Gram negative bacteria. Infectio. 2008; 12(3):227-32. [ Links ]
8. Rossolini GM, D’andrea MM, Mugnaioli C. The spread of CTX-M-type extended-spectrum β-lactamases. Clin Microbiol Infect. 2008; 14(s1):33-41. [ Links ]
9. Bonnet R. Growing group of extended-spectrum β-lactamases: the CTX-M enzymes. Antimicrob Agents Chemother. 2004; 48(1):1-4. [ Links ]
10. Chen CJ, Su LH, Lin TY, Huang YC. Molecular analysis of repeated methicillin-resistant Staphylococcus aureus infections in children. PLoS One. 2010; 5(12):e14431. [ Links ]
11. Muñoz J, García-Rodríguez J. Detección de mecanismos de resistencia. Enferm Infecc Microbiol Clin. 2003; (21):72-4. [ Links ]
12. Guillén R, Velázquez G, Lird G, Espínola C, Laconich M, Meyer M et al. Estudio multicéntrico de enterobacterias productoras de betalactamasas de espectro extendido: Detección de Genes blaCTX-M2 y blaPER-2. LabCiencia. 2009; 1: 12-4. [ Links ]
13. Zhang K, Sparling J, Chow BL, Elsayed S, Hussain Z, Church DL, Gregson DB, Louie T, Conly JM. New quadriplex PCR assay for detection of methicillin and mupirocin resistance and simultaneous discrimination of Staphylococcus aureus from coagulase-negative staphylococci. J. Clin. Microbiol. 2004; 42(11):4947-55. [ Links ]
14. Quinteros M, Radice M, Gardella N, Rodriguez MM, Costa N, Korbenfeld D, et al. Extended-spectrumβ-lactamases in Enterobacteriaceae in Buenos Aires, Argentina, public hospitals. Antimicrob Agents Chemother. 2003; 47 (9):28. [ Links ]
15. Guzmán Blanco M, Labarca JA, Villegas MV, Gotuzzo E; Latin America Working Group on Bacterial Resistance. Extended spectrum β-lactamase producers among nosocomial Enterobacteriaceae in Latin America. Braz J Infect Dis.2014;18(4):421-33. [ Links ]
16. Casellas JM. Resistencia a los antibacterianos en América Latina: consecuencias para la infectología. Rev Panam Salud Publica. 2011; 30(6):519-28. [ Links ]
17. Sennati S, Santella G, Di Conza J, Pallecchi L, Pino M, Ghiglione B, Rossolini GM, Radice M, Gutkind G. Changing epidemiology of extended-spectrum β-lactamases in Argentina: emergence of CTX-M-15. Antimicrob Agents Chemother. 2012; 56(11):6003-5. [ Links ]
18. Nastro M, Montoto Piazza L, Saposnik E, García S, Barberis C, Vay Carlos et al. Resistencia a cefalosporinas de espectro extendido en enterobacterias sin AmpC inducible: Evaluación de los nuevos puntos de corte. Rev Argent Microbiol. 2012; 44(1):30-5. [ Links ]
19. Truppia LA, Mollerach A, Di Conza JA, Radice M, Mugna V, Méndez E, Gutkind G. Comparación de tres métodos microbiológicos para la detección de betalactamasas de espectro extendido en enterobacterias aisladas en Santa Fe (Argentina). Enferm Infecc Microbiol Clin 2005; 23(9):525-8. [ Links ]
20. Hernández Pedrozo W, Ramos Godínez A, Nodarse Hernández, R, Padrón Sánchez, A, De Armas Moreno, E. Resistencia bacteriana en las bacterias productoras de betalactamasas extendidas (BLEE). Rev Cubana de Med Int Emerg. 2006; 5(1):256-64. [ Links ]
21. Ardanuy C. Epidemiología de las betalactamasas plasmídicas de espectro ampliado. Recuperado a partir de: http://seq.es/seq/html/revista_seq/0197/ponens.html [ Links ]
22. Seral-García C, Pardos de la Gándara M, Castillo-García F. Betalactamasas de espectro extendido en enterobacterias distintas de Escherichiacoli y Klebsiella. Enferm Infecc Microbiol Clin. 2010; 28(1):12-8. [ Links ]
23. Gaitán C Sandra L, Espinal M, Paula A. Caracterización molecular de Escherichiacoli y Klebsiella pneumoniae productores de β-lactamasas de espectro extendido en hospitales de la Región Caribe, Colombia. Rev chil. infectol. 2009; 26(3):239-46. [ Links ]
24. Bertona E, Radice M, Rodríguez CH, Barberis C, Vay C, Famiglietti A, et al. Caracterización fenotípica y genotípica de la resistencia enzimática a las cefalosporinas de tercera generación en Enterobacter spp. Rev. argent. microbiol. 2005; 37(4):203-8. [ Links ]
25. Cruz GR, Radice M, Sennati S, Pallecchi L, Rossolini GM, Gutkind G, et al. Prevalence of plasmid-mediated quinolone resistance determinants among oxyimino cephalosporin-resistant Enterobacteriaceae in Argentina. Mem. Inst. Oswaldo Cruz. 2013; 108(7):924-7. [ Links ]
26. García-Fulgueiras V, Bado I, Mota MI, Robino L, Cordeiro NF, Varela A, et al. Extended-spectrum β-lactamases and plasmid-mediated quinolone resistance in enterobacterial clinical isolates in the paediatric hospital of Uruguay. J Antimicrob Chemother. 2011; 66(8):1725-9. [ Links ]
27. Bartoloni A, Pallecchi L, Riccobono E, Mantella A, Magnelli D, Di Maggio T, et al. Relentless increase of resistance to fluoroquinolones and expanded-spectrum cephalosporins in Escherichia coli: 20 years of surveillance in resource-limited settings from Latin America. Clin Microbiol Infect. 2013; 19(4):356-61. [ Links ]
28. Melgarejo N, Martinez M, Franco R, Falcón M. Enterobacterias resistentes a Carbapenemes por producción de KPC, aisladas en hospitales de Asunción y Departamento Central. Rev. Salud Pública Para. 2013; 3(1):30-5. [ Links ]
29. Morejón García M. Carbapenemases, an actual threat. Rev Clin Esp. 2012; 211(4):187-91. [ Links ]
30. Bello H, Trabal N, Ibáñez D, Reyes A, Domínguez M, Mella S et al. β-Lactamasas de familias diferentes a TEM y SHV en cepas de Klebsiella pneumoniae subespecie pneumoniae aisladas en hospitales chilenos. Rev Med Chile. 2005;133:737-9. [ Links ]
Fecha de recepción: noviembre 2015. Fecha de aceptación: febrero 2016
Autor correspondiente: *Rosa Guillén. Instituto de Investigaciones en Ciencias de la Salud, UNA.
Email: rmguillenf@gmail.com