Serviços Personalizados
Journal
Artigo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares em
SciELO
Similares em
SciELO
Compartilhar
Memorias del Instituto de Investigaciones en Ciencias de la Salud
versão On-line ISSN 1812-9528
Mem. Inst. Investig. Cienc. Salud v.12 n.2 Asunción dez. 2014
ARTÍCULO ORIGINAL
Electrogramas auriculares endocárdicos anormales en pacientes de la tercera edad con fibrilación auricular paroxística idiopática
Abnormal atrial endocardial electrograms in aging patients with idiopathic paroxysmal atrial fibrillation
*Centurión OA, Shimizu A, Isomoto S, Konoe A, Yano K, Hashiba K
Departamento de Cardiología. Primera Cátedra de Clínica Médica. Hospital de Clínicas. Universidad Nacional de Asunción, Paraguay
División de Arritmias, Sanatorio Migone-Battilana, Asunción, Paraguay
Third Department of Internal Medicine, Nagasaki University School of Medicine,
Nagasaki, Japan
RESUMEN
Los pacientes de la tercera edad están particularmente predispuestos a desarrollar episodios de fibrilación auricular paroxística (FAP), pudiendo ser los cambios que experimenta el miocardio auricular un factor contribuyente a la aparición de este fenómeno con el correr de los años. Por ende, diseñamos este trabajo con la idea de investigar los cambios que se producen en los electrogramas auriculares endocárdicos registrados por medio de un mapeo intraauricular con catéter en pacientes con FAP idiopática en la tercera edad. Realizamos un mapeo endocárdico con catéter de la aurícula derecha en ritmo sinusal en 72 pacientes con FAP idiopática para evaluar la influencia de la edad avanzada en los electrogramas auriculares endocárdicos. Los electrogramas bipolares fueron registrados de 12 sitios de la aurícula derecha, y un electrograma endocárdico auricular anormal fue definido como aquel que posee una duración ≥100 ms, y/o 8 o más deflexiones fragmentadas. Se registraron 864 electrogramas auriculares endocárdicos que fueron analizados cuantitativamente. El número de electrogramas auriculares anormales, así como la máxima duración y el mayor número de deflexiones fragmentadas de los electrogramas auriculares endocárdicos en los pacientes con FAP idiopática tuvo una correlación significativamente positiva con la edad. Se observó que la edad avanzada altera las propiedades electrofisiológicas del miocardio auricular haciéndolo más susceptible a desarrollar episodios de FAP. Estos cambios electrofisiológicos son más extensos conforme aumenta la edad. Existe un aumento progresivo en la extensión de la anormalidad electrofisiológica del miocardio auricular en pacientes de la tercera edad con fibrilación auricular paroxística idiopática.
Palabras clave: tercera edad, fibrilación auricular paroxística idiopática, miocardio auricular, mapeo auricular endocárdico con catéter.
ABSTRACT
There is a predisposition to develop paroxysmal atrial fibrillation (PAF) in aging patients, and the atrial muscle changes due to the aging process could be a contributing factor to the development of this tachyarrhythmia. Thus, we designed this study to investigate the changes observed in the recorded atrial endocardial electrograms by means of an intra-atrial catheter mapping in patients with idiopathic PAF. We performed an endocardial mapping of the right atrium in 72 patients with idiopathic PAF during sinus rhythm to evaluate the influence of advancing age on the atrial endocardial electrograms. The bipolar electrograms were recorded at 12 sites of the right atrium and an abnormal atrial electrogram was defined as having a duration ≥100 ms, and/or eight or more fragmented deflections. We recorded 864 atrial endocardial electrograms that were quantitatively analyzed. The number of abnormal atrial electrograms, as well as the wider duration and the greater number of fragmented deflections of the atrial endocardial electrograms, showed a significant positive correlation with aging in patients with idiopathic PAF. It was observed that aging alters the electrophysiological properties of the atrial muscle increasing the susceptibility to develop episodes of PAF. These electrophysiological changes are more extensive in advancing age. There is a progressive increase in the extension of the electrophysiologically altered atrial muscle in aging patients with idiopathic PAF.
Keywords: advancing age, idiopathic paroxysmal atrial fibrillation, atrial myocardium, atrial endocardial catheter mapping.
INTRODUCCIÓN
Los pacientes en la tercera edad están particularmente predispuestos a desarrollar episodios de fibrilación auricular paroxística (FAP) y los cambios que experimenta el miocardio auricular con el correr de los años pueden ser un factor contribuyente a la aparición de esta taquiarrítmia. Se ha observado, en estudios histopatológicos, que la fibrilación auricular (FA) en algunos pacientes añosos está asociada a una pérdida de fibras musculares en el nódulo sinoauricular y sus cercanías sin una clara causa patológica (1). Se demostró que la pérdida de fibras musculares con la edad avanzada está acompañada de un aumento en el tejido fibroso tanto en el nódulo sinoauricular como en los tractos internodulares (2-4). En un trabajo de investigación histológica se sugirió fuertemente que la pérdida de fibras musculares y el aumento de la fibrosis en la aurícula es un lento pero continuo proceso que empieza cerca de los 60 años (3).
Es evidente que estos cambios estructurales en la histología del miocardio auricular producen a su vez cambios en las propiedades electrofisiológicas. Por ende, las fibras miocárdicas auriculares, obtenidas de pacientes con patología auricular, poseen un elevado potencial de membrana, una depresión de la amplitud máxima del potencial de acción y una disminución de la velocidad de despolarización diastólica (5-8). El acoplamiento eléctrico entre fibras adyacentes se produce con mayor dificultad cuando las fibras miocárdicas se encuentran rodeadas de septos de tejido conjuntivo. Los electrogramas auriculares endocárdicos (EAE) anormales registrados durante ritmo sinusal, mediante el mapeo endocárdico por catéter de la aurícula derecha, indican una actividad eléctrica local y contínua relacionada a una conducción anisotrópica, inhomogénea y retardada a través de un miocardio auricular patológico (9-11). Cuando las paredes auriculares se encuentran marcadamente alteradas y distorsionadas por los procesos fibrodegenerativos, la onda de despolarización debe cambiar de dirección frecuentemente de acuerdo a la orientación de las fibras miocárdicas, creando de esta manera sitios de bloqueo de conducción y reentrada (12-16).
Considerando que la edad avanzada tiene un efecto profundo sobre los cambios estructurales del miocardio auricular, y siendo que los electrogramas auriculares endocárdicos anormales representarían una actividad eléctrica local lenta y desincronizada a través de un miocardio auricular enfermo, sería razonable asumir que podrían existir cambios detectables en los electrogramas auriculares endocárdicos registrados mediante un mapeo auricular por catéter en pacientes de la tercera edad con fibrilación auricular paroxística idiopática.
MATERIAL Y MÉTODOS
Pacientes
Un total de 72 pacientes no consecutivos que tenían el diagnóstico de fibrilación auricular paroxística idiopática fueron sometidos a una evaluación electrofisiológica. Todos los pacientes fueron sometidos a un mapeo endocárdico de la aurícula derecha durante ritmo sinusal en el transcurso del estudio electrofisiológico. Todos los pacientes que presentaban enfermedad cardíaca orgánica, o insuficiencia cardíaca congestiva fueron excluidos del protocolo de estudio. Ningún paciente presentaba dilatación auricular por ecocardiografía.
El rango de edades oscilaba entre 18 y 82 años y el promedio de edad era de 59,0+16,3. Este grupo de pacientes estaba conformado por 24 mujeres y 48 hombres. La fibrilación auricular paroxística de todos los pacientes fue bien documentada por electrocardiogramas, monitoreo electrocardiográfico intrahospitalario, o por monitoreo electrocardiográfico ambulatorio Holter. El tiempo de recuperación del nódulo sinusal fue medido en todos los pacientes después de una sobre-estimulación auricular rápida "overdrive" (48,49) a una frecuencia que oscilaba de 70 a 210 latidos por minuto, por un período de un minuto en cada nivel.
Estudio Electrofisiológico
Todos los pacientes fueron estudiados en ayunas y sin sedación después de haber firmado el consentimiento informado correspondiente. La evaluación electrofisiológica de la gran mayoría de los pacientes fue realizada en el Departamento de Electrofisiología de la Tercera Cátedra de Clínica Médica del Hospital Universitario de Nagasaki, Japón, después de ser aprobada por el comité regional de ética en concordancia con los principios y guías para la experimentación humana detallados en la Declaración de Helsinki. Todos los fármacos fueron suspendidos por lo menos 72 horas antes del inicio del procedimiento.
La técnica de mapeo intra-auricular fue realizada con catéteres de electrodos bipolares (Nº 6F, USCI, Div. C.R. Bard, Billerica, MA, USA) insertados percutáneamente mediante la técnica Seldinger en la vena femoral derecha y en la vena subclavia izquierda, y luego avanzados hasta la aurícula derecha bajo observación fluoroscópica. La distancia entre los electrodos era de 10 mm y el diámetro del anillo del electrodo era de 2 mm.
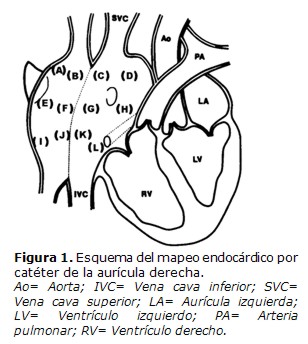
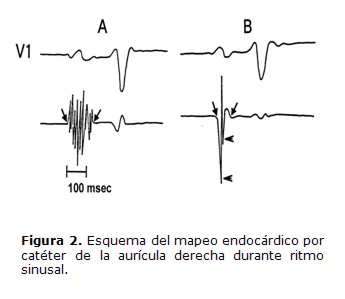
Todos los electrogramas endocárdicos de la aurícula derecha fueron registrados durante ritmo sinusal acompañados con una señal de calibración: 0.2 mV= 3 mm, y filtrados a 50 y 1000 Hz. Los electrogramas auriculares endocárdicos (EAE), conjuntamente con 3 derivaciones electrocardiográficas (I, aVF y V1), fueron controlados permanentemente en pantalla osciloscópica multicanal (Fukuda-Denshi, Polygraph, MIC-8800T, Fukuda-Denshi Inc., Tokyo, Japan) y simultaneamente registrados con un grabador de 12 canales (Ink-jet recorder, Siemens-Elema, 804, Solna, Sweden) a una velocidad del papel de 100 mm/segundo. Todos los datos obtenidos fueron grabados en cinta magnética durante todo el estudio. Los EAE permanecieron constantes y reproducibles en todos los registros de cada paciente. El catéter introducido a través de la vena femoral derecha fue utilizado para mapear las zonas altas y medias de la aurícula derecha, y el catéter introducido a través de la vena subclavia fue utilizado para mapear las zonas bajas de la aurícula derecha. Tal como lo demuestra la Figura 1, los EAE bipolares fueron registrados en 12 sitios de la aurícula derecha en cada paciente. Los EAE fueron registrados de las paredes anterior, lateral, posterior y medial de las zonas superior, media, e inferior de la aurícula derecha. La estabilidad del registro de los EAE fue asegurada mediante el registro en cada sitio de la aurícula por un tiempo mínimo de 10 segundos y mediante el uso de una"configuración en loop" del catéter. La posición de la punta del catéter fue verificada con fluoroscopía mono y multiplanar en presencia de por lo menos dos experimentados electrofisiólogos familiarizados con la técnica del mapeo endocárdico de la aurícula derecha. Se prestó particular atención para que todos los instrumentos estén totalmente aislados, con conexión a tierra. La Figura 2 muestra dos EAE, uno normal y otro anormal, registrados durante ritmo sinusal.
En la Figura 1 se observa el esquema del mapeo endocárdico por catéter de la aurícula derecha. Los electrogramas auriculares endocárdicos fueron registrados de 12 sitios de la aurícula derecha. Los sitios A-D corresponden a la parte alta de la aurícula derecha, los sitios E-H corresponden a la parte media, y los sitios I-L corresponden a la parte baja de la aurícula derecha. Los sitios A, E, y I corresponden a la región anterior de la aurícula derecha, los sitios B, F, y J corresponden a la región lateral, los sitios C, G, y K corresponden a la región posterior, y por último, los sitios D, H, y L corresponden a la región medial de la aurícula derecha. El catéter introducido a través de la vena femoral derecha fue utilizado para mapear los sitios ubicados en la parte alta y media de la aurícula derecha, mientras que el catéter introducido por la vena subclavia izquierda fue utilizado para mapear los sitios ubicados en la parte baja de la aurícula derecha.
En la Figura 2 se observan dos electrogramas auriculares endocárdicos obtenidos por mapeo endocárdico por catéter de la aurícula derecha durante ritmo sinusal. El electrograma A es un electrograma auricular endocárdico anormal con una duración de 135 ms y 11 deflexiones fragmentadas. En cambio, el electrograma B es un electrograma auricular endocárdico normal con una duración de 85 ms y con dos deflexiones fragmentadas.
Mediciones y Definiciones
La duración de un EAE se define como el tiempo transcurrido desde el inicio de la actividad eléctrica auricular más temprana que se desvía de la línea de base estable hasta el último punto del electrograma auricular donde la línea de base es nuevamente cruzada por última vez. El número de deflexiones fragmentadas fue obtenido contando el número de las deflexiones que apuntan hacia abajo de la línea de base estable.
En cada paciente fue determinado el electrograma de mayor duración y aquel con mayor número de deflexiones fragmentadas entre los 12 sitios de la aurícula derecha que fueron meticulosamente mapeados. Los valores cuantitativos estándares de los EAE fueron definidos en un estudio previo basado en las mediciones obtenidas de 516 electrogramas auriculares en pacientes con función normal del nódulo sinusal y sin fibrilación auricular paroxística (11). La duración promedio fue de 74+11 ms y el número promedio de las deflexiones fragmentadas fue de 3,9+1,3. Por lo tanto, un EAE fue definido como anormal si tenía una duración igual o mayor que 100 ms. y/o un número de deflexiones fragmentadas igual o mayor a 8 deflexiones (11).
Análisis Estadísticos de Datos
Los resultados son expresados como un valor promedio de desviación estándar. La significación estadística fue determinada mediante la prueba t de Student para unmatched pairs. La prevalencia fue comparada mediante la prueba de chi cuadrado. Los coeficientes de correlación fueron determinados por el análisis de regresión lineal.
La duración y el número de deflexiones fragmentadas de los EAE fueron analizados y medidos, por, al menos, dos investigadores en forma independiente. Un mínimo de 5 a 8 EAE de morfología uniforme fueron analizados en cada uno de los 12 sitios de la aurícula derecha, y aquellos valores con una variabilidad en más o en menos de 5 mm entre los investigadores fueron excluidos de la investigación.
RESULTADOS
Los resultados de nuestra investigación prospectiva sugieren los siguientes datos inéditos detallados a continuación. Un total de 864 electrogramas auriculares endocárdicos fueron registrados y cuantitativamente analizados en el presente estudio. El número máximo de deflexiones fragmentadas y la mayor duración de los EAE fueron determinados entre los 12 sitios de la aurícula derecha en cada paciente. A su vez, se obtuvo el número de electrogramas auriculares anormales en cada paciente.
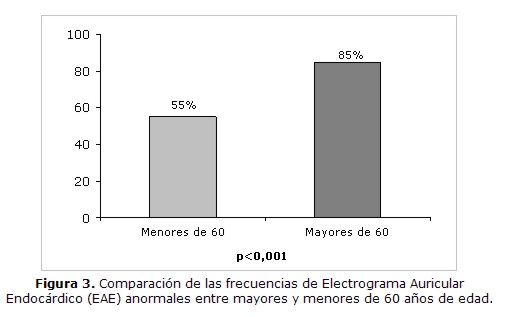
De los 72 pacientes con FAP idiopática, 38 pacientes tenían menos de 60 años de edad. Los electrogramas auriculares anormales fueron observados en 21 (55%) de estos 38 pacientes. Por otro lado, 34 pacientes tenían 60 o más años de edad. Los EAE anormales se observaron en 29 (85%) de estos 34 pacientes; p<0.001.
Los EAE anormales fueron observados en 21 (55%) de los 38 pacientes menores de 60 años y en 29 (85%) de los 34 pacientes mayores de 60 años; p<0,001 (Figura 3).
El número promedio de EAE anormales por cada paciente que fueron observados en los pacientes menores de 60 años fue de 1,52 ± 2,12 y en los pacientes mayores de 60 años fue de 3,24 ± 2,18; p<0,004. La mayor duración de EAE en pacientes menores de 60 años fue de 97,8 ± 65 ms. En cambio, la mayor duración de EAE en pacientes mayores de 60 años fue de 109,8 ± 16 ms; p<0,01. El número promedio máximo de deflexiones fragmentadas de EAE en pacientes menores de 60 años fue 8,16 ± 2,32. En cambio, el número promedio máximo de deflexiones fragmentadas de EAE en pacientes mayores de 60 años fue 9,67±2,43; p<0,03 (Tabla 1).
La correlación existente entre la máxima duración de los EAE y la edad demostró una relación significativamente positiva (r=0,37; p<0,0005). La comparación entre el número máximo de deflexiones fragmentadas de los EAE y la edad también reveló una correlación positiva significativa. El coeficiente de correlación fue de 0,31; p<0,005.
Por otro lado, la correlación entre el número total de EAE anormales en cada paciente con FAP idiopática y la edad también demostró una relación significativamente positiva, con un coeficiente de relación de (r=0,36; p<0,0005).
DISCUSIÓN
La realización de un mapeo endocárdico auricular por medio de catéteres durante el estudio electrofisiológico permite evaluar defectos en la conducción auricular, así como la secuencia de activación auricular anterógrada o retrógrada en pacientes con arritmias supraventriculares (17-21). El mapeo endocárdico auricular constituye parte de la rutina electrofisiológica en la evaluación de pacientes con taquicardias. La demostración de cambios electrofisiológicos en el miocardio auricular con el envejecimiento es consecuente con el concepto de que los cambios funcionales electrofisiológicos están directamente relacionados a los cambios histológicos del sistema de conducción del corazón con edad avanzada (22-24). Aquellos pacientes con edad avanzada están particularmente predispuestos a desarrollar episodios de fibrilación auricular y los cambios que experimenta el miocardio auricular con el correr de los años pueden ser un factor contribuyente a la aparición de éste fenómeno. La fibrilación auricular es una de las arritmias más comunes encontradas en la tercera edad, y es conocida como la taquiarritmia más común en las cardiopatías orgánicas. Existen varias condiciones precipitantes que proveen el entorno en el cual la fibrilación auricular se desarrolla, y la edad avanzada puede ser un factor contribuyente para su aparición.
El proceso de envejecimiento y su efecto en la histología del sistema de conducción del corazón han sido muy escasamente descritos en la literatura. Algunos investigadores han observado que existen cambios histológicos normales del miocardio auricular con la edad avanzada. Estos cambios incluyen una reducción en el número de células miocárdicas en el nódulo sinusal, una pérdida generalizada de fibras miocárdicas auriculares en las proximidades de los tractos internodales, así como también un aumento en la cantidad de tejido conjuntivo, lo cual conduce a una pérdida aparente de la continuidad de las fibras miocárdicas (1-4). Davies y Pomerance reportaron que la fibrilación auricular en algunos pacientes de edad avanzada estaba asociada con la pérdida de fibras musculares en el nódulo sinusal y sus proximidades, sin una clara causa patológica (3). Erickson y Lev demostraron cambios degenerativos en el sistema de conducción relacionados con la edad avanzada (25). Teniendo en mente estos cambios histológicos, es posible anticipar también cambios en las propiedades electrofisiológicas del miocardio auricular con el avance de la edad. Se ha demostrado la prolongación y dispersión de los períodos refractarios auriculares con la edad avanzada (26-28). Michelucci et al. sugirieron que el envejecimiento modifica la refractariedad auricular de una manera desuniforme, induciendo un progresivo aumento de la dispersión de los períodos refractarios auriculares (26). Ellos observaron que el envejecimiento induce una prolongación de la refractariedad auricular solamente en la parte alta de la aurícula derecha, pero no en las partes media y baja de la aurícula. Spach y Dolber demostraron una aurícula anisotrópica y desuniforme con el envejecimiento (29).
Nuestros resultados electrofisiológicos indican en forma inédita que la edad avanzada también ejerce su influencia sobre las características de los EAE registrados durante ritmo sinusal en pacientes con FAP idiopática. En esta investigación hemos encontrado y descrito una correlación significativamente positiva entre la edad y el número de EAE en pacientes con FAP idiopática. Los pacientes con más de 60 años de edad tenían un número promedio de EAE anormales significativamente mayor que los pacientes mas jóvenes. Adicionalmente, la máxima duración y el número máximo de deflexiones fragmentadas de los EAE también tuvieron una correlación significativamente positiva con la edad. Nuestros resultados demuestran un progresivo aumento en la extensión de la alteración electrofisiológica del miocardio auricular con la edad avanzada, en pacientes con FAP idiopática. Si bien existen diversos factores que influyen en la aparición de fibrilación auricular (30-38), nosotros creemos firmemente que los EAE anormales juegan un papel preponderante en el desarrollo de esta taquiarritmia auricular.
Un EAE anormalmente prolongado y fraccionado implica una actividad eléctrica local desincronizada relacionada a una conducción retardada, anisotrópica y desuniforme a través de un miocardio auricular patológico o alterado (36-44). Por ende, los EAE anormales indican áreas con histología distorsionada y conducción alterada que son substrato propicio para las arritmias de reentrada (39). Teniendo en cuenta que los EAE anormales aumentan con la edad avanzada, estos cambios electrofisiológicos podrían ser responsables de la facilidad con la que los pacientes de la tercera edad desarrollan episodios de fibrilación auricular paroxística.
Los resultados de nuestra investigación prospectiva sugieren los siguientes datos inéditos, (1) el número de EAE anormales en pacientes con FAP idiopática tiene una correlación significativamente positiva con la edad, (2) pacientes con FAP idiopática de 60 años o más tienen un número promedio de EAE anormales significativamente mayor que los pacientes más jóvenes, (3) la máxima duración y el número máximo de deflexiones fragmentadas de los EAE tienen una correlación significativamente positiva con la edad.
En conclusión, la edad avanzada altera las propiedades electrofisiológicas del miocardio auricular en pacientes con fibrilación auricular paroxística idiopática en la tercera edad. Los pacientes ancianos poseen una anormalidad de los electrogramas endocárdicos auriculares significativamente mayor que los pacientes menores de 60 años. Existe un aumento progresivo en la extensión de la anormalidad electrofisiológica del miocardio auricular en pacientes de la tercera edad con fibrilación auricular paroxística idiopática.
REFERENCIAS BIBLIOGRAFICAS
1. Davies MJ, Pomerance A. Pathology of atrial fibrillation in man. Br Heart J. 1972;34:520-25. [ Links ]
2. Lev M. Aging changes in the human sinoatrial node. J Geront. 1954; 9(1):1-9. [ Links ]
3. Davies MJ, Pomerance A. Quantitative study of aging changes in the human sinoatrial node and internodal tracts. Br Heart J. 1972; 34:150-52. [ Links ]
4. Hudson REB. The human pacemaker and its pathology. Br Heart J. 1960; 22(2):153-67. [ Links ]
5. Hordof AJ, Edie R, Malm JR, Hoffman BF, Rosen MR. Electrophysiologic properties and response to pharmacologic agents of fibers from diseased human atria. Circulation. 1976; 54(5): 774-9. [ Links ]
6. Hordof AJ, Spotnitz A, Mary-Rabine L, Edie RN, Rosen MR. The cellular electrophysiologic effects of digitalis on human atrial fibers. Circulation. 1978; 57(2):223-9. [ Links ]
7. Gelband H, Bush H, Rosen MR, Myerburg RJ, Hoffman BF. Electrophysiologic properties of isolated preparations of human atrial myocardium. Circ Res. 1972; 30(3): 293-300. [ Links ]
8. Mary-Rabine L, Albert A, Pham TD, Hordof A, Fenoglio JJ Jr, Malm JR, Rosen MR. The relationship of human atrial cellular electrophysiology to clinical function and ultraestructure. Circ Res. 1983; 52(2):188-99. [ Links ]
9. Centurión OA, Fukatani M, Konoe A, Tanigawa M, Shimizu A, Isomoto S, Kadena M, Hashiba K. Electrophysiological abnormalities of the atrial muscle in patients with sinus node dysfunction without tachyarritmias. Int J Cardiol. 1992; 37:41-50. [ Links ]
10. Centurión OA, Fukatani M, Konoe A, Tanigawa M, Shimizu A, Isomoto S, Kaibara M, Hashiba K. Different distribution of abnormal endocardial electrograms within the right atrium in patients with sick sinus syndrome. Br Heart J. 1992; 68:596-600. [ Links ]
11. Tanigawa M, Fukatani M, Konoe A, Isomoto S, Kadena M, Hashiba K. Prolonged and fractionated right atrial electrograms during sinus rhythm in patients with paroxysmal atrial fibrillation and sick sinus syndrome. J Am Coll Cardiol. 1991; 17:403-8. [ Links ]
12. Spach MS, Dolber PC. The relation between discontinuous propagation in anisotropic cardiac muscle and the "vulnerable period" of reentry. In: Zipes DP, Jalife J, eds. Cardiac Electrophysiology and arrhythmias. Orlando, Florida : Grune and Stratton; 1985. p. 241-52. [ Links ]
13. Spach MS, Dolber PC. Relating extracellular potentials and their derivatives to anisotropic propagation at microscopic level in human cardiac muscle: Evidence for electrical uncoupling of side-to-side fiber connections with increasing age. Circ Res. 1986; 58:356-71. [ Links ]
14. Spach MS, Miller WT, Dolber PC, Kootsey JM, Sommer JR, Mosher CE Jr. The functional role of structural complexities in the propagation of depolarization in the atrium of the dog. Cardiac conduction disturbances due to discontinuities of effective axial resistivity. Circ Res. 1982; 50:175-91. [ Links ]
15. Centurión OA, Fukatani M, Shimizu A, Konoe A, Isomoto S, Tanigawa M, Kaibara M, Yano K. Anterograde and retrograde decremental conduction over left-sided accessory atrioventricular pathways in the Wolff-Parkinson-White syndrome. Am Heart J. 1993; 125:1038-47. [ Links ]
16. Gallagher JJ, Gilbert M, Svenson RH, Sealy WC, Kasell J, Wallace AG. Wolff-Parkinson-White syndrome: The problem, evaluation, and surgical correction. Circulation. 1975; 51:767-85. [ Links ]
17. Centurión OA, Isomoto S, Hayano M, Ayano K. Evidence of quadruple anterograde atrioventricular nodal pathways in a patient with atrioventricular node reentry. J Electrocardiol. 1994; 27:71-8. [ Links ]
18. Josephson ME, Scharf DL, Kastor JA, Kitchen JG. Atrial endocardial activation in man: Electrode catheter technique for endocardial mapping. Am J Cardiol. 1977; 39:972-81. [ Links ]
19. Amat-y-Leon F, Dhingra RC, Wu D, Denes P, Wyndham C, Rosen KM. Catheter mapping of retrograde atrial activation: observations during ventricular pacing and AV nodal reentrant paroxysmal tachycardia. Br Heart J. 1976; 38:355-62. [ Links ]
20. Centurión OA, Isomoto S, Konoe A, Shimizu A, Hayano M, Yano K. Electrophysiologic demonstration of anterograde fast and slow pathways within the His bundle in patients with normal intraventricular conduction. Int J Cardiol. 1994; 44:251-60. [ Links ]
21. Centurión OA, Isomoto S, Fukatani M, Shimizu A, Hirata T, Hano O, et al. Relationship between atrial conduction defects and fractionated atrial endocardial electrograms in patients with sick sinus syndrome. PACE. 1993; 16:2022-33. [ Links ]
22. Escande D, Loisance D, Planche C, Coraboeuf E. Age-related changes of action potential plateau shape in isolated human atrial fibers. Am J Physiol. 1985; 249:H843-H50. [ Links ]
23. Isomoto S, Fukatani M, Konoe A, Tanigawa M, Centurión OA, Seto S, et al. The influence of advancing age on the electrophysiologic changes of the atrial muscle induced by programmed atrial stimulation. Jpn Circ J. 1992; 56:776-82. [ Links ]
24. Spach MS, Dolber PC, Anderson PAW. Multiple regional differences in cellular properties that regulate repolarization and contraction in the right atrium of adult and newborn dogs. Circ Res. 1989; 65:1594-611. [ Links ]
25. Erickson EE, Lev M. Aging changes in the human atrioventricular node, bundle, and bundle branches. J Geront. 1952; 7(1):1-12. [ Links ]
26. Michelucci A, Padeletti L, Fradella GA, Lova RM, Monizzi D, Giomi A, Fantini F. Ageing and atrial electrophysiologic properties in man. Int J Cardiol. 1984; 5(1):75-81. [ Links ]
27. Dubrow IW, Fisher EA, Denes P. The influence of age on cardiac refractory periods in man. Pediatr Res. 1976; 10:135-9. [ Links ]
28. Roberts NG, Gillette PC. Electrophysiologic study of the conduction system in normal children. Pediatrics. 1977; 60:858-63. [ Links ]
29. Spach MS, Dolber PC. Relating extracellular potentials and their derivatives to anisotropic propagation at microscopic level in human cardiac muscle. Circ Res. 1986; 58:356-71. [ Links ]
30. Centurión OA. Atrial fibrillation complicating congestive heart failure: Electrophysiological aspects and its deleterious effect on cardiac resyncronization therapy. J Atrial Fib 2009;2(1):37-49. [ Links ]
31. Centurión OA, Shimizu A, Isomoto S, Hano O, Hirata T, Konoe A, Kaibara M, Yano K. Incidence and electrophysiological characteristics of the supernormal atrial conduction in humans. J Electrocardiol 1994; 27:61-9. [ Links ]
32. Hashiba K, Tanigawa M, Fukatani M, Shimizu A, Konoe A, Kadena M, Mori M. Electrophysiologic properties of atrial muscle in paroxysmal atrial fibrillation. Am J Cardiol. 1989; 64:20-3. [ Links ]
33. Cosio FG, Palacios J, Vidal JM, Cocina EG, Gómez-Sánchez MA, Tamargo L. Electrophysiologic studies in atrial fibrillation. Slow conduction of premature impulses: a possible manifestation of the background for reentry. Am J Cardiol. 1983; 51(1):122-30. [ Links ]
34. Centurión OA, Isomoto S, Shimizu A, Konoe A, Hirata T, Kaibara M, Hano O, Yano K. Supernormal atrial conduction and its relation to atrial vulnerability and atrial fibrillation in patients with sick sinus syndrome and paroxysmal atrial fibrillation. Am Heart J. 1994; 128:88-95. [ Links ]
35. Centurión OA, Konoe A, Isomoto S, Hayano M, Yano K. Possible role of supernormal atrial conduction in the genesis of atrial fibrillation in patients with idiopathic paroxysmal atrial fibrillation. Chest. 1994; 106(3):842-47. [ Links ]
36. Centurión OA, Shimizu A, Isomoto S, Konoe A. Mechanisms for the genesis of paroxysmal atrial fibrillation in the Wolff-Parkinson-White syndrome: Intrinsic atrial muscle vulnerability vs. electrophysiological properties of the accessory pathway. Europace. 2008; 10(3):294-302. [ Links ]
37. Centurión OA. Clinical implications of the P wave duration and dispersion: Relationship between atrial conduction defects and abnormally prolonged atrial endocardial electrograms. Int J Cardiol. 2009;134 (1):6-8. [ Links ]
38. Centurión OA, Isomoto S, Shimizu A. Electrophysiological changes of the atrium in patients with lone paroxysmal trial fibrillation. JAFIB 2010; 3(1):1-9. [ Links ]
39. Centurión OA, Shimizu A, Isomoto S, Konoe A, Hirata T, Kaibara M, Yano K. Repetitive atrial firing and fragmented atrial activity elicited by extrastimuli in the sick sinus syndrome with and without abnormal atrial electrograms. Am J Med Sci. 1994; 304:247-54. [ Links ]
40. Hubbard ML, Henriquez CS. A microstructural model of reentry arising from focal breakthrough at sites of source-load mismatch in a central region of slow conduction. Am J Physiol Heart Circ Physiol. 2014; 306(9):H1341-52. [ Links ]
41. Nakahara S, Kamijima T, Hori Y, Tsukada N, Okano A, Takayanagi K. Substrate modification by adding ablation of localized complex fractionated electrograms after stepwise linear ablation in persistent atrial fibrillation. J Interv Card Electrophysiol. 2014; 39(2):121-9. [ Links ]
42. Ciaccio EJ, Biviano AB, Garan H. The dominant morphology of fractionated atrial electrograms has greater temporal stability in persistent as compared with paroxysmal atrial fibrillation. Comput Biol Med. 2013; 43(12):2127-35. [ Links ]
43. Ciaccio EJ, Biviano AB, Garan H. Computational method for high resolution spectral analysis of fractionated atrial electrograms. Comput Biol Med. 2013; 43(10):1573-82. [ Links ]
44. Ghoraani B, Dalvi R, Gizurarson S, Das M, Ha A, Suszko A, Krishnan S, Chauhan VS. Localized rotationa activation in the left atrium during human atrial fibrillation: relationship to complex fractionated atrial electrograms and low-voltage zones. Heart Rhythm. 2013; 10(12): 1830-8. [ Links ]
*Autor Correspondiente: Prof. Dr. Osmar Antonio Centurión, MD, PhD, FACC, FAHA. Profesor Titular de Medicina Interna. Departamento de Cardiología. Primera Cátedra de Clínica Médica, Hospital de Clínicas, Universidad Nacional de Asunción. San Lorenzo, Paraguay.
E-mail: osmarcenturion@hotmail.com
Fecha de recepción: enero 2014; Fecha de aceptación: agosto 2014