Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO
Related links
-
 Similars in
SciELO
Similars in
SciELO
Share
Memorias del Instituto de Investigaciones en Ciencias de la Salud
On-line version ISSN 1812-9528
Mem. Inst. Investig. Cienc. Salud vol.12 no.1 Asunción June 2014
ARTICULO ORIGINAL
Perfil de susceptibilidad a anti fúngicos de aislados de Candida spp por el método de microdilución. Nuevos puntos de cortes para fluconazol
Anti-fungal susceptibility profile of Candida spp isolates by the microdilution method. New cutoff points for fluconazole
Sanabria RI, *Samudio MI, Fariña NI-II Laspina FI, Figueredo L de II, Aguilar GIII, Espínola CIII
ILaboratorio de Microbiología. Instituto de Investigaciones en Ciencias de la Salud. Universidad Nacional de Asunción, Paraguay
IILaboratorio San Roque. Asunción, Paraguay
IIIInstituto de Previsión Social (IPS). Asunción, Paraguay
RESUMEN
Las infecciones por levaduras tienen gran importancia debido a su relativa alta frecuencia e incremento de la resistencia a los antifúngicos, especialmente a los derivados azólicos y, en particular, al fluconazol. El objetivo del estudio fue determinar la concentración inhibitoria mínima (CIM) del fluconazol y anfotericina B de aislados de Candida de pacientes ambulatorios y hospitalizados en Paraguay de mayo del 2010 a agosto del 2011, aplicando criterios nuevos y antiguos para el fluconazol. La CIM de los anti-fúngicos se determinó por el método de microdilución según la CLSI. Fueron incluidos 50 aislados de Candida, resultando predominante C. albicans (40%) seguido de C. parapsilosis y C. glabrata en igual proporción (20%), C. tropicales(16%) y C. krusei(4%). Con el antiguo criterio, cinco aislados resultaron resistentes al fluconazol (10%), dos fueron C. krusei con resistencia natural, dos C. tropicalis y uno C. albicans. Tres aislados tuvieron sensibilidad dosis dependiente (SDD), uno de cada especie de C. tropicales, C. parasilopsis y C. glabrata. Con el nuevo criterio, la resistencia aumentó a siete aislados (14%), dos de los cuales fueron clasificados previamente como SDD. Los nueve aislados de C. glabrata y dos de C. albicans de sensibles pasaron a SDD. Todos resultaron sensibles a anfotericina B. Con los nuevos puntos de corte hubo una variación importante en el perfil de sensibilidad, especialmente de C. glabrata, que apoya la necesidad de identificar especies, mantener una vigilancia constante de la resistencia a los anti fúngicos y correlacionar los resultados de sensibilidad con las respuestas clínicas al tratamiento.
Palabras clave: fluconazol, anfotericina B, Candida spp.
ABSTRACT
Yeast infections are very important because of their relatively high frequency and increased resistance to antifungal agents, especially to azole derivatives, and in particular, to fluconazole. The objective of this study was to determine the minimum inhibitory concentration (MIC) of fluconazole and amphotericin B in Candida isolates in clinically significant samples from hospitalized patients in Paraguay from May 2010 to August 2011 using the old and new criteria for fluconazole. The MICs of the antifungals were determined by the microdilution method (M27 A-2) according to CLSI recommendations. Fifty isolates were evaluated, being C. albicans the predominant species (40%) followed by C. parapsilosis and C. glabrata in equal proportion (20%), C. tropicalis (16%) and C. krusei (4%). Using the old cutoff, five isolates were resistant to fluconazole (10%), two naturally resistant isolates (C. krusei), two C. tropicalisand one C. albicans. Three C. glabrata and one isolates of each species of C. tropicales, C. parasilopsis y C. glabrata showed sensitivity dose dependent (SDD). With the new cutoff, the number of resistant isolates increased to seven (14%), of which two were SDD based on the old criteria. Nine C. glabrata and two C. albicans,previously classified as sensitive, changedto SDD. All isolates were susceptible to amphotericin B. With the new cutoff points, important variations were observed in the isolates susceptibility profiles, particularly in C. glabrata, supporting the need of species identification, permanent surveillance of the isolates resistance to anti-fungals and correlation of the sensitivity results with the clinical response to treatment.
Keywords: fluconazole, amphotericin B, Candida spp.
INTRODUCCIÓN
Las pruebas de sensibilidad a los antifúngicos constituyen en la actualidad una de las principales líneas de investigación en muchos laboratorios de microbiología debido al aumento del número de micosis a nivel mundial, la disponibilidad de nuevos agentes antifúngicos, la aparición de especies de hongos patógenos emergentes y los frecuentes reportes de resistencia asociados a fallas terapéuticas, sobretodo en pacientes inmunodeprimidos o con co-morbilidades (1-3).
Los estudios de sensibilidad son imprescindibles antes de instaurar un tratamiento. Existen varios métodos para la determinación de la sensibilidad a levaduras, entre ellos los métodos de difusión en agar con disco, con tabletas Neo Sensitans® de Rosco, el método de epsilometría de E test®, métodos comerciales colorimétricos como Sensititre® Yeast One, Fungitest®, y ASTY, la técnica no colorimétrica basada en dilución en caldo ATB- Fungus® y el método automatizado, Vitek 2® (4). Actualmente entre los métodos estandarizados para determinar CIM in vitro a levaduras se aceptan internacionalmente el método de microdilución recomendado por el Clinical Laboratory Standards Institute (CLSI) (5) y el documento del EUCAST (European Committee of Antimicrobial Susceptibility Testing) (6).
Para interpretar la concentración mínima inhibitoria (CMI) de fluconazol en los estudios de sensibilidad de levaduras el CLSI propone puntos de corte de =8 mg/L para las cepas sensibles, 16-32 mg/L para las cepas dosis dependientes y =64 mg/L para las cepas resistentes (5). Los miembros del EUCAST han considerado estos puntos de corte demasiado elevados y han propuesto otros de acuerdo con análisis poblacionales y el comportamiento clínico del antifúngico, recomendando para las cepas sensibles de C. albicans, C. parapsilosis, y C. tropicalis =2 mg/L, para las cepas dosis dependientes 4 mg/L y para las cepas resistentes >4 mg/L (6).
Recientemente, Pfaller y colaboradores (7) tomando en cuenta los mecanismos de resistencia a fluconazol y la resistencia cruzada con otros azoles, así como los puntos de corte del CLSI y del EUCAST, los perfiles epidemiológicos de distribución de las CMIs y la correlación clínica, sugieren una modificación de los puntos de corte para C. albicans, C. parapsilosis, C. tropicalis y C. glabrata, más en concordancia con los establecidos por el EUCAST. Los puntos de corte propuestos para el fluconazol frente a C. albicans, C. parapsilosis, y C. tropicalis son =2 mg/L para las cepas sensibles, 4 mg/L para las cepas dosis dependientes, y =8 mg/L para las cepas resistentes, con respecto a C. glabrata =32 mg/L para las cepas sensible dosis dependientes y =64 mg/L para las cepas resistentes. Estos puntos de corte para fluconazol propuestos por Pfaller y colaboradores ofrecen una mejor correlación de la sensibilidad con la respuesta clínica en las especies de interés clínico señaladas, por lo que el CLSI ha modificado sus puntos de corte para este antifúngico, estableciendo valores similares a los propuestos por estos autores (8).
En nuestro país no se tienen estudios publicados sobre pruebas de sensibilidad in vitro a los antifúngicos. Por ese motivo, se determinó la CIM del fluconazol y anfotericina B frente a aislados de Candida obtenidos de procesos infecciosos, utilizando el método de microdilución, recomendado por la CLSI. Además se han evaluado las variaciones en el perfil de sensibilidad a fluconazol de las especies de interés clínico aplicando los nuevos puntos de corte indicados.
MATERIALES Y MÉTODOS
Muestras. Fueron incluidos en el estudio aislados de Candida considerados significativos clínicamente, provenientes de pacientes ambulatorios y hospitalizados de muestras de hemocultivos, lavado broncoalveolar (BAL), orina, punción renal y catéter, del laboratorio San Roque y del laboratorio de Microbiología del Instituto de Previsión Social. Las levaduras aisladas fueron remitidas al laboratorio de Microbiología del Instituto de Investigaciones en Ciencias de la Salud para la confirmación de especie y estudios de sensibilidad in vitro.
Identificación de especies de Candida. Las especies de Candida se identificaron, analizando las características, bioquímicas y micromorfológicas de cada especie siguiendo procedimientos convencionales. Fueron cultivadas durante 48 hs en agar Sabouraud a 35ºC, y luego subcultivadas en medio cromogénico CHROMagar candida para la identificación presuntiva. Se empleó el microsistema comercial de identificación de especies de Candida API-20 C AUX (bioMeurieux, Francia), para la identificación definitiva.
Microdilución en placa. La técnica utilizada fue la de microdilución en caldo (CLSI, M27A-3) (4). Las drogas antifúngicas empleadas fueron la anfotericina B (Sigma, USA) y fluconazol (Pfizer, Inglaterra). La solución madre de fluconazol se preparó en agua hasta obtener una concentración de 1280 ug/ml y la de anfotericina B fue preparada disolviendo en dimetil sulfóxido (DMSO) hasta una concentración de 1600 µg/ml. Ambas soluciones fueron conservadas a -70ºC hasta su empleo.
Fueron utilizadas microplacas estériles de 96 pocillos, con fondo en U. Previo a la dilución seriada de cada antifúngico se realizó dilución 1:10 de la solución madre de fluconazol y una dilución 1:50 de la solución madre de anfotericina B. Se realizaron diluciones seriadas al doble de cada antifúngico en RPMI 1640, empezando por la columna 2 hasta la 11, quedando un volumen de 100µl de cada dilución.
Para la preparación del inóculo, se utilizaron levaduras de 24 hs en agar Sabouraud, las que fueron suspendidas en solución salina estéril, ajustando el inóculo a una concentración de 0,5 de la escala Mc Farland, midiendo turbidez hasta obtener una densidad óptica entre 0,12 a 0,13 en espectrofotómetro a 530nm y posteriormente una dilución 2000 hasta obtener una concentración 0,5-2,5 X 103 UFC/ml. La suspensión preparada fue dispensada en volumen de 100 µl en cada pocillo conteniendo los antifúngicos a distintas concentraciones, obteniéndose un volumen final de 200 µl con concentraciones finales del fluconazol de 64 - 0,12 µg/ml, y de la anfotericina B de 16 - 0,03 µg/ml.
Los pocillos de la columna 1 fueron controles negativos, conteniendo medio de cultivo RPMI. Los pocillos de la columna 12 fueron controles de crecimiento del inóculo en RPMI 1640. El control de calidad fue realizado con cepas controles, con CIMs conocidas frente a los antifúngicos probados C. parapsilosis ATCC 22019 y C. krusei ATCC 1789.
Las microplacas conteniendo las distintas concentraciones de antifúngicos y el inóculo de las diferentes cepas de Candida fueron incubadas a 35ºC durante 24 horas.
Interpretación de la microdilución. La concentración más baja de fluconazol donde se observó inhibición de por lo menos 80% del crecimiento y la menor concentración de anfotericina B, donde hubo ausencia total de desarrollo de la levadura, fue considerada la CIM. La lectura fue realizada comparando visualmente con los pocillos controles.
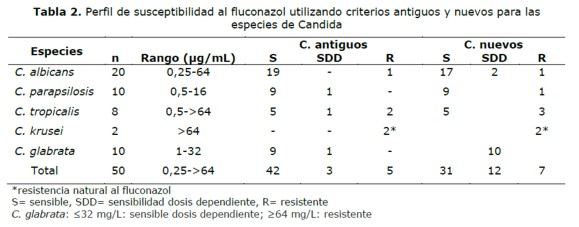
La susceptibilidad de las cepas frente al fluconazol fue clasificada como sensible (S), sensible dosis dependiente (SDD) y resistente (R), la susceptibilidad frente a la anfotericina B fue clasificada como sensible (S) y resistente (R) de acuerdo a puntos de corte según los viejos y nuevos criterios de susceptibilidad como se muestra en la Tabla 1.
Los datos fueron consignados en una planilla electrónica (SPSS 11.0) de manera a crear una base de datos. Los resultados fueron expresados en forma de distribución de frecuencias.
Consideraciones éticas. En este estudio se trabajó con aislados de levaduras y no directamente con pacientes. Los datos clínicos, demográficos y resultados de los pacientes fueron mantenidos en forma confidencial. Las levaduras fueron codificadas y solo los investigadores tuvieron acceso a los datos de los pacientes. No hubo un beneficio directo para el paciente, pero al conocer la frecuencia de especies y la susceptibilidad a los antifúngicos se espera un mejor manejo terapéutico de estas micosis.
RESULTADOS
Fueron incluidos en el estudio 50 aislados de Candida clínicamente significativos del Laboratorio de Microbiología del San Roque e Instituto de Previsión Social (IPS) en el periodo comprendido entre mayo 2010 a agosto 2011. Candida albicans resultó predominante 20 (40%), seguido de Candida parapsilosis 10 (20%), Candida glabrata 10 (20%), Candida tropicales 8 (16%) y Candida krusei 2 (4%).
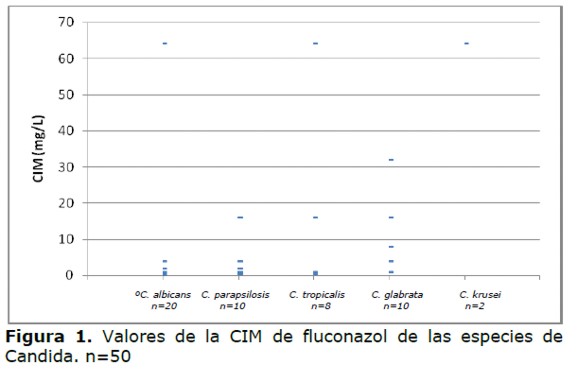
Los valores de la CIM del fluconazol oscilaron entre 0,25 µg/ml hasta mayor a 64 µg/ml. (Figura 1 y Tabla 2) y de la anfotericina B entre 0,0625 µg/ml hasta 1 µg/ml (Tabla 3). Los valores de la CIM variaron según las especies, así tanto para C. albicans como para C. parasilopsis la CIM 50 fue 1 µg/ml, para C. tropicalis fue 0,75 µg/ml y para C. glabrata 8 µg/ml.
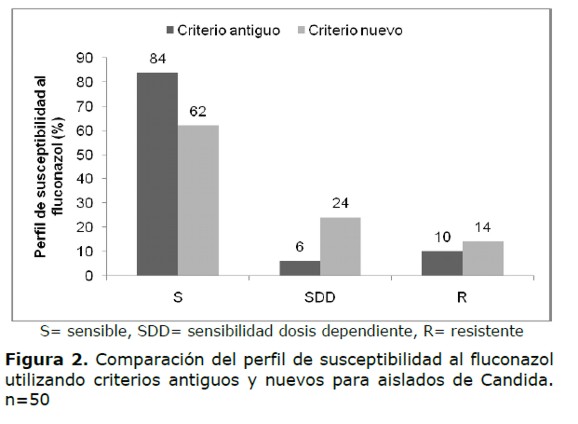
Si consideramos los criterios antiguos, cinco aislados (10%) fueron clasificados como resistentes, de los cuales dos aislados fueron de C. tropicalis, uno de C. albicans y dos de C. krusei, esta última, especie naturalmente resistente al fluconazol. Tres aislados fueron clasificados SDD, uno de C. tropicales,uno de C. parasilopsis y otro de C. glabrata.
Cuando se aplicaron los nuevos puntos de corte, dos C. albicans que habían sido SDD por el criterio antiguo pasaron a ser resistentes, por lo que aumentaron los aislados resistentes a siete (14%). Nueve aislados de C. glabrata y dos de C. albicans considerados anteriormente sensibles pasaron a SDD (Tabla 2 y Figura 2).
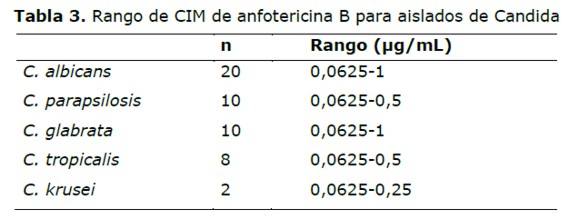
La CIM de anfotericina B fue =1 µg/mL para todos los aislados de las distintas especies de Candida, valor considerado sensible. La CIM 50 de la anfotericina B para el género Candida fue de 0,25 µg/mL.
DISCUSIÓN
La especie más frecuentemente aislada, fue C. albicans (40%), coincidente con numerosas publicaciones que reportan a esta especie como la más frecuentemente aislada de fungemias y otras infecciones invasivas (9-11). En frecuencia siguieron C. parapsilosis y C. glabrata, (20%), seguido de C. tropicalis(16%). Se ha demostrado un cambio epidemiológico continuo en la etiología de las candidiasis invasoras (12,13). En un estudio anterior hemos encontrado que C. tropicalis fue muy prevalente sobre C. parapsilosis(14).
La resistencia a fluconazol en el género Candida se mantiene baja en la mayoría de los trabajos publicados, a excepción de C. krusei que es resistente naturamente al fluconazol y de C. glabrata que presentasensibilidad disminuida a este fármaco (15). En el presente estudio, coincidente con numerosos reportes se ha obtenido buena sensibilidad frente al fluconazol, si se consideran todas las especies del género Candida (16-18), 90% de sensibilidad cuando se incluye a los sensibles dosis dependientes. Si bien cuando se consideran los nuevos puntos de corte para el fluconazol, se verifica una variación en la frecuencia de sensibilidad, se observa que un aislado de C. albicans de sensible dosis dependiente pasa a ser resistentey un aislado tanto de C. parapsilosis como de C. tropicalis, de sensibles dosis dependiente pasan a ser resistentes, resultando un 86% de sensibilidad.
El fluconazol es un triazol con demostrada eficacia para el tratamiento de las infecciones por levaduras (19,20,). El uso crónico de compuestos azólicos en la prevención de micosis sistémicas, sobre todo en pacientes con VIH, ha llevado a la selección de aislados resistentes a esta drogas (21). Mediante métodos moleculares se demostró que la resistencia de las levaduras a los azoles se debe principalmente a una disminución de la droga en el sitio de acción por bombas de eflujo, mutaciones del sitio de acción (Erg 11) e incremento en la síntesis del ergosterol (22).
Al analizar la sensibilidad por especies y considerando los antiguos puntos de corte para compararlos con la bibliografía se obtiene para C. albicans 95% de aislados sensibles y 5% de resistentes. Porte et al (23) obtuvieron 91,8% de aislados de C. albicans sensibles, 6,4% sensible dosis dependiente y 1,8% resistentes. Para C. tropicalis se obtuvo elevada resistencia al fluconazol, si bien el número de aislados de esta especie es bajo. Varios estudios mencionan a C. tropicalis como una de las especies con aumento en la resistencia a los azoles (24,25).
Todos los aislados sensibles de C. glabrata pasaron a ser SDD, debido a que actualmente no existe categoría sensible para esta especie. C. glabrata se caracteriza por presentar concentracion inibitoria mínima al fluconazol más elevada que otras especies de Candida(8). En el presente estudio se obtuvo una CIM 50 de 8 µg/mL, valor bastante superior a lo obtenido para las demás especies. Según estudios realizados en Argentina y Brasil C. glabrata es la segunda o tercera especie en frecuencia en el torrente sanguíneo entre las no albicans (), en estos estudios obtuvieron para C. glabrata valores de CIM 50 de 2 y 16 µg/mL respectivamente (9,11).C. glabrata es una levadura haploide, lo cual, induce el desarrollo de resistencia secundaria con el uso y favorece la aparición de resistencia cruzada con otros azoles. Esta característica es común en C. glabrata, además se ha reportado recientemente la aparición de resistencia al voriconazol, hecho que constituye una verdadera alerta (23, 26).
Además hemos aislado C. krusei, especie con resistencia intrínseca al fluconazol, ambos aislados presentaron CIM mayor a 64 µg/mL. El origen de la resistencia de esta especie al fluconazol se debe más a diferencias en la permeabilidad de la membrana que a la disminución de la afinidad del citocromo P450 de la levadura por la droga (15). Una opción terapéutica para esta especie sería el voriconazol, antifúngico al cual se mantiene susceptible (27).
Con respecto a la anfotericina B, todos los aislados fueron sensibles con valores de CIM menor o igual a 1 µg/ml y la CIM 50 de 0,25 µg/ml, coincidente con la mayoría de los trabajos (9,28). Aunque, existen reportes con aislados resistente a este antifúngico (10,16). Porte et al (23) reportaron un aislado de Candida krusei resistente a anfotericina B. Kuriyama et al en Cuba, reportaron resistencia en C. albicans 5%, C. glabrata 3,4% y C. krusei 3,1% (29).
En este estudio se ha utilizado el método recomendado por la CLSI, considerado de referencia, que podría ser utilizado para validar otros métodos comerciales y automatizados utilizados en nuestro medio.
Con los nuevos puntos de corte se observó una variación importante en el perfil de sensibilidad sobre todo de C. glabrata. Estos hallazgos nos obligan a realizar identificación de la especie y seguir vigilando la sensibilidad a los antifúngicos, especialmente la resistencia a los azoles que está incrementando en todo el mundo.
REFERENCIAS BIBLIOGRÁFICAS
1. Rodero L, Davel G, Soria M, Vivot W, Córdoba S, Canteros CR et al. Estudio multicéntrico de fungemias por levaduras en la República Argentina. Rev Arg Microbiol 2005;37:189-95. [ Links ]
2. Galván B, Mariscal F. Epidemiología de la candidemia en UCI. Rev Iberoam Micol 2006;23:12-5. [ Links ]
3. Pfaller MA. Antifungal susceptibility testing methods. Curr Drug Targets 2005;6:929-43. [ Links ]
4. Carrillo Muñoz A, Abarca L, Quindós G. Métodos colorimétricos para la determinación de la sensibilidad in vitro a los antifúngicos Rev Iberom Micol 2001; 18: 150-5. [ Links ]
5. Clinical and Laboratory Standards Institute. Reference method for broth dilution antifungal susceptibility testing of yeasts. Approved standard. Document M27-A3. 3rd ed. Wayne, PA: Clinical and Laboratory Standards Institute, 2008. [ Links ]
6. Rodriguez-Tudela JL, Arendrup MC, Barchiesi F, Bille J, Chryssanthou E, Cuenca-Estrella M, et al. EUCAST definitive document EDef 7.1: method for the determination of broth dilution MICs of antifungal agents for fermentative yeasts. Clin Microbiol Infect 2008; 14:398-405. [ Links ]
7. Pfaller MA, Andes D, Diekema DJ, Espinel-Ingroff A, Sheehan D. Wild-type MIC distributions, epidemiological cutoff values and species-specific clinical breakpoints for fluconazole and Candida: time for harmonization of CLSI and EUCAST broth microdilution methods. Drug Resist Updat 2010; 13:180-95. [ Links ]
8. Pfaller MA, Diekema DJ. Progress in Antifungal Susceptibility Testing of Candida spp. by Use of Clinical and Laboratory Standards Institute Broth Microdilution Methods, 2010 to 2012. J. Clin. Microbiol 2012; 50(9):2846-56. [ Links ]
9. Nucci M. Epidemiology of Candidemia in Latin America: A Laboratory-Based Survey. 2013 PLoS ONE 8(3):e59373. [ Links ]
10. Pfaller MA, Jones RN, Doern GV, Sader HS, Messer SA, Houston A et al, and The Sentry Participant Group. Bloodstream infections due to Candida species: SENTRY Antimocrobial Surveillance Program in North America and Latin America, 1997-1998. Antimicrob Agents Chemother 2000; 44:747-51. [ Links ]
11. Lopez Morala L. Fungemias en hospitales de la Ciudad de Buenos Aires, Argentina. Red de Micología de la Ciudad de Buenos Aires. Rev Iberoam Micol. 2012;29(3):144-49. [ Links ]
12. Pemán J, Cantón E, Miñana JJ, Florez JA, Echeverria J, Ortega DN, et al. Variación de la epidemiología de las fungemias y de la sensibilidad al fluconazol de los aislamientos de hemocultivos en los últimos 10 años en España: resultados del estudio FUNGEMYCA. Rev Iberoam Micol 2011; 28:91-9. [ Links ]
13. Almirante B, Cuenca-Estrella M. Candidemia: impacto de los estudios epidemiológicos en la terapéutica y en el pronóstico de una infección grave. Enferm Infecc Microbiol Clin 2011; 29:325-7. [ Links ]
14. Sanabria R, Samudio M, Fariña N, Laspina F, Ortellado de Canese J, Arbizu Ledesma G, et al. Identificación de especies de candida aisladas de pacientes ambulatorios, hospitalizados, e inmunocomprometidos en Paraguay. Mem. Inst. Investig. Cienc. Salud 2006; 2(2):45-9. [ Links ]
15. Sanglard D. Clinical relevance of mechanisms of antifungal drug resistance in yeasts. Enferm Infecc Microbiol Clin 2002;20(9):462-70. [ Links ]
16. Samra Z, Yardeni M, Peled N, Bishara J. Species distribution and antifungal susceptibility of Candida bloodstream isolates in a tertiary medical center in Israel. Eur J Clin Microbiol Infect Dis 2005; 24: 592-5. [ Links ]
17. Alvarado D, Diaz M, Silva V. Identificación y susceptibilidad antifungica de Candida spp aisladas de micosis invasora. Influencia del porcentaje de inhibición del crecimiento para la determinación del CIM. Rev Med Chile 2002; 130-6. [ Links ]
18. García L, García P, Marín P, Rodríguez M. Sensibilidad a Fluconazol de levaduras de interés clínico: nuevos puntos de corte. Rev Esp Quimioter 2012;25(4) 266-68. [ Links ]
19. Maertens JA. History of the development of azole derivatives. Clin Microbiol Infect 2004; 10 (Suppl. 1):1-10. [ Links ]
20. Barberán J, Mensa J, Fariñas C, Linares P, Serrano R, Menéndez R, et al. Recomendaciones de tratamiento antifúngico en pacientes con bajo grado de inmunodepresión. Rev Esp Quimioter 2008; 21:127-42. [ Links ]
21. Odds FC. Resistance of yeasts to azole: derivative antifungals. J Antimicrob Chemother 1993; 39:1696-9. [ Links ]
22. Loeffler J, Stevens D. Antifungal Drug Resistance. CID 2003:36 (Suppl 1) S31. [ Links ]
23. Porte L, León P, Gárate C, Guzmán AM, Labarca J, García P. Susceptibilidad a azoles y anfotericina B de aislados de Candida spp. Experiencia de una red de salud universitaria, entre 2004 y 2010 Rev Chil Infect 2012; 29 (2): 149-55. [ Links ]
24. Torres N, Alvarez C, Rondón M. Evaluación mediante tres técnicas de susceptibilidad a fluconazol en especies de Candida aisladas en pacientes con infecciones invasoras. Bogotá-Colombia. Rev Chil Infect 2009;26 (2): 135-43. [ Links ]
25. Muriel MA, Viscaino MJ Bilbao R, et al. Identificación de levaduras y sensibilidad in vitro a diversos antifúngicos Enferm Infecc Microbiol Clin 2000; 18: 120-4. [ Links ]
26. Sabatelli F, Patel R, Mann PA, Mendrick CA, Norris CC, Hare R, et al. In vitro activities of posaconazole, fluconazole, itraconazole, voriconazole, and amphotericin B against a large collection of clinically important molds and yeasts. Antimicrob Agents Chemother 2006; 50 (6): 2009-15. [ Links ]
27. Johnson EM. Issues in antifungal susceptibility testing. J.Antimicrobial. Chemother 2008; 61 Suppl 1:113.8. [ Links ]
28. Fernández Andreu C, Martínez Machín G, Illnait Zaragozí M, Perurena Lancha M, Águila Sánchez A, Brito Galloso M. Sensibilidad in vitrode cepas de Candidafrente a fluconazol y anfotericina B. Rev Cub Med Trop 2007;59(2):113-8. [ Links ]
29. Kuriyama T, Williams DW, Bagg J, Coulter WA, Reedy D, Lewis MAO. In vitro susceptibility of oral Candida to seven antifungal agents. Oral Microbiol Immunol 2005; 20:349-53. [ Links ]
*Autor Correspondiente: Dra. Margarita Samudio, Instituto de Investigaciones en Ciencias de la Salud,
Universidad Nacional de Asunción. Asunción, Paraguay.
Email: microbiologia@iics.una.py
Fecha de recepción: enero 2014; Fecha de aceptación: mayo 2014