Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO
Related links
-
 Similars in
SciELO
Similars in
SciELO
Share
Memorias del Instituto de Investigaciones en Ciencias de la Salud
On-line version ISSN 1812-9528
Mem. Inst. Investig. Cienc. Salud vol.11 no.2 Asunción Dec. 2013
TEMAS DE ACTUALIDAD
Reservorios mamíferos del Trypanosoma cruzi en Paraguay
Mammalian reservoirs of Trypanosoma cruzi in Paraguay
*Acosta N, López E
Departamento de Medicina Tropical, Instituto de Investigaciones en Ciencias de la Salud. Universidad Nacional de Asunción
RESUMEN
La transmisión enzoótica del Trypanosoma cruzi en Paraguay aún no ha sido bien determinada. Por lo tanto, todavía se desconocen varios aspectos de la dinámica de transmisión de este parásito en el medio selvático, como ser especies de reservorios naturalmente infectados, cepas circulantes y el grado de interacción con el ciclo doméstico. Con los estudios realizados hasta la fecha, se han identificado cinco especies como reservorios naturales del T. cruzi: Didelphis azarae, Monodelphis domestica, Dasypus novemcinctus, Euphractus sexcinctus y Chaetophractus spp. en el ambiente silvestre de zonas endémicas para la enfermedad de Chagas (Chaco y San Pedro). Entre éstas se destaca la especie Dasypus novemcinctus, en la cual se ha observado una alta prevalencia de infección de alrededor del 50%. En el ambiente doméstico, se han reportado perros infectados con este parásito en mayor proporción y en menor grado gatos, reses y cerdos.
Palabras claves: reservorios mamíferos - Trypanosoma cruzi-Paraguay.
ABSTRACT
In Paraguay, the enzootic transmission of Trypanosoma cruzi has not been well determined. Therefore, several aspects of the transmission dynamics of this parasite in the sylvatic environment are still unknown, such as naturally infected reservoir species, circulating strains and degree of interaction with the domestic cycle. The studies performed until now in the wild environment of endemic areas on Chagas disease (Chaco and San Pedro) have identified five species as natural reservoirs of T. cruzi: Didelphis azarae, Monodelphis domestica,Dasypus novemcinctus, Euphractus sexcinctus y Chaetophractus spp. Among them, Dasypus novemcinctus stands out for its high infection prevalence of around 50%. In the domestic environment, dogs infected by this parasite have been reported in higher proportion than cats, cattle and pigs.
Keywords: mammalian reservoirs - Trypanosoma cruzi-Paraguay.
INTRODUCCIÓN
La infección por Trypanosoma cruzi es considerada primariamente una zoonosis. Se han encontrado varias especies de animales selváticos naturalmente infectadas con este parásito, abarcando cerca de 73 géneros y 9 órdenes: Didelphimorphia (marsupiales), Cingulata (armadillos), Rodentia (roedores), Carnívora (carnívoros), Artiodactyla (cerdos, pecaríes), Chiroptera (murciélagos), Pilosa (perezosos, osos hormigueros), Lagomorpha (liebres y conejos) y Primata (primates) (1,2). A pesar de este amplio rango de hospederos, la importancia epidemiológica como reservorios del T. cruzi varía según la región geográfica y de acuerdo a la biología y ecología de estos mamíferos y su interacción con triatominos vectores y el hombre. Aunque todas las especies de mamíferos son en teoría susceptibles a la infección con el T. cruzi, existen algunas que han adquirido mayor relevancia, por la capacidad que han demostrado de mantener el parásito circulando en la naturaleza a través del tiempo. Entre éstas se destacan el D. novemcinctus (tatú hú) (Figura 1A),marsupiales del género Didelphis (comadreja) (Figura 1B) y Philander oposum, los cuales junto con osos hormigueros y perezosos son considerados los hospederos más antiguos de este parásito (2,3). La sangre de estos animales infectados, en la cual circula el T. cruzi, puede servir como fuente de alimento a triatominos selváticos (hematófagos) que a menudo colonizan sus refugios o áreas circundantes transmitiéndose de esta manera la infección a los insectos. Luego, las formas adultas de estos triatominos selváticos, que tienen gran capacidad de vuelo, pueden ser atraídas hacia las viviendas humanas por la luz o por el CO2 desprendido y así introducir el parásito al ambiente domiciliario. Otra posibilidad, es que animales infectados con hábitos sinantrópicos, como los marsupiales y roedores, frecuenten áreas cercanas a las viviendas, sirviendo como fuente de alimento a triatominos peridomiciliares e inclusive a los domiciliados, transmitiéndoles la infección. En muchas culturas indígenas y zonas rurales es común la caza y el consumo de animales selváticos (reservorios de este parásito) crudos o semicrudos, pudiendo ser ésta otra vía de transmisión. También se han reportado animales domésticos, como gatos, perros, conejos y peridomésticos, como cerdos, cabras y ovejas infectados con T. cruzi en varios países de Latinoamérica (3). Los mismos constituyen un permanente riesgo en la transmisión y dispersión de este parásito en el ambiente cercano al hombre, especialmente en aquellas viviendas infestadas con triatominos. Es así, que la identificación de especies silvestres y domésticas infectadas con el T. cruzi en un área determinada constituye un aspecto importante en la epidemiologia de la enfermedad de Chagas. En nuestro país se han realizado estudios sobre reservorios silvestres y domésticos, aunque no muchos. En el presente trabajo se hace una recopilación de los mismos.
RESERVORIOS SILVESTRES
Algunas especies de mamíferos silvestres se han estudiado en Paraguay como probables reservorios naturales del T. cruzi. En un trabajo de Canese de 1978 (4), se analizaron diecisiete animales silvestres pertenecientes a cuatro especies diferentes, incluyendo ocho ejemplares de Didelphis azarae (comadreja), cuatro deTolypeutes matacus (tatú bolita), tres de D. novemcinctus (tatú hú) y dos de Cerdocyon thous (zorro). Los animales se analizaron por gota gruesa y xenodiagnóstico (Figura 2). Dos ejemplares pertenecientes a la especie D. azarae fueron positivos para flagelados morfológicamente parecidos al T. cruzi, por lo tanto la prevalencia de infección fue de 11.7%. En este trabajo no se especificó la zona geográfica en la cual se capturaron los animales. Fujita et al. en 1994 (5) analizaron cuatro animales silvestres, provenientes de tres localidades del departamento de San Pedro, pertenecientes a tres especies diferentes: un ejemplar de D. albiventris (comadreja), dos de Euphractus sexcintus (tatú pojú) y uno de D. novemcinctus. Los animales se analizaron por examen serológico de aglutinación directa, microhematocrito, gota gruesa y hemocultivo de la punción cardiaca. Un ejemplar de E. sexcinctus resultó positivo en el cultivo realizado de la punción cardiaca, por lo tanto la prevalencia de infección fue del 25%. Los demás animales resultaron negativos con todas las técnicas utilizadas.
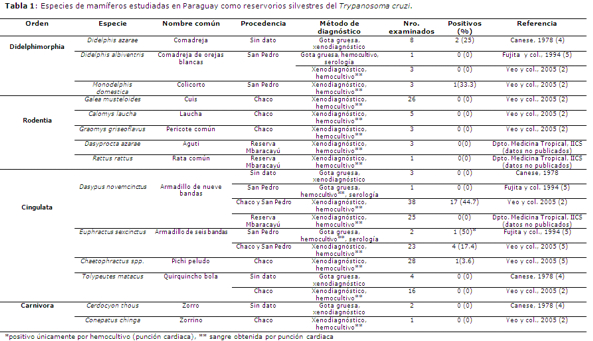
Yeo et al. 2005 (2) analizaron 146 animales silvestres de la zona de San Pedro y Chaco central, entre el 2000 y 2005, pertenecientes a diez especies diferentes, incluyendo: 38 ejemplares de D. novemcinctus, 23 de E. sexcinctus, 16 de T. matacus, 28 de Chaetophractus spp., 26 de Galea musteloides, 5 de Calomys laucha, 3 de Graomys griseoflavus, 3 de Monodelphis domestica, 3 de Didelphis albiventris y 1 de Conepatus chinga (zorrino). Los animales se analizaron por xenodiagnóstico y hemocultivo de sangre obtenida por punción cardíaca. Resultaron positivos 23 animales siendo, por lo tanto, la prevalencia de infección del 15.8%, incluyendo 17 D. novemcinctus, 4 E. sexcinctus, 1 Chaetophractus spp. y 1 M. domestica. Otras capturas se realizaron también en la reserva del Mbaracayú, departamento de Canindeyú en el año 2004 (Departamento Medicina Tropical, IICS, datos nos publicados) incluyendo animales silvestres pertenecientes a tres especies diferentes: Dasypus novemcinctus, 25 ejemplares, Dasyprocta azarae, 2 ejemplares y Rattus rattus, 1 ejemplar. Los mismos se analizaron por xenodiagnóstico y hemocultivo de punción cardíaca resultando todos negativos. En un trabajo reciente, se reportó un mono selvático de la zona de San Pedro infectado con este parásito (Acosta N, manuscrito en preparación). En la Tabla 1, se muestra una lista de las especies de mamíferos silvestres hasta ahora estudiadas en el Paraguay como reservorios del T. cruzi, las zonas donde fueron capturadas y las técnicas utilizadas para la detección de la infección.
De las especies de mamíferos silvestres estudiadas hasta ahora en nuestro país, los mayores índices de infección se observaron en armadillos, especialmente de la especie D. novemcinctus, en concordancia con estudios realizados en otros países, en los cuales se mencionan prevalencias de infección que van desde 4% a 50% desde el sur de los Estados Unidos hasta el Uruguay (3). Se cree que el tipo de refugio que estos animales construyen, favorece la formación de un microambiente adecuado para la colonización de triatominos selváticos y para la transmisión y mantenimiento de la infección (6).
Los mecanismos de infección y dispersión del T. cruzi entre animales, especialmente en el ambiente selvático, aun no son del todo claros. Se piensa que la vía oral de transmisión por ingestión de insectos (en el caso de los insectívoros) o de pequeños animales infectados (en el caso de los carnívoros) es la más común. Experimentalmente, la transmisión congénita fue descrita en murciélagos, de la especie Molossus molossus (7), pero no se ha observado en marsupiales ni en primates (8,9). La potencial significancia del marsupial Didelphis en la transmisión del T. cruzi en la naturaleza se ha incrementado desde el descubrimiento en sus glándulas anales de diferentes estadios del ciclo biológico del parásito. Así, en un didelfido infectado, las formas tripomastigotas sanguíneas pueden migrar hasta el lumen de las glándulas odoríferas y ahí se diferencian en formas epimastigotas, las cuales se multiplican por fisión binaria. Luego, se diferencian en tripomastigotes metacíclicos (formas infectivas) y pueden ser rociados con las secreciones de las glándulas. Por tanto, en las glándulas odoríferas de estos animales es observado el mismo ciclo de vida del T. cruzi que ocurre en el tracto digestivo de los insectos y se cree que este puede ser un mecanismo natural de dispersión de parásitos.
RESERVORIOS DOMÉSTICOS
Junto con las especies selváticas, los animales domésticos también constituyen importantes reservorios del T. cruzi en Latinoamérica. En nuestro país, en un trabajo reportado por Canese en 1978 (4), se analizaron 25 perros y 9 gatos por xenodiagnóstico y cuatro perros (16%) resultaron positivos. Sin embargo, no se menciona la zona de procedencia de los mismos. Chapman et al. en el año 1984 (10) analizaron 26 perros en una localidad chaqueña por xenodiagnóstico de los cuales 10 (38.4%) resultaron positivos. En esta comunidad, se encontró además una alta seroprevalencia en humanos (80%) y una elevada tasa de infección con T. cruzi (38%) de triatominos domésticos. En otro trabajo, realizado en el departamento de San Pedro por Fujita et al. en 1994 (5), se analizaron 112 animales domésticos, incluyendo seis grupos de animales: 37 reses, 2 caballos, 1 asno, 20 cerdos, 44 perros y 8 gatos. Los animales se analizaron por examen serológico de aglutinación directa, microhematocrito, gota gruesa y hemocultivo de la sangre obtenida por punción cardiaca. Veinticuatro animales (21.4%) fueron positivos por serología, los cuales fueron: 3 reses (títulos entre 1:32-1:64), 2 cerdos (títulos entre 1:64-1:128), 16 perros (títulos entre 1:32-1:1024) y 3 gatos (títulos entre 1:32-1:64). Estos animales fueron negativos para las otras pruebas diagnósticas. Adicionalmente, en 11 reses se pudo realizar el aislamiento de otro parásito flagelado, que fue identificado como Trypanosoma theileri.
Entre los animales domésticos, el perro es el que con mayor frecuencia se ha encontrado infectado en zonas endémicas para la enfermedad de Chagas. Así, se han reportado casos en Argentina (11-14), Brasil (15,16), Venezuela (17), México (18,19), Panamá (20), Colombia (15,21), Costa Rica (22) y Estados Unidos (23-26). Los índices de infección varían de acuerdo a las regiones, oscilando entre 9% y 50%. Se han usado perros centinelas en la vigilancia epidemiológica en áreas endémicas (11,18,27).
Animales peridomésticos como cabras, ovejas y cerdos también se han reportado infectados en varias regiones, como Brasil (28,29), México (30) y Chile (31,32), con índices de infección entre 2% y 26%.
Los mecanismos de infección de animales domésticos podrían ser similares a los observados en animales silvestres, especialmente si ellos se encuentran en áreas enzoóticas y de alta endemia, ya que así aumentan las probabilidades de entrar en contacto con insectos y animales infectados. La transmisión transplacentaria es considerada un importante mecanismo de transmisión en perros (27,33).
CONCLUSIONES
Se han reportado varias especies de mamíferos silvestres y domésticos infectadas con el T. cruzi en nuestro país, aunque en general se han realizado muy pocos estudios. En las zonas del Chaco y San Pedro, se han identificado cinco especies como reservorios naturales, especialmente armadillos y en el ambiente doméstico el perro es el que se ha encontrado infectado en mayor proporción.
Resulta esencial aumentar el rango de especies estudiadas para identificar nuevos hospederos e incorporar técnicas que permitan detectar infecciones aún con bajas parasitemias e infecciones mixtas con otros flagelados infectantes de mamíferos como el T. rangeli, entre otros. También en estos casos, es fundamental realizar el aislamiento del parásito, para tener la certeza de infección y así poder descartar posibles reacciones cruzadas en las pruebas serológicas o evitar confusiones con otros flagelados morfológicamente parecidos al T. cruzi. De esta manera quedan disponibles estos aislados para estudios posteriores relacionados al comportamiento biológico, para realizar comparaciones con los del ciclo domestico en cuanto a virulencia y patogenicidad y así determinar si existen diferencias o no entre los aislados de pacientes, animales silvestres y vinchucas de diferentes regiones.
Los estudios relacionados con reservorios son de importancia para los estamentos encargados de la elaboración de estrategias de control y de vigilancia epidemiológica, porque permiten evaluar la dinámica de transmisión del agente causal de la enfermedad de Chagas en zonas endémicas y el riesgo que implicaría la presencia de estos reservorios en áreas cercanas a las viviendas humanas, asociado con ciertas costumbres, como la caza y el consumo de animales silvestres.
REFERENCIAS BIBLIOGRÁFICAS
1.Hoare CA. The trypanosomes of mammals. A Zoological Monograph. Oxford, UK: Blackwell Scientific Publications. 1972; p. xvii-749. [ Links ]
2. Yeo M, Acosta N, Llewellyn M, Sanchez H, Adamson S, Miles GA et al. Origins of Chagas disease: Didelphis species are natural hosts of Trypanosoma cruzi I and armadillos hosts of Trypanosoma cruzi II, including hybrids. Int J Parasitol. 2005; 35(2):225-33. [ Links ]
3. Jansen AM, Roque, ALR. Domestic and wild mammalian reservoirs. En: Telleria J, Tibayrenc M, eds. American Trypanosomiasis, Chagas disease - one hundred years of research. London: Elsevier. 2010; p. 249–76. [ Links ]
4. Canese A. Datos actualizados sobre conocimientos epidemiológicos de la enfermedad de Chagas en el Paraguay. Rev Parag Microb. 1978; 13:7-19. [ Links ]
5. Fujita O, Sanabria L, Inchaustti A, De Arias AR, Tomizawa Y, Oku Y. Animal reservoirs for Trypanosoma cruzi infection in an endemic area in Paraguay. J Vet Med Sci. 1994; 56:305-8. [ Links ]
6. Gaunt M, Miles M. The ecotopes and evolution of triatomine bugs (triatominae) and their associated trypanosomes. Mem Inst Oswaldo Cruz. 2000; 95:557-65. [ Links ]
7. Añez N, Crisante G, Soriano PJ. Trypanosoma cruzi congenital transmission in wild bats. Acta Trop. 2009; 109:78-80. [ Links ]
8. Jansen AM, Madeira FB, Deane MP. Trypanosoma cruzi infection in the opossum Didelphis marsupialis: absence of neonatal transmission and protection by maternal antibodies in experimental infections. Mem Inst Oswaldo Cruz. 1994; 89:41-5. [ Links ]
9. Lisboa CV, Mangia RH, Rubião E, de Lima NR, das Chagas Xavier SC, Picinatti A et al. Trypanosoma cruzi transmission in a captive primate unit, Rio de Janeiro, Brazil. Acta Trop. 2004; 90(1):97-106. [ Links ]
10. Chapman MD, Baggaley RC, Godfrey-Fausset PF, Malpas TJ, White G, Canese J, Miles MA. Trypanosoma cruzi from the Paraguayan Chaco: isoenzyme profiles of strains isolated at Makthlawaiya. J Protozool. 1984; 31:482-6. [ Links ]
11. Gürtler RE, Cécere MC, Rubel DN, Petersen RM, Schweigmann NJ, Lauricella MA et al. Chagas disease in north-west Argentina: infected dogs as a risk factor for the domestic transmission of Trypanosoma cruzi. Trans R Soc Trop Med Hyg. 1991; 85(6):741-5. [ Links ]
12. Gurtler RE, Cecere MC, Lauricella MA, Cardinal MV, Kitron U, Cohen JE. Domestic dogs and cats as sources of Trypanosoma cruzi infection in rural northwestern Argentina. Parasitology, 2007;134:69–82. [ Links ]
13. Cardinal MV, Lauricella MA, Ceballos LA, Lanati L, Marcet PL, Levin MJ et al. Molecular epidemiology of domestic and sylvatic Trypanosoma cruzi infection in rural northwestern Argentina. Int J Parasitol. 2008 Nov; 38(13):1533-43. [ Links ]
14. Ragone PG, Pérez Brandán C, Padilla AM, Monje Rumi M, Lauthier JJ, Alberti D'Amato AM et al. Biological behavior of different Trypanosoma cruzi isolates circulating in an endemic area for Chagas disease in the Gran Chaco region of Argentina. Acta Trop. 2012; 123(3):196-201. [ Links ]
15. Rosypal AC, Corte´s-Vecino JA, Gennari SM, Dubey JP, Tidwell RR, Lindsay DS. Serological survey of Leishmania infantum and Trypanosoma cruzi in dogs from urban areas of Brazil and Colombia. Vet Parasitol. 2007; 149:172–7. [ Links ]
16. Roque ALR, Jansen AM. Importância dos animais domésticos sentinelas na identificação de áreas de risco de emergência de doença de Chagas. Rev Soc Bras Med Trop. 2008; 41:191–193. [ Links ]
17. Crisante G, Rojas A, Teixeira MM, Añez N. Infected dogs as a risk factor in the transmission of human Trypanosoma cruzi infection in western Venezuela. Acta Trop. 2006; 98:247–54. [ Links ]
18. Estrada-Franco JG, Bhatia V, Diaz-Albiter H, Ochoa-Garcia L, Barbabosa A, Vazquez-Chagoyan JC et al. Human Trypanosoma cruzi infection and seropositivity in dogs, Mexico. Emerg Infect Dis. 2006; 12(4):624-30. [ Links ]
19. Jiménez-Coello M, Guzmán-Marín E, Ortega-Pacheco A, Acosta-Viana KY. Serological survey of American trypanosomiasis in dogs and their owners from an urban area of Mérida Yucatán, México. Transbound Emerg Dis. 2010; 57(1-2):33-6. [ Links ]
20. Pineda V, Saldaña A, Monfante I, Santamaría A, Gottdenker NL, Yabsley MJ et al. Prevalence of trypanosome infections in dogs from Chagas disease endemic regions in Panama, Central America. Vet Parasitol. 2011; 178(3-4):360-3. [ Links ]
21. Falla A, Herrera C, Fajardo A, Montilla M, Vallejo GA, Guhl F. Haplotype identification within Trypanosoma cruzi I in Colombian isolates from several reservoirs, vectors and humans. Acta Trop. 2009; 110:15–21. [ Links ]
22. Zuriaga MA, Blandón-Naranjo M, Valerio-Campos I, Salas R, Zeledón R, Bargues MD. Molecular characterization of Trypanosoma cruzi and infection rate of the vector Triatoma dimidiata in Costa Rica. Parasitol Res. 2012; 11:1615-20. [ Links ]
23. Beard CB, Pye G, Steurer FJ, Rodriguez R, Campman R, Peterson AT et al. Chagas disease in a domestic transmission cycle, southern Texas, USA. Emerg Infect Dis. 2003; 9:103–5. [ Links ]
24. Brown EL, Roellig DM, Gompper ME, Monello RJ, Wenning KM, Gabriel MW, et al. Seroprevalence of Trypanosoma cruzi among eleven potential reservoir species from six states across the southern United States. Vector Borne Zoonotic Dis. 2010; 10(8):757-63. [ Links ]
25. Bern C, Kjos S, Yabsley MJ, Montgomery SP. Trypanosoma cruzi and Chagas' Disease in the United States. Clin Microbiol Rev. 2011; 24(4):655-81 [ Links ]
26. Patel JM, Rosypal AC, Zimmerman KL, Monroe WE, Sriranganathan N, Zajac AM et al. Isolation, mouse pathogenicity, and genotyping of Trypanosoma cruzi from an English Cocker Spaniel from Virginia, USA. Vet Parasitol. 2012; 187(3-4):394-8. [ Links ]
27. Castañera MB, Lauricella MA, Chuit R, Gurtler RE. Evaluation of dogs as sentinels of the transmission of Trypanosoma cruzi in a rural area of north-western Argentina. Ann Trop Med Parasitol. 1998; 92:671–83. [ Links ]
28. Herrera L, DAndrea PS, Xavier SCC, Mangia RH, Fernandes O, Jansen AM. Trypanosoma cruzi infection in wild mammals of the National Park Serra da Capivara, and its surroundings (Piauí, Brazil), endemic for Chagas disease. Trans R Soc Trop Med. Hyg. 2005; 99:379-88. [ Links ]
29. Valente VC, Valente SA, Noireau F, Carrasco HJ, Miles MA. Chagas disease in Amazon basin: association of Panstrongylus geniculatus (Hemiptera: Reduviidae) with domestic pigs. J Med Entomol. 1998; 35:99-103. [ Links ]
30. Salazar-Schettino PM, Bucio MI, Cabrera M, Bautista J. First case of natural infection in pigs. Review of Trypanosoma cruzi reservoirs in Mexico. Mem Inst Oswaldo Cruz. 1997; 92(4):499-502. [ Links ]
31. Correa V, Briceno J, Zuniga J, Aranda JC, Valdes J, Contreras MC et al. Infección por Trypanosoma cruzi en animales domésticos de sectores rurales de la IV región Chile. Bol Chil Parasit. 1982; 37:27-8. [ Links ]
32. Rozas M, Botto-Mahan C, Coronado X, Ortiz S, Cattan PE, Solari A. Short report: Trypanosoma cruzi infection in wild mammals from a chagasic area of Chile. Am J Trop Med Hyg. 2005; 73(3):517-9. [ Links ]
33. Barr SC, Van Beek O, Carlisle-Nowak MS, Lopez JW, Kirchhoff LV, Allison N, Zajac A et al. Trypanosoma cruzi infection in Walker hounds from Virginia. Am J Vet Res. 1995; 56(8):1037-44. [ Links ]
*Autor Correspondiente:Dra. Nidia Acosta. Departamento de Medicina Tropical, Instituto de Investigaciones en Ciencias de la Salud. Universidad Nacional de Asunción.
Email: nidacostag@gmail.com
Fecha de recepción: marzo 2013; Fecha de aceptación: agosto de 2013