Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO
Related links
-
 Similars in
SciELO
Similars in
SciELO
Share
Memorias del Instituto de Investigaciones en Ciencias de la Salud
On-line version ISSN 1812-9528
Mem. Inst. Investig. Cienc. Salud vol.11 no.2 Asunción Dec. 2013
ARTICULO ORIGINAL
Frecuencia de colonización por Estreptococo grupo B en embarazadas de 35 a 37 semanas en el Hospital Materno-Infantil San Pablo
Frequency of group B Streptococcus colonization in 35 to 37 weeks pregnant women in the San Pablo Maternal-Child Hospital
Ortiz MEI, *Fariña NII, Sanabria RRII, Caballero EI, Dacak RI, Haramoto NI, Acuña VI
ICentro de Salud Nº 5, Hospital Materno-Infantil San Pablo, Ministerio de Salud Pública y Bienestar Social
IIDepartamento de Análisis Clínicos y Microbiología, Instituto de Investigaciones en Ciencias de la Salud, Universidad Nacional de Asunción
RESUMEN
La colonización del Estreptococo grupo B en la embarazada está relacionada a patologías perinatales, constituyéndose en una causa muy importante de morbi-mortalidad neonatal. De manera a reducir dicha morbi-mortalidad, el Centro de Control y Prevención de Enfermedades Infecciosas de Estados Unidos desarrolló una estrategia que consiste en realizar el cultivo de muestra tanto vaginal como ano-rectal de todas las mujeres entre 35 y 37 semanas de gestación. El objetivo de este trabajo fue determinar la frecuencia de colonización por Estreptococo ß hemolítico grupo B en mujeres gestantes entre las 35-37 semanas de embarazo que concurrieron al Hospital Materno-Infantil San Pablo, Centro de Salud Nº 5, desde abril del 2010 a agosto del 2011. Se realizó un estudio con diseño observacional descriptivo de corte transverso. Las muestras fueron tomadas mediante hisopado de introito vaginal y ano-rectal, colocadas en medio de transporte Stuart y remitidas al Instituto de Investigaciones en Ciencias de la Salud para el cultivo en agar sangre, previo enriquecimiento en caldo Todd Hewitt. La identificación bacteriana se realizó mediante pruebas bioquímicas convencionales y la confirmación mediante aglutinación con látex. La frecuencia de colonización obtenida fue relativamente alta, de 23,6%. Los resultados de este estudio permiten dimensionar la problemática en nuestro país y evidenciar la necesidad de la implementación de un programa a nivel nacional para la detección del Estreptococo grupo B de forma rutinaria en las embarazadas. De esta manera, se podrá disminuir la morbi-mortalidad perinatal y materna con la administración oportuna del tratamiento profiláctico.
Palabras clave: embarazadas, estreptococo grupo B, colonización, frecuencia.
ABSTRACT
The colonization of Group B streptococcal in pregnant women is related to perinatal pathologies, being an important cause of neonatal morbi-mortality. In order to reduce this morbi-mortality, the Control Center for Infectious Diseases of United States developed a strategy that consisted in making culture of both vaginal and anal-rectal samples of all pregnant women who were in the 35-37 weeks of pregnancy. The objective of this work was to determine the colonization frequency of Group B βhemolytic streptococcus in pregnant women who were in the 35-37 weeks of pregnancy that attended the San Pablo Maternal-Child Hospital, Health Center No. 5 from April 2010 to August 2011. A cross-sectional descriptive observational study was performed. Sample collection was made by vaginal introitus and anal-rectal swabs, and then samples were placed in Stuart medium and sent to the Instituto de Investigaciones en Ciencias de la Salud for culture in blood agar, previously enriched in Todd Hewitt broth. The identification of the bacteria was made by conventional biochemical tests and confirmation by latex agglutination. The frequency of colonization found was relatively high (23.6%). The results obtained in this study allow dimensioning the problem in our country and show the necessity of the implementation of a national program for the routine detection of Group B streptococcus in pregnant women, in order to prevent perinatal and maternal morbidity and mortality by the opportune administration of prophylactic treatment.
Keywords: pregnant, group B streptococcus, colonization, frequency.
INTRODUCCIÓN
El estreptococo beta hemolítico grupo B o Streptococcus agalactie (SGB) es una bacteria grampositiva, huésped habitual del tracto genital inferior femenino, y también del tercio inferior del colon. La prevalencia de colonización de este germen en introito vaginal y en región ano-rectal es similar en mujeres embarazadas o no, con cifras que oscilan entre un 10-35% e incluso mayores (1-3).
Si bien SGB en la mujer no gestante no está relacionada con procesos patológicos, su presencia en el tracto genital inferior de la mujer embarazada está asociada a patologías perinatales tales como: corioamnionitis, rotura prematura de membranas, partos pre-término, meningitis, neumonía, sepsis neonatal entre las más importantes, que son mortales intra-útero y hasta después del mes del nacimiento y constituyen la causa del 80 a 90% de muerte neonatal (2-8). Según estudios realizados en EEUU, entre 1 a 2% de las madres colonizadas por esta bacteria desarrolla infecciones urinarias, endometritis, infecciones en la herida quirúrgica de las cesáreas, y también sepsis puerperal, cifra que se ve aumentada en países en vías de desarrollo (2). La sepsis puerperal constituye la cuarta causa de muerte materna en nuestro país, después del aborto, la toxemia y las hemorragias, desconociéndose el agente causal en la mayoría de los casos (9).
Sin medidas de prevención, del 40 al 70% de las mujeres colonizadas transmiten el EGB a sus recién nacidos durante el parto, y de los recién nacidos colonizados, del 1 al 2% desarrollan una infección precoz, lo que representa una incidencia media anual de 1-3 casos/1.000 nacidos vivos (10). Diferentes factores obstétricos favorecen el desarrollo de infección por SGB en el recién nacido; fundamentalmente, parto pre-término, rotura prematura de membrana, fiebre intraparto, bacteriuria por SGB durante el embarazo y haber tenido un hijo con infección por SGB; aunque más de la mitad de estas infecciones neonatales se presentan en ausencia de estos factores de riesgo (11,12).
La presencia de SGB se pone de manifiesto mediante el estudio bacteriológico de la flora del introito vaginal y la región ano-rectal, considerando que habitualmente la colonización produce flujo inespecífico, o bien es asintomático, siendo el tracto gastrointestinal el reservorio humano más probable para SGB y el tracto urinario el secundario (11). El Centro de Control y Prevención de Enfermedades Infecciosas de Atlanta (CDC), Estados Unidos, propuso en 1996 que la detección del SGB sea realizada entre las 35-37 semanas de gestación, teniendo un valor predictivo positivo del 85% y un valor predictivo negativo del 97% para colonización neonatal en el momento del parto, y recomendó la administración de profilaxis intraparto a todas las portadoras de SGB, así como a las gestantes con factores de riesgo que no se hayan realizado el cultivo(11,13,14).
En Paraguay, la detección del SGB figura en la ficha de control natal y perinatal de la Dirección de Salud Sexual y Reproductiva del Ministerio de Salud Pública y Bienestar Social (MSPBS), como uno de los estudios que debería realizarse a las embarazadas, pero esto solo se cumple en algunos casos, debido a la falta de laboratorios de bacteriología en muchos de los centros hospitalarios del MSPBS.
El objetivo de este estudio fue determinar la frecuencia de colonización por SGB en embarazadas entre 35 a 37 semanas de gestación que concurrieron al Hospital Materno-Infantil San Pablo (HMI-SP), Centro de Salud Nº 5, dependiente del MSPBS en muestras vaginal y ano-rectal, utilizando medios de enriquecimiento selectivos de acuerdo a las recomendaciones del CDC, además de caracterizar clínica y demográficamente la población estudiada.
Con este trabajo se pretende dimensionar la problemática en nuestro país y poner de manifiesto la necesidad de la implementación de un programa a nivel nacional para la detección del Estreptococo grupo B de forma rutinaria en las embarazadas.
MATERIALES Y MÉTODOS
Se realizó un estudio observacional, descriptivo, de corte transverso. Fueron incluidas en el estudio mujeres gestantes de 35 a 37 semanas que consultaron los días lunes y miércoles como parte de la consulta prenatal, (HMI-SP), desde abril del 2010 a agosto del 2011. Fueron excluidas del estudio aquellas gestantes con trabajo de parto, las que recibieron antibióticos 48 hs antes y/ o corticoides hasta 8 días antes de la toma de muestra, así como las que se aplicaron óvulos o desinfectantes vaginales o las que se realizaron Papanicolau hasta 72 hs previas a la toma de muestra.
Muestra- Todas las pacientes que cumplían con los criterios de selección fueron derivadas con pedidos numerados y duplicados de cultivo para SGB al Consultorio de Tracto Genital Inferior del HMI-SP, donde se tomaron dos muestras por paciente: un hisopado de introito vaginal (IV) sin colocación de espéculo y otro hisopado ano-rectal (AR), previa firma del consentimiento informado. Los hisopos fueron colocados en medio de transporte de Stuart y remitidos inmediatamente al Laboratorio de Microbiología del Instituto de Investigaciones en Ciencias de la Salud para el estudio microbiológico. Además, fueron registrados en una ficha clínica los datos demográficos: edad, procedencia, nivel de instrucción, como así también los clínicos: paridad, leucorrea, dispareunia, sinusorragia, fiebre, síntomas de infección urinaria, diabetes, alergia a la penicilina y antecedentes obstétricos como: partos prematuros, rotura prematura de membranas, fetos muertos, muertes peri natales e infecciones puerperales, por los médicos co-investigadores de los consultorios de pre-natal del HMI-SP.
Cultivo- Una vez recibidas las muestras de introito vaginal y de la región ano-rectal, cada una de ellas fue introducida en 2 ml de caldo Todd Hewitt con colistina (10 microgramos/ml) y ácido nalidíxico (15 microgramos/ml), Britania©, Argentina, e incubada por 18 hs a 35ºC. De estos caldos se realizaron sub-cultivos en placas de Agar-sangre (Agar base Columbia suplementado con 5% de sangre ovina), luego incubados a 35ºC en atmósfera de 5% de CO2 durante 48 hs.
Las colonias compatibles con SGB fueron posteriormente identificadas con las siguientes pruebas bioquímicas: catalasa, hidrólisis de la esculina en presencia de bilis, desarrollo en caldo hipersalado (ClNa 6.5%) y reacción de CAMP. Todos los aislamientos con características bioquímicas de SGB fueron confirmados por serología mediante la técnica de aglutinación con partículas de látex, Biomerieux©, Francia. El estudio se consideró positivo para SGB, cuando se demostró su presencia en por lo menos una de las localizaciones estudiadas. El resultado del cultivo fue informado al investigador principal, quien se encargó de adjuntar a la ficha clínica y dar aviso a la paciente.
Profilaxis- A todas las pacientes con resultados positivos para SGB se les administró tratamiento profiláctico inmediatamente y luego en el momento del parto siguiendo las recomendaciones de la OMS. La medicación fue proporcionada en forma gratuita.
Gestión y análisis de datos- Los datos obtenidos del estudio fueron almacenados en una planilla electrónica Micro Excel en base a una ficha previamente codificada y analizados por EPI-INFO versión 3.5.1, utilizando estadística descriptiva e inferencial.
Cuestiones éticas- El protocolo de investigación fue aprobado por el Comité Ético y Científico del Instituto de Investigaciones en Ciencias de la Salud, Universidad Nacional de Asunción. El estudio se ajustó a los principios éticos de la investigación clínica. Se obtuvo consentimiento informado de todas las gestantes incluidas en el estudio, y sus datos se manejaron en forma confidencial. Tanto los estudios como el tratamiento administrado fueron gratuitos.
RESULTADOS
Fueron estudiadas 203 embarazadas, de las cuales en 48 se obtuvo aislamiento de SGB al menos en uno de los sitios anatómicos estudiados, por lo tanto la frecuencia de colonización fue de 23,6%.
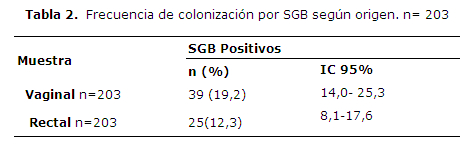
En 16 pacientes, el aislamiento fue tanto de hisopado vaginal como rectal, en 23 casos fue solo de la muestra vaginal y en 9 casos solamente de la muestra rectal (Tabla 1).
La frecuencia de colonización por SGB fue 19,2% al considerar solamente las muestras vaginales, y 12,3% cuando se consideró solo las muestras rectales (Tabla 2).
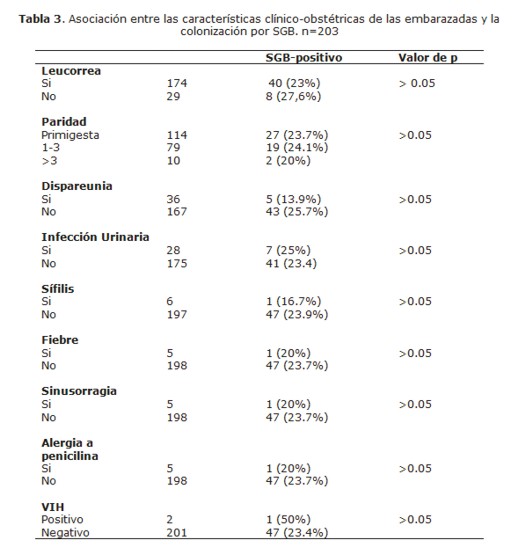
En la Tabla 3 se observa la asociación entre la frecuencia de colonización por SGB y las principales características clínico-obstétricas como leucorrea, paridad, dispareunia, infección urinaria, sífilis, fiebre, sinusorragia, alergia a la penicilina y VIH. No se observó asociación estadísticamente significativa con ninguna de ellas.
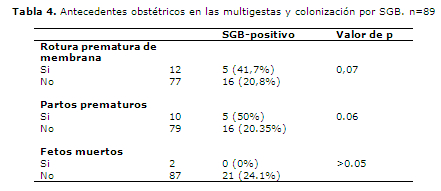
En la Tabla 4 se analizan los antecedentes obstétricos de las multigestas con referencia a la colonización por SGB, observándose una tendencia entre rotura prematura de membrana y partos prematuros con colonización positiva.
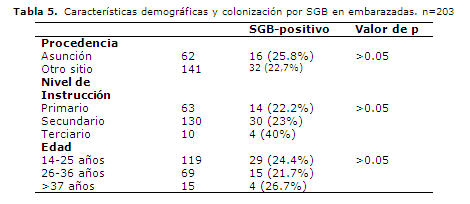
En la Tabla 5 se presenta la frecuencia de colonización en relación a las características demográficas como procedencia, nivel de instrucción y edad, en donde no se aprecia diferencia significativa.
DISCUSIÓN
En el presente estudio, la frecuencia de colonización por SGB en muestra vaginal y ano-rectal de embarazadas entre 35 a 37 semanas de gestación que consultaron en el (HMI-SP), fue de 23,6%. Diversos estudios revelan cifras muy variables que van del 8% hasta 40% (1-3,10,15-18). Al comparar la frecuencia obtenida con otros trabajos de la región en los que se ha utilizado similar metodología, vemos que es alta en relación a lo reportado por Perazzi et al. en Argentina y Castellano et al. en Brasil que reportan frecuencias de 9,6% y 9,5% respectivamente (1,15). En cambio, es inferior a lo reportado en Chile por Diaz et al. que obtuvieron una frecuencia de colonización del 36,7% (18).
Es importante tener en cuenta que si el estudio se hubiera realizado solamente con muestras vaginales, el porcentaje de positividad hubiera sido menor, en un 4,4%, lo que confirma la necesidad de realizar toma de muestras en ambas localizaciones.
En un trabajo previo realizado en nuestro país, la prevalencia de portación encontrada en embarazadas fue del 12% (15/121), distribuida en 17% (9/52) para gestantes que consultaron en el Hospital Materno-Infantil Santísima Trinidad y 8% (6/69) para las del Centro Materno Infantil del Hospital de Clínicas, valores bastante menores a los obtenidos en el presente trabajo, probablemente debido a que no fueron utilizados medios de enriquecimiento selectivos para el cultivo en dicho estudio (19).
Si bien existen varios métodos para la detección del SGB como la utilización de placas primarias selectivas, de caldos de enriquecimiento selectivos, PCR de colonias presuntivas seleccionadas, PCR del medio de enriquecimiento selectivo, agar cromogénico para SGB o detección del pigmento carotenoide (20-23), en este trabajo se ha utilizado un enriquecimiento durante 18 hs en caldo Todd Hewitt con el agregado de dos antibióticos, colistina y ácido nalidixico para la inhibición del desarrollo de la flora gramnegativa, previo al sub-cultivo en agar sangre de carnero, como lo recomienda el CDC (11).
El documento del año 1996 del CDC recomendaba el tratamiento profiláctico considerando los factores de riesgo o teniendo en cuenta el cultivo positivo para SGB. Estudios posteriores estimaron que la aplicación de estrategias basadas en cultivo permiten prevenir más del 90% de los casos de infección neonatal por SGB, mientras que las basadas en factores de riesgo tales como parto pre-término, rotura prolongada de membranas, fiebre intraparto, bacteriuria por SGB, únicamente previenen del 50 al 60% (10). Por esta razón el CDC en el año 2002, en un nuevo documento recomienda realizar cultivo vaginal y rectal a todas las gestantes entre 35 a 37 semanas de gestación administrando profilaxis intraparto a las portadoras y ya no basarse en factores de riesgo sin la realización del cultivo (13). En países como Estados Unidos, en los que se ha implementado esta recomendación, se ha comprobado una disminución significativa de infecciones neonatales, mientras que la cantidad de mujeres portadoras ha permanecido sin cambios (24, 25).
En nuestro estudio, siguiendo las recomendaciones del CDC, todas las gestantes con cultivo positivo para SGB recibieron tratamiento antibiótico inmediatamente y además, durante el trabajo de parto se administraron las dosis correspondientes para la profilaxis del recién nacido a fin de evitar las gravísimas complicaciones que el SGB puede ocasionar.
Se han estudiado además, en este trabajo diversas variables demográficas: edad, procedencia, nivel de instrucción; clínico-obstétricas: leucorrea, sinusorragia, dispareunia, sífilis, VIH, diabetes, fiebre, infección urinaria y antecedentes obstétricos considerados factores de riesgo como rotura prematura de membranas, partos prematuros, fetos muertos, a fin de evaluar la relación de las mismas con la colonización por SGB. Se ha demostrado que no existe diferencia estadísticamente significativa con las características demográficas ni con las características clínico-obstétricas, obteniéndose sólo una tendencia significativa con los antecedentes considerados factores de riesgo como rotura prematura de membrana y parto prematuro. Estos hallazgos coincidentemente con el de otros autores, indica que es importante la realización del cultivo para confirmar la colonización del SGB a fin de instituir el tratamiento adecuado, ya que más de la mitad de las infecciones neonatales se presentan en ausencia de estos factores de riesgo (10,14-16).
Recientemente, en el año 2010, el CDC publicó un nuevo documento en el que se introducen algunas modificaciones al documento del año 2002. Este documento expone en detalle el procedimiento para el cultivo del SGB, establece que recuentos iguales o mayores a 104 UFC/mL de SGB en el urocultivo de la embarazada deben ser reportados, actualiza algoritmos para la detección del SGB y el tratamiento profiláctico en casos de: rotura prematura de membrana, parto prematuro y parto a término, modifica la dosis de penicilina G recomendada para la profilaxis y modifica el tratamiento para la gestante alérgica a la penicilina G (25).
Desde el año 2008, la República Argentina cuenta con una Ley que incorpora con carácter obligatorio como práctica rutinaria de control y prevención, la realización de la detección del SGB a todas las embarazadas con edad gestacional entre las semanas 35 y 37, presenten o no condiciones de riesgo (23). En el Paraguay, aún no se indica la búsqueda del SGB de forma rutinaria y obligatoria en las embarazadas y la profilaxis solo se realiza teniendo en cuenta los factores de riesgo recomendados por el CDC en el reporte del año 1996 (11).
Cabe recordar que en el Paraguay la muerte por causa de enfermedades neonatales ocupa el 5º lugar, siendo su incidencia más alta en los departamentos Central, Alto Paraná e Itapúa. En el año 2000 se producían 173 óbitos debido a infecciones del recién nacido, lo que sumado a las muertes por prematurez, neumonía, signos y hallazgos anormales, totalizaba 336, cifra que podría ser aun mayor teniendo en cuenta el sub-registro existente y estas cifras de mortalidad neonatal han tenido poca variación en los últimos diez años. Dentro de estas no se incluyen las muertes registradas intra-útero, un mes antes del nacimiento, que deberían ser clasificadas como muertes perinatales (9). Gran parte de estas muertes neonatales y perinatales podría deberse al SGB (2-8).
Hemos demostrado, con los resultados obtenidos en el presente trabajo, la necesidad de implementar en nuestro país un programa de detección de SGB en mujeres embarazadas entre las 35 a 37 semanas de gestación. La detección de SGB de carácter obligatorio en embarazadas implicaría una disminución de las tasas de morbi-mortalidad perinatal y materna, se ahorraría horas-cama de terapia, demandas que en muchas oportunidades no pueden ser satisfechas por falta de lugar en los centros especializados, disminuyendo el alto costo social que representan las graves secuelas que ocasiona la enfermedad y la muerte de un recién nacido o de una joven madre. Sería fundamental la implementación de un programa, en el que obstetras, neonatólogos, microbiólogos y todo el personal de salud trabajen de forma coordinada, que permita resolver las dificultades que conlleva en la práctica el desarrollo y la aplicación de un programa de profilaxis.
AGRADECIMIENTOS
Al Laboratorio Central de Salud Pública-Ministerio de Salud Pública y Bienestar Social, por la provisión de parte de los reactivos e insumos para el cultivo.
A la Dra Margarita Samudio del Instituto de Investigaciones en Ciencias de la Salud, por la colaboración con los análisis estadísticos.
REFERENCIAS BIBLIOGRAFICAS
1. Perazzi B, Coppolillo E, García S, Cora Eliseth M, Ortiz E, Torrea R, Vay C et al. Colonización por Estreptococo grupo B en gestantes provenientes de un Hospital Universitario. Rev. Argent. Microbiol. 2007;39(2): 35-9. [ Links ]
2. Baker CJ, Edwards MS. Group B streptococcal Infections. Clin Perinatol. 1997, 24; 59-70. [ Links ]
3. Koneman E. Diagnóstico Microbiológico. 6ta ed. Buenos-Aires: Panamericana; 2008. [ Links ]
4. García SD, Cora Eliseth M, Lazzo MJ, Coppolillo, E., Barata, AD, de Torrea R et al. Portación de estreptococo grupo B en mujeres embarazadas. Rev Arg Microbiol. 2003; 35: 183-7. [ Links ]
5. Meis PJ, Goldenberg RL, Mwercer B, Moawad A, Das A, Nellis D, et al. The preterm prediction study: significance of vaginal infections. Am J Obstetric Gynecol.1995; 173 (4):1231-5. [ Links ]
6. Blackwell AL,ThomasPD, Wareham K, Emery SJ. Health gains from screening for infection of the lower genital tract in woman attending for termination of pregnancy. Lancet 1993; 342(8865):206-10. [ Links ]
7. German M, Krohn MA, Hillier SL, Eschenbach DA. Genital flora in pregnancy and its association with intrauterine growth retardation. J Clin Microbiol 1994; 32(9): 2162-8. [ Links ]
8. McDonald HM, O´Loughlin JA, Jolley P, Vigneswaran R, Mc Donald PJ. Vaginal infection and preterm labor. Br Obstet Gynecol 1991; 98(5) :427-35. [ Links ]
9. Ortiz, ME. Diagnóstico de la Situación actual de la Salud Pública en la República del Paraguay. Proyecto PAR 01.012. PNUD.2002. Paraguay. [ Links ]
10. De Cueto M, De La Rosa M. Prevención de la infección neonatal por Streptococcus agalactiae. Un tema consolidado. Enferm Infecc Microbiol Clin. 2003;21(4):171-3 [ Links ]
11. Center of Disease Control and Prevention. Prevention of perinatal group B streptococcal disease: A public health perspective. MMWR. 1996;45:1-24. [ Links ]
12. American College of Obstetricians and Gynecologysts. Prevention of early onset group B streptococcal disease in newborns. ACOG Comm Opin 1996; 173:1-8. [ Links ]
13. Cochrane Database. Intrapartum antibiotics for group B streptococcal colonisation. Syst.Rev(2): CD 000115,2000. [ Links ]
14. Centers for Diseases Control and Prevention. Prevention of Group B streptococcal perinatal disease. Revised guidelines from CDC. MMWR 2002;51: 1-22. [ Links ]
15. Castellano Filho SD, Da Silva VL, Nascimento TC, Toledo Vieira M, Galuppo Diniz C. Detection of group B Streptococcus inBrazilian pregnant women and antimicrobial susceptibility patterns. Brazilian Journal of Microbiology. 2010; 41: 1047-55. [ Links ]
16. Pogere A, Zoccoli CM, Tobouti NR, Freitas PF, D´Acampora AJ, Zunino JN. Prevalência da colonização pelo estreptococo do grupo B em gestantes atendidas em ambulatório de pré-natal Rev.Bras. Ginecol. Obstet.2005; 27 (4), 174-180. [ Links ]
17. Regan JA, Klebanoff MA, Nugent RP. The epidemiology of group B streptococcal colonization in pregnancy. Vaginal Infections and Prematurity Study Group Obstet Gynecol 1991; 77:604-10. [ Links ]
18. Díaz TM, Nieves BM. Comparación de medios de cultivos y procedimientos para detectar colonización por Streptococcus agalactiae en mujeres embarazadas. Rev Chil Infect 2008; 25 (2): 108-13. [ Links ]
19. Fariña N, Balmaceda MA, Sanabria R, Samudio M, Laspina F, Campuzano de Rolón A, Aparicio de Real C, Acosta A, Ortíz G. Portación rectovaginal de Estreptococo beta hemolítico grupo B en embarazadas del Centro Materno Infantil y Hospital Santísima Trinidad. Mem. Inst. Invest. Cienc. Salud/ publicación periódica en línea/2001-2002 citada 2003 abr 22/; 1(1) Disponible en: http://scielo.iics.una.py/pdf/iics/v2n1/v2n1a04.pdf [ Links ]
20. Paris F de, Mombach AB, Machado P, Conte Gheno, Ascoli BM, Pilger de Oliveira KR, Barth AB. Group B Streptococcus detection: comparison of PCR assay and culture as a screening method for pregnant women. Braz J Infect Dis. 2011; 15(4):323-7. [ Links ]
21. Fatemi F, Chamani-Tabriz L, Pakzad P, Zeraati H, Rabbani H, and Asgari S. Colonization Rate of Group B Streptococcus (GBS) in Pregnant Women Using GBS Agar Medium. Acta Medica Iranica. 2009; 47(1): 25-30. [ Links ]
22. Carvalho MG, Facklam R, Jackson D, Beall B, McGee L. Evaluation of Three Commercial Broth Media for Pigment Detection and Identification of a Group BStreptococcus (Streptococcus agalactiae). J Clin Microbiol 2009, 47(12) 4161-3. [ Links ]
23. Poder Legislativo. Ley Nº 26.239. Convenio de Cooperación Técnica y Científico Tecnológica entre la República Argentina y el Reino de Arabia Saudita, suscripto en Buenos Aires el 25 de septiembre de 2000. Novedades Legislativas. Legislación, Doctrina y Jurisprudencia. 2007;9(3):14. [ Links ]
24. CDC. Perinatal group B streptococcal disease after universal screening recommendations-United States, 2003-2005. MMWR 2007;56: 701-5. [ Links ]
25. CDC. Prevention of perinatal group B streptococcal disease. MMWR 2010;59: 1-36. [ Links ]
*Autor Correspondiente:Dra. Norma Fariña.Departamento de Microbiología. Instituto de Investigaciones en Ciencias de la Salud.
Email: normafarina@gmail.com. Tel/FAX: 595(21)480185
Fecha de recepción: Mayo de 2013, Fecha de aceptación: setiembre de 2013