Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO
Related links
-
 Similars in
SciELO
Similars in
SciELO
Share
Memorias del Instituto de Investigaciones en Ciencias de la Salud
On-line version ISSN 1812-9528
Mem. Inst. Investig. Cienc. Salud vol.11 no.1 Asunción June 2013
ARTICULO ORIGINAL
Aplicación de la PCR para la detección de género y complejos de Leishmaniaen diferentes tipos de muestras biológicas
Application of PCR for detection of Leishmania genus and complexes in different types of biological samples
*Chena LI,II, Nara EI, Canese AIII, Oddone RIV, Russomando GI
IDepartamento de Biología Molecular y Genética. Instituto de Investigaciones en Ciencias de la Salud. Universidad Nacional de Asunción. Paraguay
IIDepartamento de Parasitología. Laboratorio Central de Salud Pública, Ministerio de Salud Pública y Bienestar Social. Paraguay
IIIPrograma Nacional de Control de Leishmaniosis. SENEPA. Ministerio de Salud Pública y Bienestar Social. Paraguay
IVDepartamento de Producción Bioquímica. Instituto de Investigaciones en Ciencias de la Salud. Universidad Nacional de Asunción. Paraguay
RESUMEN
La leishmaniosis es una enfermedad producida por diferentes especies del protozoario Leishmaniaagrupados en complejos, es transmitida por flebótomos presentando una variedad de síntomas clínicos. La técnica reacción en cadena de la polimerasa (PCR) permite amplificar regiones blanco específicas del género Leishmaniay de los complejos Leishmania donovaniy Leishmania braziliensis, directamente en muestras biológicas sin cultivos in vitroprevio. En este estudio se realizó una evaluación descriptiva, durante el periodo 2001 a 2006, analizando 169 biopsias (piel y mucosas) y 31 aspirados de médula ósea en pacientes con sospecha clínica de leishmaniosis, además se evaluaron 44 muestras de bazo de caninos. Las muestras procedían de distintas zonas endémicas del país. Se detectó género Leishmaniaen el 71% de las biopsias (piel y mucosas), en 68% en los aspirados de médula ósea y en 82% de los bazos de caninos. Se identificó el complejo L. braziliensis en los pacientes con leishmaniosis cutánea y mucosa y el complejo L. donovanien pacientes con la forma visceral. Estos resultados han demostrado la utilidad de la técnica de PCR para la detección y caracterización de los parásitos de Leishmaniaen distintas muestras biológicas.
Palabras claves: Leishmania, caracterización molecular, reacción en cadena de la polimerasa (PCR).
ABSTRACT
Leishmaniasis is a disease caused by several species of Leishmaniaprotozoan that are grouped in complexes and transmitted by sandflies, presenting a variety of clinical symptoms. The polymerase chain reaction (PCR) allows the amplification of specific target regions for Leishmania genus and Leishmania donovaniand Leishmania braziliensis complexes directly in biological samples without previous in vitroculture. In this study, a descriptive evaluation was carried out between 2001 and 2006 by analyzing 169 biopsy samples (skin and mucous membranes) and 31 bone marrow aspirates from patients with clinical suspicion of leishmaniasis as well as 44 spleen samples from canine. The samples came from different endemic areas of the country. Leishmaniawas detected in 71% of the biopsies (skin and mucous membranes), in 68% of the bone marrow aspirates and in 82% of the dog spleen samples. L. braziliensis complex was identified in patients with cutaneous and mucous leishmaniosis and L. donovanicomplex in patients with the visceral form. These results showed the usefulness of PCR for the detection and characterization of Leishmania parasites in different biological samples.
Keywords: Leishmania, molecular characterization, polymerase chain reaction (PCR).
INTRODUCCION
La leishmaniosis es una enfermedad endémica en muchas áreas tropicales y subtropicales de América, en donde constituye un importante problema de salud pública. El control de la leishmaniosis en el Nuevo Mundo es complicado, debido a la variedad de especies de Leishmania, a los diferentes patrones epidemiológicos y a la diversidad de manifestaciones clínicas (1).
Los parásitos de éste género son capaces de producir un amplio espectro de manifestaciones clínicas en el humano que van desde infecciones asintomáticas, pasando por desfiguraciones notorias en la leishmaniosis mucocutánea hasta una forma potencialmente fatal en la leishmaniosis visceral (2-4).
La clasificación de especies inicialmente fue basada en criterios extrínsecos, como son las características clínicas, geográficas y biológicas; tres de los complejos originalmente definidos fueron Leishmania mexicana, Leishmania braziliensis y Leishmania donovanique agrupan a varias especies (3-5). La leishmaniosis cutánea es causada por parásitos de especies pertenecientes a los complejos L. mexicanay L. braziliensis. La leishmaniosis mucosa es una forma invasiva ulcerativa que progresa a partir de la lesión inicial o algunas veces aparece años después de haber tenido una lesión cutánea y está más frecuentemente asociada al complejo L. braziliensis. La leishmaniosis visceral americana es causada por Leishmania infantum que pertenece al complejo L. donovani(4,6).
En el Paraguay existen zonas consideradas endémicas para algunas formas de la enfermedad, la forma tegumentaria abarca principalmente los departamentos de San Pedro, Caaguazú, Canindeyú y Alto Paraná, que juntos poseen casi el 80% de los casos totales del país (7) y para la forma visceral el 75% de los casos registrados en los últimos años pertenecían al departamento Central y el 25% restante distribuidos en Asunción, Cordillera, Paraguarí, Alto Paraná, Guaira e Itapuá (8,9). La leishmaniosis visceral canina (LVC) en nuestro país también ha ido en continuo aumento. Según datos del Centro Antirrábico Nacional (CAN), la incidencia en perros es alta, provenientes mayoritariamente del departamento Central y la ciudad de Asunción (9,10).
La Reacción en Cadena de la Polimerasa (PCR) es una herramienta molecular que presenta buena especificidad y sensibilidad y permite identificar el género y caracterizar los complejos de Leishmaniadirectamente en muestras biológicas (3,5) y puede ser utilizada para fines diagnósticos. Diferentes blancos de amplificación han sido utilizados, sin embargo los que presentan mayor sensibilidad son los que se encuentra en secuencias multicopias, como el gen de la subunidad pequeña ribosomal (SSU rRNA), secuencias repetitivas del DNA genómico, secuencias de los minicírculos de DNA del kinetoplasto (kDNA), el gen del locus gp63, que han sido utilizados no solo para la detección sino para la identificación de los parásitos (11). La especificidad puede ser adaptada según la necesidad, a regiones específicas ya sean conservadas o variables como blanco (12).
Para la detección del género Leishmania y para identificar miembros del complejo L. braziliensis se emplean con frecuencia técnicas que amplifican secuencias de los minicírculos del kDNA. ElkDNA es considerado como uno de los principales blancos, debido a la presencia de 10.000 a 20.000 copias por célula, lo cual incrementa la sensibilidad del ensayo (3, 9, 13,14). Para miembros del complejo L. donovani, agentes causantes de LV, se utilizan secuencias repetitivas del DNA de L. infantumcomo blanco de amplificación (15).
Esta detección e identificación de parásitos por métodos moleculares constituye un apoyo a las técnicas convencionales de diagnóstico permitiendo además realizar estudios epidemiológicos.
El presente trabajo fue realizado con el objetivo de detectar parásitos del género Leishmania y caracterizar los complejos circulantes en zonas endémicas del país, amplificando varias secuencias blanco del parásito por medio de la técnica PCR aplicada directamente a diferentes tipos de muestras biológicas de pacientes humanos y caninos.
MATERIALES Y MÉTODOS
1. Muestras: En el presente estudio descriptivo de corte transversal se analizaron 169 biopsias, que incluyeron 94 de lesiones de piel y 75 de lesiones mucosas de pacientes con sospecha de leishmaniosis tegumentaria y 31 aspirados de médula ósea de pacientes con sospecha de leishmaniosis visceral. Además, se evaluaron 44 muestras de bazo de caninos. Las muestras provenían de 8 Departamentos del país (Caaguazú, Alto Paraná, Canindeyú, Amambay, Concepción, Central, Caazapá, Cordillera) entre los años 2001 y 2006. Las muestras fueron procesadas en el Departamento de Biología Molecular y Genética del Instituto de Investigaciones en Ciencias de la Salud IICS-UNA.
2. Extracción de ADN: las muestras fueron inicialmente digeridas over nighta 55 °C, con un tampón de lisis (10 mM de Tris, 10% SDS) conteniendo 200 µg/mL de Proteinasa K. Luego de la lisis, se realizó la extracción de ADN y el proceso consistió de dos pasos de fenol-cloroformo (25:24) y uno de cloroformo puro final. El ADN fue precipitado con acetato de sodio 3M, pH 5.3, etanol 99,5% p.a. frio y una noche a –20°C. Finalmente, el producto de la extracción se resuspendió en 100 µl de agua destilada y se empleó como molde en la reacción de PCR. El resto del DNA extraído se almacenó a -20 °C. Esta metodología se basó en la combinación de diversos protocolos pre establecidos y modificados (6,14), tomando como referencia la propuesta por Sambrook et al(16).
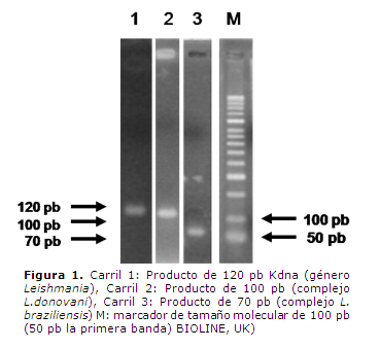
3. Reacción en Cadena de la Polimerasa (PCR): Se emplearon los siguientes pares de cebadores: 13A: 5-GTG GGG GAG GGG CGT TCT-3 y 13B: 5-ATT TTA CAC CAA CCC CCA GTT-3, descritos por Rodger et al. (13) que amplifican una región conservada del kDNA de 120 pb, para detección del género Leishmania, los cebadores MP1L: 5-TAC TCC ACA TGC CTC CTG-3 y MP3H: 5-GAA CGG GGT TTC TGT ATG C-3diseñados por López et al.(17)que amplifican parte de la región conservada y parte de la región variable del kDNA para detección de parásitos del complejo L. braziliensis, y generando un producto de 70 pb y los cebadores LV-P1: 5-ACG AGG TCA GCT CCA CTC C-3 y LV-P2:5-CTG CAA CGC CTG TGT CTA CG-3 diseñados por Piarroux et al.(15) que amplifican secuencias repetitivas del genoma de L. infantumperteneciente al complejo L. donovani y que generan unproducto de 100 pb.Las reacciones de PCR se realizaron en un DNA Termal Cycler 480 (Perkin Elmer, Norwalk, USA). La mezcla de reacción para la detección del género Leishmania y complejo L. braziliensiscontenía: Buffer1X, 1,5 mM MgCl2, 5% DMSO, 0,4 mM dNTPs (BIOLINE, UK), 0,2 mM de cada cebador, 1 unidad de Taq polimerasa (FERMENTAS, EU) para un volumen total de 50 µL y para la detección del complejo L. donovaniigual mezcla de reacción empleando 3 mM MgCl2.
4. Análisis de los productos de PCR: Los productos de PCR fueron analizados por electroforesis en un gel de agarosa al 2%, empleando solución tampón TAE (0.04 M Tris-acetato, 0.001 M EDTA). La electroforesis se realizó en cámaras MUPID-3 (Japón) a 100 V durante 30 minutos y las bandas visualizadas con luz UV previa tinción con bromuro de etidio (0,5 µg/mL). La imagen de los geles de agarosa fueron registrados empleando un analizador de imágenes digital (KODAK Digital Science DC120, USA).
5. Control de calidad: Se utilizó como control negativo: agua de resuspensión del ADN y como controles positivos: cepas de referencia: Leishmania (V.) braziliensis(MHOM/BR/75/M2903), Leishmania infantum (MHOM/BR/1974/PP75).
6. Análisis estadístico: Los datos fueron introducidos y almacenados en una base de datos, utilizando una planilla electrónica, el cálculo de los porcentajes fue realizado utilizando la herramienta Microsoft Excel versión 2003. Se empleó estadística descriptiva para referir género y complejos de Leishmaniaencontrados en las distintas muestras biológicas obtenidas de humanos y caninos.
7. Consideraciones éticas: El presente estudio cuenta con la aprobación del Comité de Ética del Instituto de Investigaciones en Ciencias de la Salud IICS-UNA. Las muestras de piel, mucosa y médula ósea de pacientes humanos sospechosos; fueron tomadas para diagnostico, debidamente codificadas y respetando en todo momento la confidencialidad de los datos y resultados de los pacientes. Las muestras de bazo de perros fueron obtenidas de animales con serología positiva para LVC luego de la eutanasia de los mismos, con el consentimiento previo de sus dueños.
RESULTADOS
1. Detección de parásitos de Leishmaniaen muestras biológicas por PCR
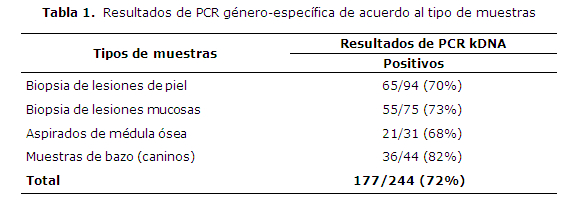
La presencia de ADN del parásito perteneciente al género Leishmania fue detectada en 177 muestras de las 244 estudiadas (72%), incluyendo muestras biológicas de pacientes humanos y caninos con sospecha y/o diagnóstico clínico y/o serológico positivo para la enfermedad. La tabla 1 muestra la distribución de los resultados de la PCR género-específica que amplifica la región conservada del kDNA de Leishmania. En pacientes humanos se analizaron 169 biopsias de piel y mucosas, de estas; 94 biopsias eran de lesiones cutáneas y 75 de lesiones mucosas detectándose Leishmaniaen 65/94 y 55/75 respectivamente; mientras que en aspirados de médula ósea se detectó el parásito en 21 de 31 muestras. En muestras de bazo de caninos se detectó Leishmaniaen 36 de un total de 44 muestras analizadas.
2. Caracterización de los complejos de Leishmania presentes, por PCR
De las 169 biopsias (piel y mucosas) obtenidas de los pacientes humanos se caracterizaron los complejos en 134, de las cuales 74 eran de lesiones cutáneas y 60 de lesiones mucosas (tabla 2). Todos correspondieron a parásitos del complejo Leishmania braziliensis. El complejo Leishmania donovanise detectó en 17 de los 31 aspirados de médula ósea de humanos y en 33 de 44 muestras de bazo de caninos (Tabla 2). Un total de 184 de las 244 muestras fueron caracterizadas en complejos.
La figura 1 muestra una electroforesis en gel de agarosa al 2% en donde se muestra una representación de los productos amplificados en las diferentes PCRs utilizadas para la detección de Leishmaniay la caracterización de los complejos en las diferentes muestras.
DISCUSIÓN
En nuestro país se encuentran zonas endémicas tanto para las formas cutánea y mucosa como para la visceral, comprendiendo zonas del norte, centro y este del país. Al presentarse diversas formas clínicas también se cuenta con una variedad de muestras biológicas que pueden ser empleadas para la detectar la presencia del parasito.
En el presente trabajo la técnica PCR permitió detectar el género Leishmaniay el complejo correspondiente directamente en diferentes tipos de muestras biológicas, biopsias de lesiones de piel y mucosas, aspirado de medula ósea y muestras de bazo de caninos, sin realizar la amplificación previa del parásito por medio del cultivo in vitro, constituyendo así un complemento de las técnicas convencionales de diagnóstico, ya que algunas veces estas no pueden llegar a definir los casos.
Por un lado las muestras analizadas tanto de humanos como de perros con sospecha de leishmaniosis visceral arrojaron positividad para el complejo L. donovani, confirmando el diagnóstico clínico y/o serológico presuntivo y por otro lado las muestras de lesiones de piel y mucosas de pacientes sospechosos de leishmaniosis tegumentaria, fueron caracterizadas dentro del complejo L. braziliensis.
En cuanto a la capacidad de detección de los cebadores empleados cabe destacar que se observó una pequeña diferencia; la detección de ADN del parasito fue ligeramente superior con cebadores complejo-especifico de L. braziliensis 134/169(79%),en relación a los cebadores género-especifico donde se amplificó 120 de 169 muestras de lesiones cutánea y mucosas (71%). La capacidad de detección observada con los cebadores específicos para el complejo L. donovanifue del 67% (50/75), aplicados en forma directa a las muestras biológicas (aspirados de medula ósea y muestras de bazo), un poco menor a lo observado empleando los cebadores que amplifican el género Leishmania57/75 (76%) para este tipo de muestras.
La diferencia en cuanto a detección podría deberse a que los cebadores utilizados en el estudio para detección de género Leishmania (13 A y 13 B) y complejo L. braziliensis(MP1L y MP3H) ofrecen ventajas como el blanco que amplifican, ya que estos reconocen secuencias presentes en los minicírculos del kinetoplasto kDNA, los cuales están presentes en un gran número de copias (10.000 y 20.000/parásito), otorgando una buena sensibilidad a la técnica, por otro lado también señalan Aviles et al.que el tamaño pequeño de los productos de las reacciones utilizando el kDNA, disminuye la probabilidad de que la polimerasa falle al completar la extensión o no sufra los efectos debidos a la degradación de la región blanco; esto es contrario a lo que si puede ocurrir con blancos genómicos, lo cual disminuye la sensibilidad de la reacción. Por otro lado, por la experiencia en el laboratorio, vimos que la concentración de ADN presente en la muestra influye en algunas reacciones de PCR, creemos que los cebadores 13A y 13B son más sensibles al exceso de ADN y la reacción se ve inhibida en esos casos, no así para las reacciones con los cebadores MP1L y MP3H.
Se vio una diferencia en cuanto a los tipos de muestras utilizadas para la detección del genero Leishmania en pacientes sospechosos de leishmaniosis visceral humanos y caninos, 55% de detección en aspirados de medula ósea de humanos en contraste con 75% en muestras de bazo de caninos. En este caso esto podría atribuirse al escaso material del cual se realizó la extracción de ADN, ya que la mayoría de las muestras de medula ósea analizadas fueron obtenidas de frotis en láminas de vidrio.
La identificación de Leishmania por la técnica de PCR y la factibilidad de su aplicación a distintas muestras biológicas constituye una importante ventaja y un apoyo al diagnóstico de rutina de la enfermedad, aunque esta técnica debe ser evaluada en cuanto a su sensibilidad y especificidad, comparada con una técnica gold estándar y definir así su capacidad diagnostica, la información que proporciona es epidemiológicamente relevante para identificar focos de transmisión activa y para el diseño de estrategias de control de la enfermedad.
AGRADECIMIENTOS
A los profesionales de la cátedra de Otorrinolaringología de la FCM-UNA, por su colaboración en la toma de muestra de los pacientes sospechosos de leishmaniosis mucosa, a los estudiantes Esquivel J, Duarte M, Domaniczky F de la cátedra de Microbiología de la FCM-UNA, por su colaboración en la toma de muestra de los caninos.
REFERENCIAS BIBLIOGRÁFICAS
1. Cupolillo E, Brahim LR, Toaldo CB, Oliveira-Neto MP, Felinto de Brito ME, Falqueto A, et al. Genetic polymorphism and molecular epidemiology of Leishmania (Viannia) braziliensisfrom different hosts and geographic areas in Brazil. J. Clin. Microbiol. 2003; 41 (7): 3126-3132. [ Links ]
2. García A, Kindt A, Quispe-Tintaya KW, Bermudez H, Llanos A, Arevalo J, et al. American tegumentary leishmaniasis: antigen-gene polymorphism, taxonomy and clinical pleomorphism. Infect Genet Evol 2005; 5:109-16. [ Links ]
3. Belli A, Rodríguez B, Aviles H, Harris E. Simplified polymerase chain reaction detection of new world Leishmania in clinical specimens of cutaneous Leishmaniasis. Am J. Trop. Med. Hyg. 1998; 58(1):102-9. [ Links ]
4. Grimaldi G, Tesh R. Leishmaniases of the new world: Current concepts and implications for future research. Clin. Microbiol. Rev. 1993; 6(3):230-50. [ Links ]
5. Brenière SF, Telleria J, Bosseno MF, Buitrago R, Bastrenta B, Cuny G, et al. Polymerase chain reaction-based identification of new world Leishmaniaspecies complexes by specific kDNA probes. Acta Trop 1999; 73(3):283-93. [ Links ]
6. Harris E, Kropp G, Belli A, Rodríguez B, Agabian N. Single-step multiplex PCR assay for characterization of new world Leishmania complexes. J Clin Microbiol 1998; 36(7):1989-95. [ Links ]
7. Oddone R. Epidemiologia de la Leishmaniosis Tegumentaria en Paraguay. Servicio Nacional de Erradicación de Enfermedades Vectoriales (SENEPA- MSP y BS) Boletín informativo semanal N° 11. Asunción; 2010. [ Links ]
8. Servicio Nacional de Erradicación de Enfermedades Vectoriales. Distribución de casos humanos de L. Visceral en Paraguay. Año 2009. (SENEPA- MSP y BS) Boletín informativo semanal N° 7. Asunción; 2010. [ Links ]
9. Servicio Nacional de Erradicación de Enfermedades Vectoriales. Leishmaniosis Visceral humana y canina. (SENEPA- MSP y BS) Boletín informativo semanal N° 18. Asunción; 2010. [ Links ]
10. Organización Mundial de la Salud. Leishmaniasis Visceral en las Américas. Informe final de expertos de OPS/OMS. Sao Paulo: OPS/OMS; 2005. [ Links ]
11. Marfurt J, Niederwieser I, Makia ND, Beck H, Felger I. Diagnostic genotyping of Old and new world Leishmania species by PCR-RFLP. Diagn Microbiol Infect Dis 2003; 46(2):115-24. [ Links ]
12. Schallig H, Oskam L. Molecular biological applications in the diagnosis and control of leishmaniasis and parasite identification. Trop Med Int Health 2002; 7(8):641-51. [ Links ]
13. Rodgers M, Popper S, Wirth D. Amplification of Kinetoplast DNA as a tool in the detection and diagnosis of Leishmania. Experim. Parasitol. 1990; 71:267-75. [ Links ]
14. Aviles H, Belli A, Armijos R, Monroy FP, Harris E. PCR detection and identification of Leishmania parasites in clinical specimens in Ecuador: a comparison with classical diagnostic methods. J Parasitol 1999; 85(2):181-7. [ Links ]
15. Piarroux R, Gambarelli F, Dumon H, Fontes M, Dunan S, Mary Ch, et al. Comparison of PCR with direct examination of Bone Marrow aspiration, Myeloculture, and serology for diagnosis of visceral Leishmaniasis in immunocompromised patients. J. Clin. Microbiol. 1994; 32(3):746-9. [ Links ]
16. Sambrook J, Fritsch E, Maniatis T. Molecular cloning. a laboratory manual. New York: Cold Spring Harbor Laboratory Press; 1989 [ Links ]
17. López M, Inga R, Cangalaya M, Echavarría J, Llanos-Cuentas A, Orrego C, et al. Diagnosis of Leishmania using the polymerase chain reaction: a simplified procedure for field work. Am J Trop Med Hyg. 1993; 49(3):348-56. [ Links ]
18. Delgadillo V, Macchi M, Rodríguez M, Rolón R, Casartelli M, Morel Z, et al. Cinco casos de Leishmaniasis Visceral detectados en la Cátedra de Pediatría del Hospital de Clínicas. En: Sociedad Paraguaya de Infectología 2003: IV Congreso Paraguayo de Infectología: Temas libres; 2003; Asunción: Sociedad Paraguaya de Infectología; 2003. p.4. [ Links ]
19. Oddone R, Arbo C, Nara E, Velázquez G, Acosta M, Poletti D, et al. Utilidad diagnóstica de los métodos laboratoriales en leishmaniasis mucosa, incluyendo la PCR. Noticias Técnicas del Laboratorio. 2004; 12(4): 7-9. [ Links ]
*Autor Correspondiente: Dra. Lilian Chena. Dpto. de Biología Molecular y Genética. Instituto de Investigaciones en Ciencias de la Salud. UNA.
Email:lilian_chena@yahoo.com
Fecha de recepción: julio de 2012; Fecha de aceptación: noviembre de 2012