Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO
Related links
-
 Similars in
SciELO
Similars in
SciELO
Share
Memorias del Instituto de Investigaciones en Ciencias de la Salud
On-line version ISSN 1812-9528
Mem. Inst. Investig. Cienc. Salud vol.10 no.2 Asunción Dec. 2012
ARTICULO ORIGINAL
Contaminación microbiana de colirios utilizados por pacientes en la consulta externa de oftalmología
Microbial contamination of eye drops used by patients in an outpatient clinic of ophthalmology
Ginés JCI, *Samudio MII, Fariña NII, Sanabria RII, Laspina FII, Peña FI, Bedoya PI, Duerksen RI, Miño de Kaspar HIII
IFundación Visión
IIInstituto de Investigaciones en Ciencias de la Salud. Universidad Nacional de Asunción.
IIIAugenklinik der Ludwig Maximilian Univeristät München
RESUMEN
Los colirios contaminados representan una causa potencial de infección ocular prevenible. Como toda medicación terapéutica tópica, los colirios deben estar libres de agentes contaminantes. La frecuencia de contaminación varía entre 0,07% y 35,6% en los estudios publicados; no existiendo estudios publicados sobre este tema en nuestro país. Este estudio tiene como objetivo determinar la frecuencia de contaminación de las gotas oftálmicas utilizadas por pacientes que consultan en la Fundación Visión en Asunción, Paraguay. A todos los pacientes que acudieron a la consulta externa en el Servicio de Oftalmología de la Fundación Visión, de agosto de 2007 a julio de 2008 se les solicitó que entregaran sus envases de gotas oftálmicas que estuvieron utilizando por dos o más semanas, además se registraron sus datos demográficos y relacionados al uso del colirio. Los envases fueron enviados al Instituto de Investigaciones en Ciencias de la Salud (IICS), de manera que la medicación restante en el interior de los mismos fuera cultivada en los medios microbiológicos convencionales. De los 73 envases recolectados, 8 (11%) presentaron cultivos positivos, siendo los gérmenes aisladosEstafilococo coagulasa negativo, Propionibacterium acnes, Serratia marcescens, Corynebacterium sp y Alcaligenes faecalis, además del hongo oportunista Aspergillus fumigatus. La contaminación de los colirios utilizados por estos pacientes es relevante. Estos resultados coinciden con reportes de otros países y señala la importancia de dar orientaciones a los pacientes en cuanto al modo de utilización, almacenamiento y tiempo de recambio de los colirios por parte de los oftalmólogos.
Palabras clave: contaminación, colirios, microorganismos.
ABSTRACT
Contaminated eye drops are a potential cause of preventable eye infection. As any topical therapeutic medication, eye drops must be free of contaminants. The frequency of contamination varies across published studies between 0.07% and 35.6%. In our country, there are no published data on the frequency of microbial contamination of eye drops. The objective of this study was to determine the frequency of contamination of eye drops used by the patients than consult in the Visión Foundation in Asuncion, Paraguay. All patients attending the outpatient clinic at the Department of Ophthalmology of the Vision Foundation from August 2007 to July 2008 were asked to turn in their eye drops containers they were using for 2 or more weeks, and their demographic data and data related to the use of eye drops were registered. The containers were sent to the microbiology laboratory of the Health Sciences Research Institute (IICS in Spanish) so that the remaining medication was cultured in conventional microbiological media. Of the 73 containers collected, 8(11%) had positive cultures and the most frequent microorganisms identified were coagulase negativeStaphylococcus,Propionibacterium acnes,Serratia marcescens,Corynebacterium sp, Alcaligenes faecalis and the opportunist fungus Aspergillus fumigatus. The contamination of the eye drops used by these patients is relevant. These results are consistent with reports from other countries and points out the importance of ophthalmologists providing guidance to patients regarding the mode of use, storage and turnover time of eye drops.
Keywords: contamination, eye drops, microorganisms.
INTRODUCCIÓN
Los colirios como cualquier medicación terapéutica, deben ser administrados utilizando técnicas de asepsia y de almacenamiento con el fin de prevenir la contaminación bacteriana. Para prevenir la contaminación secundaria de las gotas oftálmicas se agregan agentes antisépticos a la medicación lo que permite su uso durante un mes luego de abiertas (1,2). En la mayoría de los colirios, se condiciona su caducidad a un mes, una vez abierto el envase.
La presencia de aditivos, no garantiza el estado de esterilidad de las soluciones oftálmicas una vez abierto el envase. El riesgo de contaminación se ha estimado entre el 2% y 10%, pudiendo originarse previamente en la preparación de las soluciones, elaboración de los recipientes, sea por la presencia de ciertos microorganismos resistentes a los propios conservantes, o la inadecuada manipulación o la deficiente técnica de aplicación de las gotas (roce del extremo del tapón con el borde palpebral), así como el almacenamiento y transporte de los mismos (1,2).
La frecuencia de contaminación de los colirios varía entre los diferentes estudios y los microorganismos aislados corresponden frecuentemente a la flora de la conjuntiva o alrededores. En Israel, Porges y col (3) encontraron un 12,9% de contaminación en muestras tomadas del interior y de la tapa de las medicaciones tópicas de pacientes diagnosticados de glaucoma y los gérmenes aislados fueronPseudomonas aeruginosa,Staphylococcus epidermidis,Streptococcus viridans y Klebsiella sp. Clark y col (4) encontraron 11,7% de contaminación en muestras de medicaciones tópicas oftálmicas utilizadas en una clínica de atención ocular, aislándose más frecuentemente microorganismos comoBurkholderia cepacia, Staphylococcus epidermidis, Pseudomonas putida y varias especies de Estreptococos. Raynaud y col (5) encontraron un 16,3% de contaminación en las puntas de envases y la medicación restante en su interior de envases de medicaciones oftálmicas con una semana de uso.
En el trabajo de Geyer y col (6), la frecuencia de contaminación fue alta, alrededor del 28% en envases de medicación tópica oftálmica antiglaucomatosa en pacientes asintomáticos y la conjuntiva de pacientes tratados de glaucoma, la contaminación fue mayor en las puntas de las botellas que las gotas. El aumento en la frecuencia de la contaminación de las gotas fue proporcional al tiempo de uso de las mismas, así las gotas utilizadas por menos de 8 semanas la contaminación bacteriana ocurría en el 19% de los casos; en contraste a las medicaciones tópicas utilizadas por más de 8 semanas en las cuales el 40% de los frascos estaban contaminados. En el 81% de las 55 medicaciones contaminadas se encontró microorganismos gram positivos y el 12% de los pacientes tenían el mismo microorganismo aislado tanto en los envases como en sus conjuntivas (12).
En Paraguay no existen reportes de la frecuencia de la contaminación de gotas oftálmicas motivo por el cual se llevó a cabo este estudio en pacientes que concurrieron a la Fundación Visión por diferentes motivos. Es sabido los efectos adversos que presentan el uso continuado de los colirios en ciertas patologías oculares como glaucoma, úlceras de córnea y otras. Este estudio servirá para conocer la situación y en base a los resultados hacer recomendaciones si fuere necesario.
MATERIALES Y MÉTODOS
Fueron invitados a participar del estudio pacientes que concurrieron al consultorio externo de la Fundación Visión en el período comprendido entre agosto de 2007 a julio de 2008 y que hayan estado usando colirios por 2 o más semanas por diferentes motivos. A cada paciente se le explicó claramente los objetivos del estudio y se les solicitó que entreguen el envase que estaban utilizando hasta esa fecha a cambio de uno nuevo. A cada paciente que aceptó participar del estudio de le aplicó una encuesta que incluía además de los datos demográficos, el tipo de colirio, tiempo de uso, lugar de almacenamiento, número de aplicaciones por día, si fue compartido con otra persona, entre otros. Se recolectó un envase de colirio por paciente.
Los envases fueron enviados al laboratorio de Microbiología del Instituto de Investigaciones en Ciencias de la Salud (IICS) para su procesamiento. Se realizaron cultivos por los métodos microbiológicos convencionales para la búsqueda e identificación de gérmenes aerobios, anaerobios y hongos. Para el cultivo bacteriano en aerobiosis se inocularon 2 gotas del colirio en la superficie de agar sangre de carnero al 5% y agar chocolate a los 7%, incubadas en CO2 a 35ºC durante 72 hs; y 10 gotas del colirio en caldo tioglicolato incubándose a 35ºC durante 7 días. Para el cultivo en anaerobiosis, se utilizó agar sangre de carnero al 5% e incubada en bolsa con generador de anaerobiosis, a 35ºC, durante 7 días. Para el cultivo de hongos se utilizaron 2 placas de agar Sabouraud, incubadas a 25ºC y 35ºC, respectivamente durante 15 días (7).
RESULTADOS
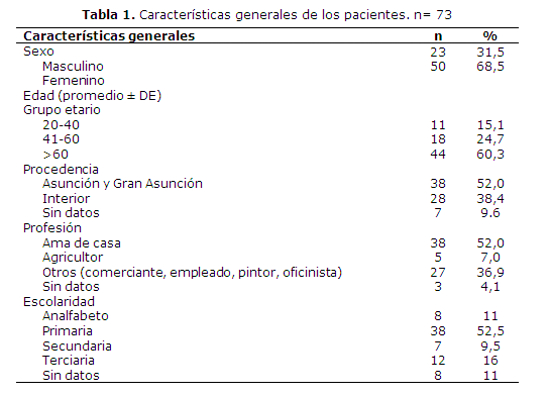
En el estudio se incluyeron envases de colirios correspondientes a 73 pacientes con edades entre 23 y 91 años, la edad promedio fue de 61 ± 16 años, la mayoría era del sexo femenino (68,5%) y amas de casa (52%). Más de la mitad eran procedentes de Asunción o Gran Asunción (52%) con un nivel educativo primario en un 52,5% (tabla 1).
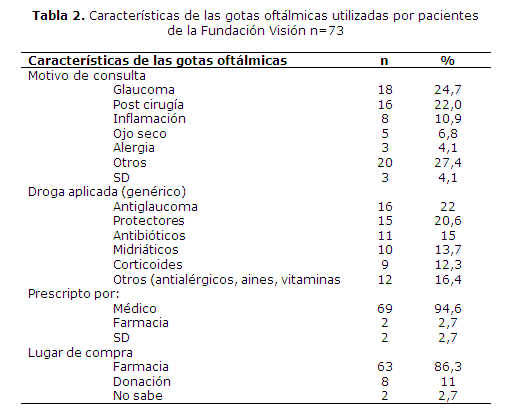
El motivo de consulta más frecuente de los pacientes fue por glaucoma (24,7%), seguido de control pos cirugía (22%), en consecuencia la droga aplicada más frecuente fue la antiglaucomatosa, seguido de protectores de la superficie ocular (20,6%). En su mayoría la gota estudiada fue prescrita por un médico oftalmólogo (94,6%), siendo la farmacia el lugar de compra más frecuente (86,3%) (tabla 2).
La mayoría de las gotas tenía un tiempo de uso de hasta 4 semanas (53,4%), el lugar de almacenamiento más frecuente fue la mesita de luz (57,5%), el tiempo hasta la fecha de expiración fue entre 2 a 12 meses en el 37% y entre 13 a 24 meses en el 41,1%. Casi el 90% los pacientes se aplica entre una a tres veces por día. El tiempo más frecuente de adquirido el producto fue 4 o menos semanas (53,4%). El 63% de los pacientes refirió conocer su enfermedad, en un 13% el uso del frasco de colirio es compartido con otras personas y en el 50% de ellos es aplicada por el mismo paciente (tabla 3).
Se aislaron 9 microorganismos, de los cuales 2 (22,2%) correspondieron a Estafilococo coagulasa negativa, 2 (22,2%)Propionibacterium acnes, 2 (22,2%)Serratia marcescens, 1 (11,1%)Corynebacterium sp y 1 (11,1%) fueAlcaligenes faecalis y 1 (11,1%) hongo, Aspergillus fumigatus. En una muestra, se aislaron dos microorganismos, Estafilococo coagulasa negativo yAspergillus fumigatus (tabla 4).
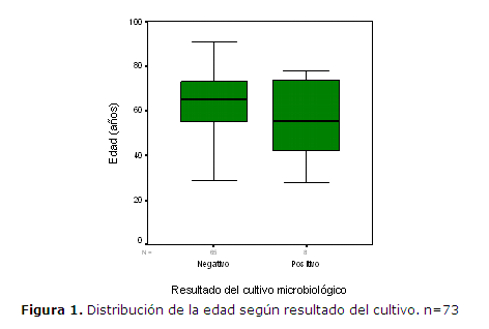
En el figura 1 se muestra la distribución de la edad de acuerdo al resultado del cultivo. La mediana de la edad fue menor en el grupo de cultivo positivo, pero la diferencia no llegó a ser significativa.
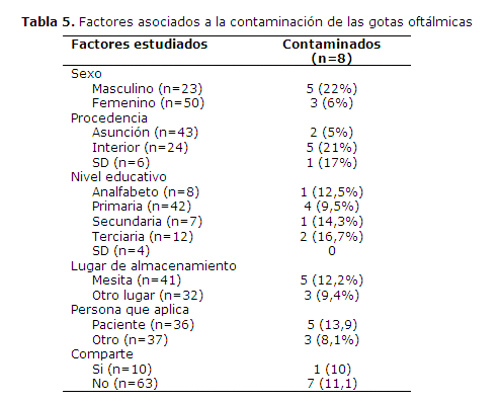
No se encontró ningún factor que se relacione significativamente con la contaminación de la gota oftálmica. La media del tiempo de uso fue similar en ambos grupos, 12 días en los frascos contaminados en comparación a 12,5 días en los no contaminados. Se observó que la frecuencia de contaminación fue mayor en los usuarios varones, pero la diferencia no fue significativa (tabla 5).
DISCUSIÓN
En nuestro estudio, la frecuencia de contaminación de las gotas oftálmicas fue de 11%. La frecuencia de contaminación en otros estudios varía considerablemente, desde 0.07%(8) realizado en 1485 envases abiertos de 18 consultorios oftalmológicos en California, EEUU hasta 35.8%(9) en pacientes hospitalizados en un hospital escuela en Francia.
A pesar de que en nuestro estudio no se realizaron cultivos de los bordes ni de las tapas de los frascos, tampoco se tomaron muestras de colirios cerrados y sellados, algunos estudios han reportado contaminación de ellos. Así, Clark y col (4) encontraron que el 76,5% de las muestras de los residuos de partículas secas alrededor de la punta de los envases utilizadas en una clínica de atención ocular estaba contaminado y en comparación al 11,7% del contenido de 60 muestras de medicaciones tópicas oftálmicas. Por su lado Geyer y col (6) encontraron un 28% de contaminación de la punta y gotas contenidas en 194 envases de medicación tópica oftálmica antiglaucomatosa en pacientes asintomáticos y de la conjuntiva de 109 pacientes tratados de glaucoma. La punta de la botella estaba más frecuentemente contaminada que las gotas (p=0.008). Raynaud y col (5) encontraron un 16,3% de cultivo positivo de las puntas de envases y la medicación restante en su interior de 406 envases de medicaciones oftálmicas con una semana de uso. Rahman y col obtuvieron crecimiento bacteriano en un 8,4% del contenido de 95 frascos de medicación tópica oftálmica. Betbeze y col (10), concluyen que existe un bajo nivel de contaminación bacteriana dentro de 1 o 2 semanas de haber sido abiertos, cultivando el contenido de los envases de medicación tópica oftálmica, el interior de la tapa y la punta de la tapa en aerobiosis.
El aumento en la frecuencia de la contaminación de las gotas en el estudio de Raynaud y col (5) fue proporcional al tiempo de uso de las mismas. En las gotas utilizadas por menos de 8 semanas la contaminación bacteriana ocurría en el 19% de los casos; en contraste a las medicaciones tópicas utilizadas por más de 8 semanas en las cuales el 40% de los frascos estaban contaminados. En contraposición a otros estudios; en este trabajo, la mayoría de los envases contaminados tuvo un tiempo de uso menor a un mes (54,2%), lo contrario a resultados de otros estudios en los cuales se concluye que a mayor tiempo de uso del envase, mayor será su riesgo de contaminación. No encontramos asociación entre el tiempo de uso y la contaminación.
Algunos estudios han mostrado que el problema de contaminación ya se inicia durante el procesamiento de las gotas oftálmicas, así Taayli y col (11) examinando el contenido de 92 botellas de medicación tópica ocular, de las cuales 43 botellas abiertas en uso y 49 cerradas y selladas encontraron una contaminación del 10% en las botellas cerradas y del 34,8% en las botellas abiertas. La elevada contaminación en las botellas cerradas indicaría un mal procesamiento en la etapa de esterilización o conservación de las medicaciones, siendo también muy elevada en las abiertas.
Los microorganismos aislados corresponden frecuentemente a la microbiota de la conjuntiva y alrededores. A pesar de que el trabajo de Rahman et al (12) mostró una muy baja proporción de microorganismos de la flora normal. En nuestro estudio los microorganismos aislados se encuentran dentro del espectro descripto en estudios anteriores. Las bacterias más frecuentemente aisladas de la conjuntiva normal son Estafilococo coagulasa negativo, Corynebacterium spp, Propionibacterium acnes y Staphylococcus aureus.
Los gérmenes aislados por Israel, Porges y col (3) fueronPseudomonas aeruginosa,Staphylococcus epidermidis,Streptococcus viridans yKlebsiella sp. Según el estudio de Clark y col(4) los microorganismos más frecuentemente aislados fueronBurkholderia cepacia, Staphylococcus epidermidis, Pseudomonas putida y varias especies de Estreptococos y en las muestras de los residuos de partículas secas alrededor de la punta de los envases estaba contaminado con mayor frecuencia conStaphylococcus spp yMicrococcus spp. Según Raynaud y col(5), los gérmenes comensales fueron los hallazgos más frecuentes, además de organismos gram negativos. Rahman y col (5) identificaron 7 tipos de microorganismos comoStaphylococcus aureus,Staphylococcus coagulasa negativo,Bacillus spp,Serattia spp,Klebsiella oxytoca,Enterobacter cloacae, y Estreptococo alfa hemolítico.
En nuestro estudio, a pesar de que se observó que la frecuencia de contaminación fue mayor en los usuarios varones, la diferencia no fue significativa. La mediana de edad de los usuarios que tuvieron colirios contaminados fue menor que los que no tuvieron, probablemente estos recibieron ayuda en la aplicación de la gota, pero no pudimos demostrar asociación entre contaminación y quien aplicaba la gota.
Algunos puntos sobre los cuales habría que intervenir con explicaciones claras por parte del oftalmólogo son el hecho de compartir las gotas oftálmicas, encontramos un porcentaje no despreciable (13,7%) que utiliza la gota oftálmica con otros miembros de la familia. La práctica de automedicación es un hecho frecuente en nuestro país, no solo para los colirios oftálmicos aparentemente inofensivo, sino también para otras medicaciones.
Es importante que los pacientes entiendan que la manipulación de los colirios debe ser cuidadosa, que es necesario lavarse las manos antes de aplicarlos, no sólo para no contaminar el líquido, sino para no contaminar el ojo, que debe sujetarse con los dedos para la aplicación, que siempre se debe guardar el envase de un colirio bien cerrado, en un sitio fresco, seco y oscuro, hasta la siguiente aplicación y no fuera de la heladera a temperatura ambiente o en el bolso o en el auto como se encontró en este estudio. No deben compartirse los colirios con otros pacientes. Estos medicamentos son de uso personal. Luego de cuatro semanas de abierto un colirio, debe desecharse. En caso de que el tratamiento finalice antes, debe desecharse al finalizar el mismo. La razón es que luego de abierto el medicamento, deja de ser estéril. Un aspecto positivo en este grupo de pacientes fue que ninguna de las gotas estaba expirada.
En conclusión podemos decir que la frecuencia de contaminación es alta, pero está dentro del promedio al comparar con otros reportes. Estos resultados sugieren que es la mala manipulación del colirio, el mecanismo más importante para su contaminación, de ahí la importancia de orientar a los pacientes sobre el uso y manipulación de los mismos.
Agradecimiento. Este trabajo de investigación recibió apoyo económico de la Fundación Hannelore-Georg Zimmermann, Munich, Alemania.
REFERENCIAS BIBLIOGRAFICAS
1. Hogan M. The preparation and sterilization of ophthalmic solutions. Calif Med. 1949; 71(6): 414-6. [ Links ]
2. Belmonte Martínez J. Microcirugía ocular (Internet) Editorial: Monodosis 2002 Set. (Citado en Julio de 2012); (3). Disponible en: http://www.oftalmo.com/secoir/secoir2002/rev02-3/02c-01.htm. [ Links ]
3. Porges Y, Rothkoff L, Glick J, Cohen S. Sterility of glaucoma medications among chronic users in the community. J Ocul Pharmacol Ther. 2004; 20(2):123-8. [ Links ]
4. Clark PJ, Ong B, Stanley CB. Contamination of diagnostic ophthalmic solutions in primary eye care settings. Mil Med. 1997; 162(7):501-6. [ Links ]
5. Raynaud C, Laveran H, Rigal D, Bonicel P. Bacterial contamination of eyedrops in clinical use. J Fr Ophthalmol. 1997; 20(1):17-24. [ Links ]
6. Geyer O, Bottone EJ, Podos SM, Schumer RA, Asbell PA. Microbial contamination of medications used to treat glaucoma. Br J Ophthalmol. 1995; 79(4):376-9. [ Links ]
7. Koneman E, Allen S, Janda W, Schreckenberger P, Winn(h) W. Diagnóstico microbiológico: Texto y atlas color. 5º Ed. Buenos Aires: Médica Panamericana; 1999. [ Links ]
8. Wessels IF, Bekendam P, Calvin WS, Zimmerman GJ. Open drops in ophthalmology offices: expiration and contamination. Ophthalmic Surg Lasers 1999;30:540-6. [ Links ]
9. Brudieu E, Duc DL, Masella JJ, Croize J, Valence B, Meylan I, et al. Bacterial contamination of multi-dose ocular solutions. A prospective study at the Grenoble Teaching Hospital. Pathol Biol (Paris) 1999;47:1065-70. [ Links ]
10. Betbeze CM, Stiles K, Krohne SG. Assesment of bacterial contamination of three multidose ophthalmic solutions. Vet Ophthalmol. 2007; 10(2):81-3. [ Links ]
11. Taayli H, Coayar G. Microbial contamination of eye drops. Cent Eur J Public Health. 2001; 9(3):162-4. [ Links ]
12. Rahman MQ, Tejwani D, Wilson JA, Butcher I, Ramaesh K. Microbial contamination of preservative free eye drops in multiple application containers. Br J Ophthalmol 2006;90:139-41. [ Links ]
*Autor Correspondiente:Dra. Margarita Samudio. Instituto de Investigaciones en Ciencias de la Salud. Universidad Nacional de Asunción.
Río de la Plata y Lagerenza
Email: margarita.samudio@gmail.com
Fecha de recepción: Setiembre de 2012; Fecha de aceptación: Noviembre de 2012