Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO
Related links
-
 Similars in
SciELO
Similars in
SciELO
Share
Memorias del Instituto de Investigaciones en Ciencias de la Salud
On-line version ISSN 1812-9528
Mem. Inst. Investig. Cienc. Salud vol.10 no.1 Asunción June 2012
ARTICULO ORIGINAL
Comparación de dos cepas de Leishmania en el ELISA para el diagnóstico de leishmaniosis visceral canina
Comparison of two Leishmania strains in an ELISA for the diagnosis of canine visceral leishmaniasi
*Aria L, Acosta ME, Rojas A, Guillén I, Meza T, Pedrozo MG
Departamento de Producción-Bioquímica. Instituto de Investigaciones en Ciencias de la Salud. Universidad Nacional de Asunción. Paraguay
RESUMEN
La leishmaniosis visceral es una enfermedad causada por protozoos del género Leishmania, afecta fundamentalmente al hombre y a los caninos, englobando un amplio espectro de procesos patológicos que parten desde cuadros cutáneos autocurables a viscerales con desenlace fatal. La leishmaniosis se conoce en Paraguay desde los años 1913; y se observa un aumento de los casos en paralelo al proceso de deforestación y expansión agrícola. La infección en los caninos es causada por parásitos del género Leishmania complejo L. donovani, especies L. infantum en el viejo mundo y L. chagasi en el nuevo mundo. Entre las técnicas de diagnóstico serológico se destacan la aglutinación directa (DAT), la inmunofluorescencia indirecta (IFI), el ELISA, la inmunocromatografía y el inmunoblotting. La sensibilidad y especificidad de cada una de ellas dependen en gran medida del antígeno utilizado. Sin embargo, pocos análisis comparativos se han hecho con tests que utilizan diferentes antígenos para identificar el mejor antígeno. El trabajo realizado fue un estudio analítico que tuvo como objetivo comparar a las dos cepas de leishmania: L. chagasi y L. donovani utilizadas en el ELISA indirecto para el diagnóstico serológico de leishmaniosis visceral canina que se realiza en el IICS. Del total de muestras analizadas, 173/185 (94%) resultaron concordantes. Utilizando la prueba de ELISA con antígeno L. chagasi como referencia, el antígeno de L. donovani dio una positividad y negatividad del 92% y 100% respectivamente. Se obtuvo una excelente concordancia (Kappa 0.82) y una fuerte asociación de 125.29 (p< 1x10-7) por chi2. Estos resultados sugieren que el antígeno L. donovani podría ser utilizado en el ELISA indirecto para la detección de anticuerpos anti-leishmania en caninos.
Palabras Claves: leishmaniosis, L. chagasi, L. donovani, ELISA, concordancia, diagnóstico.
ABSTRACT
Visceral leishmaniosis is a disease caused by protozoa of the genus Leishmania. It mainly affects humans and canines, encompassing a wide spectrum of pathological processes from self-healing cutaneous cases to visceral cases with fatal outcome. Leishmaniosis is known in Paraguay since 1913, and there is an increase of cases in parallel to the process of deforestation and agricultural expansion. The infection in dogs is caused by parasites of the genus Leishmania: L. donovani complex, L. infantum species in the Old World and L. chagasi in the New World. Among serological diagnostic techniques, there are direct agglutination (DAT), indirect immunofluorescence (IIF), ELISA, immunochromatography and immunoblotting. The sensitivity and specificity of each test depend largely on the antigen used. However, few comparative analyses have been made in tests using different antigens to identify the best antigen. This work was an analytical study aimed to compare two strains of Leishmania: L. chagasi and L. donovani used in the indirect ELISA for the serological diagnosis of canine visceral leishmaniosis performed in the IICS. Of the samples tested, 173/185 (94%) were concordant. Using the ELISA with L. chagasi antigen as reference, the antigen of L. donovani gave a positivity and negativity of 92% and 100% respectively. An excellent agreement (Kappa 0.82) and a strong association of 125.29 (p < 1x10-7) by chi2 were obtained. These results suggest that the antigen of L. donovani could be used in the indirect ELISA for the detection of anti-leishmania antibodies in dogs.
Keywords: leishmaniosis, L. chagasi, L. donovani, ELISA, agreement, diagnosis.
INTRODUCCION
La leishmaniosis visceral (LV) es una enfermedad zoonótica causada por un protozoo de la familia Trypanosomatidae. Es transmitida por la picadura de vectores flebotomíneos del género Lutzomyia sp. (1-2). Es causada en el Viejo Mundo (Asia, África) por la L. donovani, en la cuenca del Mediterráneo y otras regiones del mundo por L. infantum y en el Nuevo Mundo por L. chagasi (3).
La leishmaniosis se caracteriza por presentar un amplio espectro de manifestaciones clínicas que abarcan desde heridas cutáneas autocurables hasta compromiso visceral grave dependiendo de la especie de leishmania y de la respuesta inmune del hospedador (4-5).
Los cánidos (Canis familiaris) son los principales reservorios domésticos de la LV y son considerados responsables de la presentación endémica/epidémica natural de la enfermedad, sugiriéndose que el hombre sería una fuente de infección secundaria para los vectores y la transmisión dependería básicamente de la presencia de caninos infectados (6).
Un estudio de dos focos de leishmaniosis visceral canina urbana en Lambaré y Villa Elisa, entre noviembre de 1997 y febrero de 1998, demostró una prevalencia del 28%, con esto se corrobora la presencia de focos de leishmaniosis visceral caninaen zonas urbanas de las ciudades que comprenden el "Gran Asunción"(7).
En los últimos años la frecuencia de la leishmaniosis visceral canina (LVC) a aumentado, reportándose en Paraguay que el 32.5 % de los perros es portador de la leishmania(8). Tradicionalmente los métodos de control de la leishmaniosis visceral zoonótica (LVZ) han incluido: el tratamiento de las personas afectadas, la disminución de la densidad del vector, la identificación y eliminación de caninos (Canis familiaris) infectados (1). La detección del foco de la LVC urbana constituye todo un desafío para evitar no solo la diseminación y el aumento de la incidencia de la enfermedad en la población canina, sino para evitar la posible aparición de los casos humanos (9).
Entre los métodos de diagnóstico existe una amplia gama entre las que se destacan la aglutinación directa (DAT), la inmunfluorescencia indirecta (IFI), el ELISA, el inmunoblotting, la inmunocromatografía (10). La sensibilidad y especificidad de cada una de ellas no dependen únicamente de las características inherentes de la propia técnica sino, en gran medida, del antígeno utilizado. Sin embargo, pocos análisis comparativos se han hecho con pruebas que utilizan diferentes preparados de antígenos para identificar el mejor antígeno (11).
En un trabajo realizado en el Brasil, comparando la sensibilidad y especificidad de antígenos crudos de L. chagasi, L. amazonensis y antígenos recombinantes rk39 y rk26 usando sueros y eluatos de sangre de perros, tuvo como resultado sensibilidades similares (97-100%). La especificidad fue mayor al 96% tanto para antígenos crudos como recombinantes (12).
En el Instituto de Investigaciones en Ciencias de la Salud (IICS) se estandarizó el método de ELISA para la leishmaniosis canina con el antígeno L. chagasi dando valores de sensibilidad y especificidad del 96% respectivamente (13). Dicho método se utiliza de rutina en el IICS para el diagnóstico serológico de LVC.
Se realizó este estudio analítico de corte transversal con el objeto de comparar dos cepas de Leishmania:L. chagasi y L. donovani cultivadas en el IICS, como antígenos en el ELISA indirecto, en caso de no poder contar con el antígeno de L. chagasi utilizado hasta el momento.
MATERIALES Y MÉTODOS
En este estudio analítico de pruebas diagnósticas para concordancia, de corte transversal se evaluaron 146 sueros positivos y 39 sueros negativos de perros para leishmaniosis visceral testados por el ELISA IICS sensibilizados con L. chagasi. Los sueros fueron previamente codificados y conservados a -20ºC en la seroteca del Departamento de Medicina Tropical -IICS.
La cepa utilizada fue la L. donovani MHOM/ET/1967/L82-LV9 cultivada en el Departamento de Medicina Tropical. Los promastigotes de leishmania se cultivaron en medio Schneider drosophila(S-9895Sigma-Aldrich)suplementado con 10% de suero fetal de bovino (F-4135 Sigma-Aldrich) e incubados a 25ºC (14).
El control utilizado consistió en un pool de sueros positivos y un pool de sueros negativos de perros, previamente testados por ELISA y confirmados por IFI e Inmunoblotting.
La prueba de ELISA utilizada fue desarrollada en el Departamento de Producción-Bioquímica por Kaspar y col(15), utilizando microplacassensibilizadas con antígeno L. donovani. Se consideraron como positivos los sueros con densidad óptica (DO) > 0.317.
Los resultados fueron registrados en una planilla electrónica (Microsoft Excel).
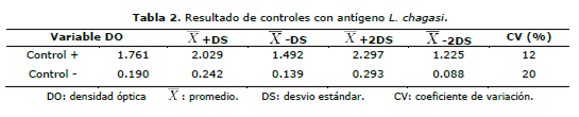
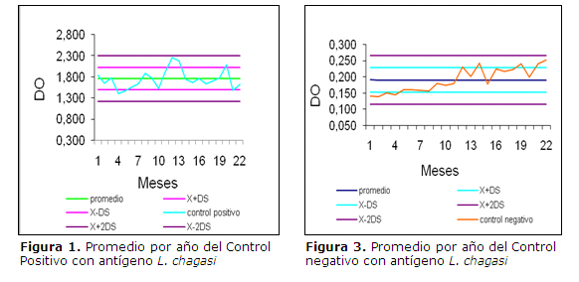
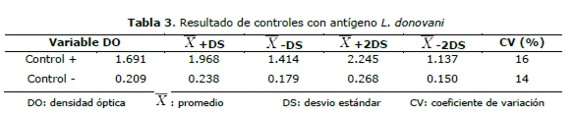
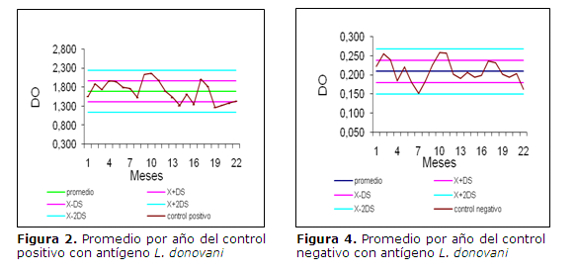
La asociación de las variables se evaluó por el estadígrafo chi2 e índice Kappa a un nivel de significancia p £0.05. Los valores de control positivo y negativo de los distintos ensayos se graficaron en cartas de control (Levey-Jennings) y se analizaron por las reglas de Shewart (16).
RESULTADOS
Del total de muestras analizadas, 173/185 (94%) tuvieron resultados concordantes y 12/185 (6%) discordantes usando el antígeno L. donovani. Utilizando la prueba de ELISA con antígeno L. chagasi como referencia dieron una positividad y negatividad del 92% y 100% respectivamente.
El índice Kappa obtenido fue 0.82, considerándose una excelente concordancia según la escala de Landis y Koch (17). Se obtuvo un chi2 corregido de 125.29 (p< 1x10-7) indicando una fuerte asociación entre los resultados con ambos antígenos.
Utilizando como antígeno L. chagasi los controles positivos dieron un promedio de 1,761 de DO, con un coeficiente de variación (CV) 12%, mientras que el promedio del DO en los controles negativos fue de 0,190 con un CV de 20%.(tabla 2 y figuras 1 y 3). En cuanto al antígeno L. donovani se obtuvo promedio de DO del control positivo fue de 1,691 y CV del 16%, mientras que el promedio del control negativo fue de 0,209 y un CV del 14% (tabla 3 y figuras 2 y 4).
DISCUSIÓN
En el presente estudio se ha demostrado que existe una excelente concordancia siendo esta estadísticamente significativa entre los antígenos L. chagasi y L. donovani, en la prueba de ELISA-IICS, indicada por el índice de kappa según la escala de Landis y Koch (17). En un trabajo realizado por Minaya y col. (18), el antígeno L. donovani evidenció una sensibilidad del 97% comparado con otros antígenos que dieron una sensibilidad promedio del 95,9%, esto coincide con un trabajo realizado en el Brasil, comparando la sensibilidad y especificidad de antígenos crudos de L. chagasi, L.amazonensis y antígenos recombinantes rk39 y rk26 usando sueros y eluatos de sangre de perros, dieron como resultado sensibilidades similares (97-100%). La especificidad fue mayor al 96% tanto para antígenos crudos como recombinantes (12). Dos institutos en el mundo ofrecen comercialmente antígenos para el test de aglutinación directa, uno en Bélgica y el otro en Holanda. Ambas pruebas comerciales están fabricadas con un antígeno preparado a partir de promastigotes de L. donovani MHOM/SD/68/1S. Éste ha sido evaluado en numerosas regiones endémicas de LV alrededor del mundo y ha presentado sensibilidad (96.5 a 100%) y especificidad variables en cada una de ellas(19).En un metanálisis realizado en el año 2006 para evaluar el desempeño del FD-DAT desde su introducción al diagnóstico de LV desde 1986 hasta 2004; se concluyó que a pesar de presentar en la mayoría de los casos sensibilidad mayor del 90% y especificidad comúnmente cercana al 100%, es necesaria la determinación de estos parámetros en las zonas endémicas en las que se inicia su empleo debido a la heterogenicidad de ambos valores con respecto a la localización geográfica de los estudios (20), en nuestro país se verificó una alta concordancia con L. chagasi como ya lo hemos dicho.
En cuanto a la evaluación de la precisión del ELISA con ambos antígenos se observó que los valores de DO de los sueros se encontraron dentro del rango aceptado de dos desviaciones estándar (2DS) con un intervalo de confianza del 95% criterio recomendado por elManual de la OIE (16).
En conclusión, estos resultados sugieren que el antígeno L. donovani podría ser utilizado en el ELISA indirecto para la detección de anticuerpos anti-leishmania en perros, de manera a reemplazar al de L. chagasi al no contarse con ella.
REFERENCIAS BIBLIOGRÁFICAS
1. Alves WA, Bevilacqua PD. Quality of diagnosis of canine visceral Leishmaniosis in epidemiological surveys: an epidemic in Belo Horizonte, Minas Gerais, Brazil, 1993–1997. Cad. Saude Pública 2004; 20(1):259–65. [ Links ]
2. Ferroglio, F, Centaro E, Mignone W, Trisciuoglio A. Evaluation o fan ELISA rapid device for the serological diagnosis of Leishmania infantum infection in dog as compared with immunofluorescence assay and Western blot. Veterinary Parasitology 2007; 144:162-6. [ Links ]
3. Fernández J, Charry T, Bello F, Escovar J, Lozano C, Ayala M, et al. Prevalencia de Leihsmaniosis Visceral Canina en Municipios de Huila – Colombia. Rev. Salud pública 2002; 4(3):278-85. [ Links ]
4. Padilla C, Montoya I. Caracterización e inmunoreactividad de la proteína acídica Ribosomal P2ß de L braziliensis. Rev Perú Med Exp Salud Pública 2003; 20(2):92-6. [ Links ]
5. González García A. Búsqueda de genes que codifican proteínas útiles para la inmunoprotección frente a las Leishmaniosis. (Tesis Doctoral). La Laguna: Servicio de Publicaciones, Universidad de La Laguna; 2004. [ Links ]
6. Silva ES, Gontijo MF, Pacheco RS, Fiuza VOP, Brazil RP. Visceral Leishmaniosis in the Metropolitan Region of Belo Horizonte, State of Minas Gerais, Brazil. Mem Inst Oswaldo Cruz 2001; 96(3):285-91. [ Links ]
7. Canese A, Garoso O, Ramírez J, Maidana N, Montini M, Santa Cruz R, et al. Focos de leishmaniosis visceral canina en las ciudades de Lambaré y Villa Elisa Paraguay. Rev Parag Microb 1999; 18(1): 18-24. [ Links ]
8. Miret J, Galeano E, Sosa L, Ocampos H, Martínez R, Ojeda J, et al. Leishmaniosis visceral canina en el Paraguay año 2012. Rev Par Epidemiol (próxima aparición). [ Links ]
9. Schinini A, Inchaustti A, Samudio M, Guillen I, Meza T, Rojas de Arias A. Características clínica y epidemiológica de la leishmaniosis visceral canina en Paraguay. En: Anual Reports 1998; Asunción: EDUNA-EFACIM; 2000. 13-20. [ Links ]
10. Iniesta González L. Diagnóstico de la leishmaniosis Críptica en el Perro. Expresión Isotópica e Idiotipica de los anticuerpos producidos en distintas fases de la infección. Tesis Doctoral. Universidad de Barcelona; 2007. [ Links ]
11. Abdmouleh Maalej I, Chenik M, Louzir H, Ben Salah A, Bahloul Ch, Amri F et al.Comparative Evaluation of Elisas based on ten recombinant or purified Leishmania antigens for the serodiagnosis of mediterranean visceral leishmaniosis. Am. J. Trop. Med. Hyg 2003; 68(3): 312-20. [ Links ]
12. Yoshie E, Genaro O, Fraça J, Da Costa R, Mayrink W, Barbosa A et al. Evaluation of enzyme-linked immunosorbent assay using crude Leishmania and recombinant antigens as a diagnostic marker for canine visceral leishmaniosis. Mem. Inst. Oswaldo Cruz 2005; 100(2):197-203. [ Links ]
13. Samudio M, Guillén Y, Schinini A, Inchausti A, Meza T, Velázquez GR, et al. Evaluación de una prueba de ELISA para el diagnóstico serológico de Leishmaniosis canina comparado con el inmunoblotting. En: III Congreso Paraguayo de Alergia e Inmunología. Asunción de 2002. Asunción, Paraguay: Soc. Pya de Alergia e Inmunología Clínica; 2002 65-7. [ Links ]
14. Orué A, De Abreu NY, Martínez C et al. Identificación de una secuencia de ADN genómico de Leishmania especifica del subgénero Leishmania. Rev. Soc. Ven. Microbiol. 2008; 28 (1):6-13. [ Links ]
15. Kaspar P, Velázquez G, Pozzoli L, Vera E, Guillen I, Meza T et al. Un nuevo Kit de ELISA para la detección de anticuerpos IgM anti Tripanosoma Cruzi. En: Enfermedad de Chagas en el Paraguay. Asunción: EFACIM-JICA. 1990; 15: p240-50. [ Links ]
16. World Organisation for Animal Health (OIE) (2004). Principios de validación para las pruebas de diagnóstico de enfermedades infecciosas. En:Manual de la OIE sobre animales terrestres. OIE, Paris: Francia; 2004. p. 27–8. [ Links ]
17. Ruiz A, Morillo L. Estudios de concordancia. In: Epidemiología Clínica. Investigación clínica aplicada. Bogotá: Médica Panamericana; 2004. p. 293-307. [ Links ]
18. Minaya G, Torres Y, Farfán M, Mendizabal L, Colchado M, Arroyo E. Evaluación de la Intradermoreacción con antígenos de leishmania (viannia) peruviana y leishmania (viannia) braziliensis en áreas endémicas de leishmaniosis en el Perú. Rev Med Exp 1999, 15 (1-2): 5-14. [ Links ]
19. Terán-Angel G, Schallig HD, Zerpa O, Rodríguez V, Ulrich M, Cabrera M. Evaluation of the direct agglutination test as an alternative method for the diagnosis of canine and human visceral Leishmaniosis in Venezuela. Biomedica 2007; 27: 447-53. [ Links ]
20. Chappuis F, Rijal S, Soto A, Menten J, Boelaert M. A meta-analysis of the diagnostic performance of the direct agglutination test and rK39 dipstick for visceral leishmaniosis. BMJ 2006. 333: 723. [ Links ]
*Autor Correspondiente: AI. Laura Aria Zaya, Dpto. de Producción. Instituto de Investigaciones en Ciencias de la Salud. UNA. Paraguay. Email: producción@iics.una.py.
Fecha de recepción: marzo de 2012,
Fecha de aceptación: mayo 2012.