Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO
Related links
-
 Similars in
SciELO
Similars in
SciELO
Share
Memorias del Instituto de Investigaciones en Ciencias de la Salud
On-line version ISSN 1812-9528
Mem. Inst. Investig. Cienc. Salud vol.10 no.1 Asunción June 2012
ARTICULO ORIGINAL
Detección por PCR múltiple de gérmenes atípicos en pacientes con neumonía adquirida de la comunidad que concurrieron al INERAM
Multiplex PCR for detection of atypical bacteria in community-acquired pneumonia patients attending INERAM Hospital
*Guillén RI, Franco RII, Franco LI, Moraga PII, Ojeda MII, Russomando GI
IInstituto de Investigaciones en Ciencias de la Salud (IICS), Asunción-Paraguay
IIInstituto de Enfermedades Respiratorias y de Ambiente (INERAM), Asunción-Paraguay
RESUMEN
La neumonía adquirida en la comunidad (NAC) es una causa relevante de morbilidad y mortalidad. Los métodos convencionales fracasan en la detección de Mycoplasma pneumoniae, Chlamydophila pneumoniae y Legionella pneumophila. Estas bacterias pueden generar procesos infecciosos crónicos y no responden a ciertos antibióticos empleados en el tratamiento empírico de la NAC. Nuestro objetivo fue detectar de forma simultánea, mediante métodos moleculares, M. pneumoniae, C. pneumoniae y L. pneumophila en muestras respiratorias de pacientes con NAC, y describir los gérmenes comunes aislados por métodos microbiológicos convencionales. Estudio observacional descriptivo de corte trasverso realizado en el año 2011, en el que se analizaron 60 muestras respiratorias provenientes de pacientes con NAC atendidos en el INERAM (Instituto de Enfermedades Respiratorias y del Ambiente). Para la PCR múltiple se emplearon primers específicos para genes de los tres microorganismos citados. El protocolo de estudio fue aprobado por los comités científico y ético del IICS y se mantuvieron en estricta confidencialidad los datos personales de los pacientes. La PCR múltiple permitió la amplificación de los genes específicos de estos microorganismos con límites de sensibilidad comprendidos entre 0,05 y 0,001 ng/µL de ADN. M. pneumoniae y C. pneumoniae estuvieron presentes respectivamente en el 18,3% y 1,7% del total de muestras analizadas. No se detectó la presencia de L. pneumophila. Los gérmenes comunes más frecuentemente aislados fueron estreptococos del grupo viridans y Candida spp.La técnica de PCR múltiple permitió detectar M. pneumoniae, C. pneumoniae y L. pneumophila, siendo el primero de los tres el más frecuentemente detectado en pacientes con NAC.
Palabras clave: NAC, M. pneumoniae, C. pneumoniae, L. pneumophila, PCR múltiple.
ABSTRACT
The community-acquired pneumonia (CAP) is a major cause of morbidity and mortality. Conventional methods fail detecting Mycoplasma pneumoniae, Chlamydophila pneumoniae and Legionella pneumophila. These bacteria can cause chronic infectious processes and do not respond to certain antibiotics used in the empirical treatment of CAP. Our objective was to detect M. pneumoniae, C. pneumoniae and L. pneumophila simultaneously using molecular methods in respiratory samples from CAP patients, and describe common germs isolated by conventional microbiological methods. This was a cross-sectional descriptive observational study carried out in 2011, which analyzed 60 respiratory samples from CAP patients treated at INERAM (National Institute of Respiratory and Environmental Diseases). For multiplex PCR, specific primers were used for the genes of the three mentioned microorganisms. The study protocol was approved by the scientific and ethical committees of the IICS and the personal data of the patients were strictly confidential. The multiplex PCR allowed the specific amplification of the genes of these microorganisms with sensitivity limits between 0.05 and 0.001 ng/µL of DNA. M. pneumoniae and C. pneumoniae were present in 18.3% and 1.7% respectively of all samples analyzed while L. pneumophila was not detected. The microorganisms most commonly isolated were streptococci from the viridans group and Candida spp. The multiplex PCR allowed the detection of M. pneumoniae, C. pneumoniae and L. pneumophila, being the first of the three the most frequently detected in CAP patients.
Keywords: CAP, M. pneumoniae, C. pneumoniae, L. pneumophila, multiplex PCR.
INTRODUCCIÓN
La neumonía aguda adquirida en la comunidad (NAC) es una entidad clínica muy frecuente, que conlleva una morbilidad y mortalidad importantes. Las características del síndrome de neumonía aguda adquirida en la comunidad han cambiado con el curso de los años, presentando una mayor diversidad de la población afectada, con aumento de la edad de los afectados y del número de pacientes con enfermedades de base (diabetes, EPOC, bronquiectasias) o inmunodepresión (infección por el VIH, trasplantados). En Paraguay las neumonías siguen constituyendo una causa importante de hospitalización. El informe de índices básicos de salud señala que las tasas de mortalidad por enfermedades del aparato respiratorio ascendió de 19,7 a 28,1 por 100.000 habitantes del año 2008 al 2009 (1-4).
El conocimiento de los patógenos causantes de NAC constituye la base para la selección del tratamiento antimicrobiano empírico, el cual tiene un impacto sustancial en el pronóstico del paciente. Diversos trabajos señalan como uno de los patógenos más frecuentes aislados en NAC al Streptococcus pnuemoniae, seguido de virus respiratorios como influenza, rinovirus, virus sincitial respiratorio y parainfluenza. En la última década se ha detectado un cambio en el espectro de los microorganismos potencialmente implicados debido mayoritariamente a los avances en las técnicas de diagnóstico. Aún así se debe tener presente que aproximadamente en el 40% de los pacientes con NAC, se desconoce el agente causal (5,6).
La neumonía causada por L. pneumophila, M. pneumoniae o C. pneumoniae, se incluye dentro de las denominadas neumonías por patógenos bacterianos atípicos. La relativa contribución de estos patógenos a la NAC varía dependiendo de la población estudiada así como de los métodos diagnósticos empleados, y su detección es problemática. La presentación clínica puede confundirse con la causada por otros agentes infecciosos y el cultivo, cuando es posible, es poco sensible o lento y requiere técnicas específicas. Por otra parte los estudios serológicos, en ocasiones, sólo permiten confirmar, pero no establecer el diagnóstico con la suficiente rapidez como para ser de utilidad en la práctica clínica. Lógicamente, esto ha llevado a la necesidad de establecer pautas terapéuticas empíricas que se utilizan de forma rutinaria ante la sospecha de infecciones causadas por estos microorganismos (7-9).
M. pneumoniae es un patógeno de comportamiento extra e intracelular implicado en infecciones del tracto respiratorio adquiridas en la comunidad tanto en niños como en adultos.M. pneumoniae es un agente etiológico importante de la NAC. Su incidencia (globalmente más del 20% de los pacientes con NAC y el segundo agente etiológico después de S. pneumoniae) presenta amplias variaciones según las áreas geográficas, los períodos en que se producen brotes epidémicos y las poblaciones que residen en instituciones cerradas (10). Este microorganismo es de crecimiento lento y difícil (7 a 35 días) que requiere el empleo de medios específicos para su cultivo, por lo que este método no es recomendable para el diagnóstico clínico debido a su baja sensibilidad (60%). Igualmente, el diagnóstico serológico es poco útil, ya que requiere la demostración de una seroconversión en el título de inmunoglobulinas G entre los sueros de las fases aguda y de convalecencia. Las pruebas rápidas para la detección antigénica directa del M. pneumoniae en las muestras respiratorias (inmunofluorescencia, ELISA de captura) muestran una sensibilidad baja y no son recomendables (11).
C. pneumoniae es un patógeno muy ubicuo, de modo que más del 50% de la población adulta presenta datos serológicos (IgG) de infección previa por esta bacteria. Causa bronquitis aguda, además de síntomas del tracto respiratorio superior, como faringitis, laringitis y sinusitis, incluso cuadros graves parecidos a la tos ferina. Otra implicación importante de C. pneumoniae se debe a su asociación con la exacerbación aguda en la bronquitis crónica, asma y EPOC (12). El diagnóstico microbiológico de la infección por C. pneumoniae no está exento de problemas y limitaciones, requiriendo técnicas específicas y personal adiestrado. El cultivo es una técnica diagnóstica muy insensible, debido al crecimiento difícil del patógeno. El aislamiento del microorganismo se realiza por cultivo de las muestras del tracto respiratorio en líneas celulares y posterior confirmación de su presencia en los cuerpos de inclusión mediante anticuerpos fluorescentes, o bien por la detección de las formas extracelulares en las muestras mediante tinción directa con antisueros específicos de género o especie. Como consecuencia de la escasa sensibilidad y complicación técnica del cultivo, las pruebas serológicas se han utilizado más ampliamente. Sin embargo el diagnóstico serológico presenta serias limitaciones, como son la alta prevalencia de anticuerpos frente a C. pneumoniae en la población general, las frecuentes infecciones crónicas y reinfecciones en el adulto, y los portadores asintomáticos. Todo ello hace extremadamente difícil diferenciar la infección aguda de la infección previa, la infección crónica de la colonización o la reactivación de una infección crónica (8).
Legionella pneumophila, es una bacteria de amplia distribución en la naturaleza, tiene su hábitat natural en las aguas ambientales, industriales y domésticas (grifos, duchas, acondicionadores de aire). La transmisión al hombre se produce por inhalación directa, aspiración o instilación en el tracto respiratorio de líquidos contaminados. La neumonía puede aparecer en casos esporádicos o en brotes epidémicos y su prevalencia varía mucho según las áreas geográficas (en general del 2%-10%). El diagnóstico microbiológico de certeza se basa en el cultivo de las secreciones y su aislamiento en el medio específico agar BCYE, considerado como el patrón de referencia. También, la detección del antígeno de Legionella en orina permite un diagnóstico rápido sensible y específico de la neumonía causada por L. pneumophila,aunque sólo del serogrupo 1(sensibilidad del 70-90% y especificidad mayor del 99%). En cuanto al estudio serológico, se considera diagnóstica la seroconversión (títulos de 1:128 o mayores) por inmunofluorescencia indirecta (13).
Ante el panorama presentado en el que el diagnóstico mediante técnicas clásicas de cultivo o serológicas es limitado, surgen nuevas herramientas de laboratorio, como son las técnicas de amplificación de ácidos nucleicos. Estas técnicas moleculares permiten la detección del agente causal de forma más rápida y sensible, sobre todo en el caso de los patógenos difíciles de cultivar. En la actualidad, los métodos moleculares ofrecen mayor sensibilidad que el cultivo. La aplicación de la PCR (dirigida frente a diversos genes como: 16S rRNA, OMP o la proteína 60-kDa rica en cisteína) directamente a partir de muestras biológicas como secreción faríngea, lavado broncoalveolar y esputo permite la detección de estos microorganismos en las muestras, mostrando las mejores perspectivas en sensibilidad para el diagnóstico microbiológico (14-16). La limitante de los métodos moleculares consiste en contar con muestras control apropiadas y en cantidad suficiente para el gran número de determinaciones necesarias en el caso de métodos de diagnóstico para patologías frecuentes.
En Paraguay no se cuenta con datos epidemiológicos que evidencien el rol que cumplen estos patógenos como agentes causales de enfermedades respiratorias, debido a que estos tres gérmenes no son detectados por métodos clásicos de cultivo llevados a cabo en laboratorios microbiológicos. El presente trabajo tiene como objetivos: diseñar y estandarizar una técnica molecular para la detección simultánea de ADN proveniente de estos microrganismos mediante la aplicación de un tipo de reacción en cadena de la polimerasa (PCR múltiple), en muestras biológicas de pacientes con NAC, así como describir los gérmenes comunes aislados en dichas muestras.
MATERIALES Y MÉTODOS
Diseño del estudio: este trabajo es descriptivo de corte transverso, con muestreo de casos consecutivos de muestras respiratorias provenientes de pacientes con diagnóstico de NAC que concurrieron al INERAM de julio a noviembre del 2011. Si bien el tamaño de la muestra determinado por métodos estadísticos fue de 292 muestras, en el presente trabajo se reportan los datos preliminares correspondientes a las primeras 60 muestras que cumplieron con los criterios de inclusión en el periodo de estudio de julio a noviembre del 2011, con la salvedad de que en la actualidad proseguimos la colecta de muestras hasta cumplir el criterio estadístico.
Métodos bacteriológicos: las muestras fueron sometidas a tinción de gram y Ziehl Nielsen. Los medios de cultivo convencionales empleados para el aislamiento de bacterias respiratorias comunes incluyeron agar sangre de carnero 5%, una placa de agar chocolate y una placa de agar MacConkey o agar EMB. Las condiciones de cultivo incluyeron incubaciones de las placas a 35-37ºC en 5% de CO2 durante 48 a 72 horas. A continuación se realizaron pruebas bioquímicas para la identificación de los gérmenes comunes presentes en las muestras, según protocolo de procedimiento del laboratorio de microbiología del INERAM.
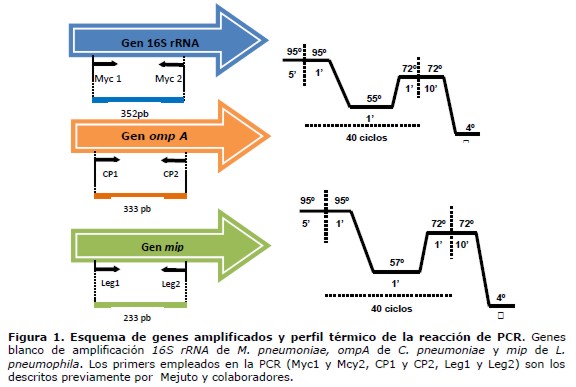
Métodos moleculares: las muestras respiratorias fueron remitidas al laboratorio de Biología Molecular en viales herméticos, estériles de tapa rosca, especialmente preparadas para el protocolo de estudio. El primer paso incluyó la inactivación por hervido durante 20 minutos. Posteriormente se sometió a las muestras viscosas como esputo y líquidos purulentos a tratamiento con N-Acetil Cisteína en medio alcalino, con agitación a temperatura ambiente durante 30 minutos. El ADN proveniente de las muestras fluidificadas se extrajo empleando un kit comercial (Wizard Genomics, Promega, Estados Unidos) siguiendo las recomendaciones del fabricante. El ADN obtenido fue cuantificado mediante la medición de la Absorbancia a 260 nm medida en el espectrofotómetro Biowave (WPA, Inglaterra). Las reacciones de PCR amplificaron regiones de los genes 16S rRNA de M. pneumoniae,ompA que codifica la proteína mayor de membrana de C. pneumoniae y mip, gen potenciador de infección de macrófagos de L. pneumophila, empleando primers específicos y condiciones de ciclado descritos por Mejuto y colaboradores (17) (figura 1). En todas las reacciones de amplificación se incluyeron controles negativos y positivos. Los controles positivos incluyeron soluciones de ADN de M. pneumoniae, C. pneumoniae y L. pneumophila. Las soluciones de ADN control de M. pneumoniae y C. pneumoniae fueron gentilmente cedidas por la Dra. María Angélica Martínez de la Facultad de Medicina de la Universidad de Chile y el Dr. Gerardo De Lucca del Instituto de Medicina Tropical de la Universidad de Nordeste, Resistencia, Argentina. En el caso de L. pneumophila la solución control se obtuvo mediante la extracción de ADN a partir de la cepa ATCC 33152 (Microgiologics, Estados Unidos). Las soluciones control se emplearon para estandarizar las reacciones de PCR de cada gen de forma individual. Se realizó la electroforesis en gel de agarosa al 2% y tinción de bromuro de etidio para visualizar los productos de PCR obtenidos. El tamaño de los productos de PCR se determinó mediante comparación de la migración relativa a un marcador de peso molecular de 100 pb (100 bp ready to use, Fermentas, Estados Unidos) y 50 pb (Bioline, Inglaterra). Los productos de PCR obtenidos fueron del tamaño esperado 352 pb para M. pneumoniae, 333 pb para C. pneumoniae y 233 pb para L. pneumophila.
Los productos obtenidos fueron empleados como inserto para el clonado en el vector pGEMT-Easy (Promega, Estados Unidos), siguiendo las recomendaciones del fabricante para la reacción de ligamiento. Se transformaron células competentes de Escherichia coli DH5α mediante el protocolo de choque térmico. Los transformantes fueron crecidos en medio LB con Ampicilina mg/mL. La extracción de los plásmidos recombinantes se realizó empleando un kit comercial Quiaprep Spin Miniprep (Quiagen,Alemania) y su tamaño fue evaluado en geles de agarosa del 0,8%, empleando como marcador de peso molecular fago λ digerido con BstEII. Los insertos de los plásmidos recombinantes fueron secuenciados en la Facultad de Farmacia de la Universidad de Sao Paulo, empleando ABI PRISM Big Dye Terminator Kit (Applied Biosystem, Estados Unidos) y el secuenciador automatizado ABI PRISM 310 Genetic Analyzer (Applied Biosystem, Estados Unidos).
Análisis estadístico: los datos se recogieron mediante un cuestionario pre codificado y se cargaron en una planilla electrónica de Microsoft Excel. Para el análisis estadístico se emplearon herramientas de estadística descriptiva del programa Epi Info (versión 3.5.1). Para las variables dicotómicas se calcularon las frecuencias absolutas y relativas; para las variables continuas se utilizaron promedios y desviación estándar.
Asuntos éticos: el protocolo de estudio fue aprobado por los comités científico y ético del IICS (UNA), así como por las autoridades del INERAM, (MSP y BS). Todos los pacientes participantes fueron beneficiados con análisis bacteriológicos y moleculares sin costo y recibieron sus resultados en sobre cerrado de forma individual. Estos resultados permitieron orientar las medidas terapéuticas específicas a ser tomadas para cada paciente. Los datos personales de los pacientes participantes se mantuvieron en estricta confidencialidad y fueron manejados bajo códigos de forma exclusiva por los investigadores principales de ambas instituciones.
RESULTADOS
En el periodo de julio a noviembre del 2011, fueron incluidas dentro del protocolo de estudio un total de 60 muestras respiratorias provenientes de pacientes con diagnóstico de neumonía adquirida de la comunidad. El 51,7% de los pacientes fue de sexo masculino (n=31) y el 48,3% del sexo femenino (n=29). La mayoría de los pacientes fueron adultos, con una mediana de edad de 55 años en los varones (Intervalo intercuartílico de 28 a 68 años) y 43 años en las mujeres (intervalo intercualtílico de 28 a 62 años). La complicación más frecuentemente detectada en los paciente fue el derrame pleural en el 11,7% (n=7). Dentro de las comorbilidades presentes en el grupo estudiado se incluyen asma severa, tuberculosis y VIH, en un 1,7% respectivamente.
Las muestras biológicas analizadas incluyeron mayoritariamente esputo (n=40) y secreciones traqueales (n=11), las restantes muestras (n=9) correspondieron a muestras de lavado broncoalveolar y líquido pleural. Los métodos convencionales de cultivo detectaron la presencia de gérmenes comunes como estreptococosdel grupo viridans en el 40% de las muestras (n=24), Cándida sp en el 15% (n=9), Enterobacterias como: Enterobacter sp, Klebsiella pneumoniae y Serratia marcens, en el 11,6% (n=7). La presencia de bacterias como Haemophilus influenzae, Staphylococcus aureus, estafilococos coagulasa negativa no superó el 1,7%. Los métodos convencionales de cultivo fueron incapaces de detectar gérmenes comunes en el 45% de las muestras (n=27).
Para las pruebas de estandarización de la reacción de PCR se emplearon como molde, soluciones control de ADN de Mycoplasma pneumoniae, Chlamydophila pneumoniae y Legionella pneumoniae. Las condiciones óptimas para la amplificación de los genes 16s rRNA de M. pneumoniae y ompA de C. pneumoniae incluyeron: concentración de primers de 0,5 µM y 1,5 mM cloruro de magnesio, empleando como temperatura de hibridación de los primers 55ºC. En el caso de la amplificación del fragmento del gen mip de L. pneumophila la concentración de primers óptima fue de 1,0 µM y se mantuvo la concentración de cloruro de magnesio a 1,5 mM, así mismo con el objetivo de disminuir la presencia de bandas inespecíficas la etapa de hibridación de primers se realizó a 57ºC. El resto de los parámetros de reacción y ciclado se mantuvo tal cual lo describieron Mejuto y colaboradores (17). Los productos de PCR obtenidos fueron del tamaño esperado 352 pb para M. pneumoniae, 333 pb para C. pneumoniae y 233 pb para L. pneumophila.
Los productos de PCR obtenidos de cada microorganismo fueron empleados como inserto en reacciones de ligamiento empleando el vector pGEMT-Easy y la mezcla de ligamiento fue utilizada para transformar E. coli DH5α. Se obtuvieron plásmidos recombinantes de tamaño esperado evaluados mediante electroforesis en gel de agarosa. Se seleccionaron una serie de 5 plásmidos recombinantes para cada microorganismo y fueron sometidos a la PCR respectiva con la finalidad de confirmar la presencia del inserto. La totalidad de los plásmidos sometidos a este procedimiento originó productos de PCR de tamaño esperado y a modo de confirmación definitiva fueron secuenciados. Las secuencias obtenidas se alinearon con las bases de datos del NCBI mediante la herramienta BLAST y se observó un 100% de similitud, De los analizados, se seleccionaron los plásmidos p12A, p911A y pLeg1, portadores de insertos de M. pneumoniae, C. pneumoniae y L. pneumophila respectivamente como controles positivos de para las reacciones de PCR.
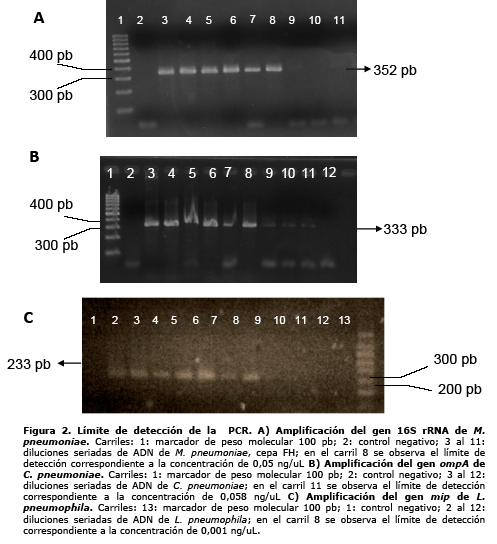
Para determinar el límite de detección de las reacciones de PCR para cada microorganismo, realizamos diluciones seriadas de las soluciones de los plásmidos control previamente cuantificadas por espectrofotometría ultravioleta. Dichas diluciones fueron sometidas a amplificación empleando los protocolos de PCR estandarizados. En el caso de M. pneumoniae, C. pneumoniae y L. pneumophila el límite de detección fue respectivamente de 0,050 ng/µL, 0,058 ng/µL y 0,001 ng/µL (figura 2). El uso de las mismas diluciones de plásmidos control en la PCR múltiple permitió observar la obtención de productos específicos para cada microorganismo, así como la ausencia de reacciones cruzadas entre los mismos, sin embargo se observó una disminución en el límite de sensibilidad de la detección para M. pneumoniae (0,075ng/µL) y C. pneumoniae (0,1 ng/µL), probablemente asociada al hecho de precisar 57ºC en la fase de hibridación de primers con la finalidad de favorecer la especificidad de unión.
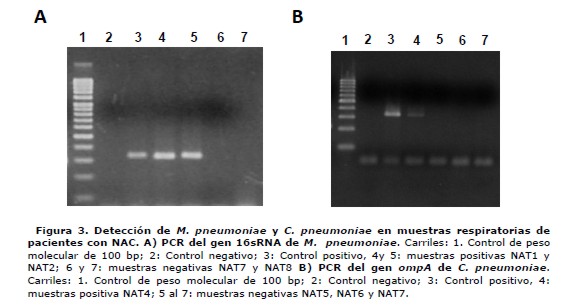
El método empleado para la extracción de ADN a partir de las muestras respiratorias generó un rendimiento en el rango de 30 a 1000 ng/µL. Los rendimientos mayores se registraron en muestras de esputo con gran celularidad. El ADN extraído de las 60 muestras biológicas incluidas en el presente periodo de estudio fue sometido a amplificación empleando las condiciones de PCR estandarizadas previamente descritas. Se empleó como molde entre 30 a 100 ng de ADN por reacción. Se obtuvieron resultados positivos para M. pneumoniae y C. pneumoniae en el 18,3% (n=11) y 1,7% (n=1) de las muestras. No detectamos la presencia de L. pneumophila en las muestras analizadas (figura 3).
Aún con el análisis combinado de los hallazgos microbiológicos y moleculares, no se pudo identificar el agente etiológico de la NAC en 24 pacientes. Se detectó un solo patógeno en 17 pacientes, mientras que los 19 pacientes remanentes se caracterizaron por coinfecciones de 2 hasta 4 microorganismos. M. pneumoniae se presentó como patógeno único en 3 de los 11 casos positivos para este germen. Mientras que el paciente que resultó positivo para C. pneumoniae presentó coinfección con Streptococcos del grupo viridans y Neisseria sp. No se observaron productos inespecíficos de amplificación en muestras que presentaban gérmenes comunes aislados por métodos convencionales de cultivo.
DISCUSIÓN
Si bien los resultados obtenidos corresponden a un número modesto de muestras analizadas, nos han permitido generar los primeros datos nacionales de la presencia de M. pneumoniae y C. pneumoniae en muestras respiratorias de pacientes con NAC. Para poder determinar la prevalencia de estos gérmenes, seguimos colectando y procesando muestras por un periodo de dos años. El número de casos que hemos registrado coincide de forma aproximada con datos publicados por Díaz y colaboradores que analizaron 176 pacientes con NAC en dos años de estudio en un hospital de referencia de Chile que contaba con 520 camas y es superior al reportado por Donalisio y colaboradores que estudiaron 66 pacientes hospitalizados en Sumaré, Brasil por cuadros de NAC en un periodo dos años de trabajo (1,6).
Los pacientes con NAC fueron en su mayoría adultos mayores y se observó un ligero predominio de hombres sobre mujeres. Estos datos coinciden con lo reportado en la literatura en estudios realizados en Chile, Brasil y Suecia (1,5,6). La complicación más frecuente registrada fue el derrame pleural en el 11,7% de los pacientes y las comorbilidades incluyeron asma severa, tuberculosis y VIH. Las muestras biológicas analizadas incluyeron mayoritariamente a esputo y secreción traqueal, con menor frecuencia se estudiaron muestras de lavado broncoalveolar y líquido pleural.
Los métodos convencionales de cultivo detectaron la presencia de gérmenes comunes como estreptococosdel grupo viridans en el 40% de las muestras (n=24), Cándida sp en el 15% (n=9), Enterobacterias como: Enterobacter sp, Klebsiella pneumoniae y Serratia marcens, en el 11,6% (n=7). La presencia de bacterias como Haemophilus influenzae, Staphylococcus aureus, estafilococos coagulasa negativa no superó el 1,7%. La mayoría de los microorganismos aislados pertenecen a flora de boca y tracto respiratorio, en estos casos para definir el agente etiológico es importante determinar la carga bacteriana, para lo cual se precisan de métodos microbiológicos cuantitativos no realizados de forma rutinaria. Otro factor importante es el estado inmunológico del paciente, en nuestra serie uno sólo de los participantes presentaba infección por VIH. Es llamativo el hecho de que en la muestras analizadas no se aislóStreptococcus pneumoniae, que ha sido citado como el agente más frecuente de NAC en diversos estudios realizados a nivel mundial (2,3,18,19). Una posibilidad es el consumo previo de antibióticos, usualmente sin prescripción médica por parte de los pacientes antes de llegar a consulta, lo cual podrían inhibir el crecimiento de esta bacteria en los medios de cultivo convencionales. Los métodos de cultivo arrojaron resultados negativos en el 45% de los pacientes. Este hecho podría deberse al uso previo de antibióticos, con la consiguiente inhibición del crecimiento bacteriano o bien la posibilidad de que en estos casos el agente etiológico de la neumonía sea un virus.
El empleo de soluciones patrón de ADN de M. pneumoniae, C. pneumoniae y L. pneumophila permitió establecer las condiciones óptimas de amplificación de fragmentos de los genes 16S rRNA, ompA y mip respectivamente. Se obtuvieron productos del tamaño esperado y no se observaron bandas de amplificación inespecífica. Diversos autores han diseñado y validado técnicas diversas con fundamento molecular para el diagnóstico de M. pneumoniae, C. pneumoniae y L. pneumophila con excelentes resultados de sensibilidad y especifidad. Así por ejemplo Ginevra y colaboradores compararon métodos de PCR múltiple e hibridación de ácidos nucleicos para los tres microorganismos citados y obtuvieron un 98,6% de concordancia con métodos serológicos considerados como métodos gold standard. Gullsby y colaboradores diseñaron un método de PCR a tiempo real que amplificaba genes de la adhesina P1 de M. pneumoniae y ompA de C. pneumoniae de forma simultánea que comparado con PCR convencional realizada de forma individual mostró sensibilidades del orden del 93 al 100% y especificidades del 98 al 100%. En el caso de L. pneumophila se han desarrollado métodos moleculares de alta complejidad como por ejemplo la SBT (Seqcuence based typing, Tipificación basada en secuenciación) que permite la amplificación simultánea de 7 genes directamente de muestras clínicas y ambientales y la consiguiente secuenciación de dichos productos permite diferenciar aislados y contribuir a estudios epidemiológicos (14,20,21).
La obtención de plásmidos recombinantes mediante el clonado de los productos de PCR de cada microorganismo en un vector comercial como pGEMT-Easy, nos ofreció la ventaja sustancial de generar un sistema de producción de muestras control con bajo costo, a diferencia de los elevados precios de soluciones de ADN comerciales o cepas ATCC de difícil crecimiento, más aún considerando que son obligatorias en cada serie de reacciones de PCR. El límite de detección de la reacción de PCR individual estuvo comprendido entre 0,05 y 0,001 ng/µL de plásmidos control y se vio ligeramente disminuida en la reacción múltiple para M. pneumoniae y C. pneumoniae, probablemente debido que se empleó una temperatura más alta para la etapa de hibridación de primers que en la versión individual.
La aplicación de la técnica de PCR múltiple descrita en este trabajo sobre muestras clínicas provenientes de pacientes con NAC permitió la detección de M. pneumoniae en el 18,3% y C. pneumoniae en el 1,7% de las muestras analizadas. Estos datos posicionan a M. pneumoniae como segundo microorganismo más frecuentemente detectado en los pacientes con NAC incluidos en este trabajo. Estos resultados corresponden al doble de lo reportado en un estudio realizado en dos hospitales de Santiago de Chile durante los años 2005 a 2008 y son cuatro veces mayores que los datos de Donalisio y colaboradores en la región de Sumaré, Brasil (1,22). Estas variaciones de la frecuencia de detección pueden atribuirse a la posibilidad de la colecta de muestra dentro de un periodo estacional con alta tasa de infección por M. pneumoniae, como lo refiere Martínez y colaboradores. Mientras que la diferencia con el estudio realizado en Sumaré podría deberse a que dicho estudio no empleó métodos moleculares sino que se basó en el uso de análisis serológicos, con las consecuentes limitaciones de los mismos. La frecuencia de detección de C. pneumoniae de este trabajo no superó el 2% de las muestras, siendo 3 veces menor a lo reportado en Chile en el 2007. Sin embargo, a pesar de ser baja la frecuencia de infección detectada, es de gran importancia poder identificar a los pacientes infectados con esta bacteria, debido a las consecuencias que puede tener un proceso infeccioso crónico. Es reconocido el rol que cumple C. pneumoniae en el desarrollo de enfermedades respiratorias como cáncer de pulmón y asma, enfermedades cardiovasculares como ateroesclerosis e infarto e incluso enfermedades del sistema nervioso central como Alzheimer. Por tanto es esencial el diagnóstico certero para la prescripción de antibióticos apropiados que controlen el proceso infeccioso y eviten la persistencia crónica de esta bacteria (23-27).
En las muestras analizadas no detectamos la presencia de L. pneumophila, este hecho podría deberse al número discreto de muestras analizadas en este trabajo. Si bien esta bacteria se ha adaptado a vivir en agua, colonizando amebas ambientales, puede producir neumonías en humanos y su frecuencia varía ampliamente en distintas regiones del mundo. En Grecia se han descrito casos aislados y brotes en España como el descrito en Murcia por García y colaboradores. Así un estudio realizado describe 97 casos esporádicos de la enfermedad del legionario, con presentaciones clínicas graves que precisaron asistencia de respiradores mecánicos en el 22% y que conllevaron al óbito en el 12,5% de los pacientes (9,28,29).
Si bien una de las principales limitaciones de la técnica de PCR que aplicamos en este trabajo ha sido la dificultad de obtener ADN patrón de estos microorganismos fue resuelta mediante la estrategia del empleo de plásmidos recombinantes, queda la posibilidad de la presencia de inhibidores de la reacción de PCR en las muestras biológicas que conlleven a falsos resultados negativos. Por lo que planeamos en un futuro próximo incluir dentro de la técnica la amplificación de un gen como control interno para validar la calidad del ADN extraído, en el sentido de determinar la presencia de inhibidores de la PCR. Este control interno consiste en un gen propio de humanos (housekeeping gene) como por ejemplo el gen de la betaglobina, de forma que todas las muestras de buena calidad deberán tener como mínimo el producto de amplificación del control interno, independientemente de la presencia de los genes propios de los microorganismos causantes de NAC.
La ejecución de este trabajo pone de manifiesto la capacidad tanto profesional como estructural así como la factibilidad a nivel nacional del diseño y empleo de forma eficiente de técnicas moleculares para el diagnóstico de infecciones respiratorias causadas por microorganismos no cultivables o de difícil crecimiento en medios de cultivo convencionales. Este tipo de estrategia podrá ser utilizada a futuro para el diseño de kits de diagnóstico molecular para diversos patógenos con costos razonables y competitivos frente a aquellos ofrecidos internacionalmente.
La técnica de PCR estandarizada en este trabajo permite detectar la presencia de M. pneumoniae, C. pneumoniae y L. pneumophila en muestras respiratorias de forma sensible y específica.
Los resultados preliminares indican como gérmenes más frecuentemente identificados en pacientes con NAC a Streptococcos del grupo viridans, M. pneumoniae y Cándida sp.
Para determinar la prevalencia de gérmenes atípicos como M. pneumoniae, C. pneumoniae y L. pneumophila en NAC precisamos continuar con el presente estudio hasta completar el tamaño de muestra establecido en el diseño del protocolo de investigación.
AGRADECIMIENTOS
Este proyecto ha sido financiado por la Dirección General de Investigación Científica y Tecnológica de la Universidad Nacional de Asunción dentro de la convocatoria de apoyo a proyectos de investigación del 2011.
Agradecemos a: la Dra. María Angélica Martínez de la Facultad de Medicina de la Universidad de Chile y al Dr. Gerardo de Lucca del Instituto de Medicina Tropical de la Universidad del Nordeste, Resistencia, Argentina por ceder gentilmente soluciones de ADN control, así como al Dr. Víctor Aquino y al Dr Alberto Amarilla de la Facultad de Farmacia de la Universidad de Sao Paulo por su colaboración con la secuenciación de los insertos de los plásmidos recombinantes obtenidos en este trabajo.
REFERENCIAS BIBLIOGRÁFICAS
1. Donalisio MR, Arca CHM, de Madureira PR. Clinical, epidemiological, and etiological profile of inpatients with community-acquired pneumonia at a general hospital in the Sumaré microregion of Brazil. J Bras Pneumol 2011;37(2):200-8. [ Links ]
2. Lassmann B, Poetschke M, Ninteretse B, Issifou S, Winkler S, Kremsner PG, et al. Community-acquired pneumonia in children in Lambarene, Gabon. Am. J. Trop. Med. Hyg. 2008; 79(1):109-14. [ Links ]
3. Miyashita N, Fukano H, Mouri K, Fukuda M, Yoshida K, Kobashi Y, et al. Community-acquired pneumonia in Japan: a prospective ambulatory and hospitalized patient study. J Med Microbiol. 2005 Apr;54(Pt 4):395-400. [ Links ]
4. Ministerio de Salud Pública y Bienestar Social. Indicadores básicos de salud, Paraguay 2010. Asunción: Ministerio de Salud Pública y Bienestar Social; 2010. p. 1-16. [ Links ]
5. Johansson N, Kalin M, Tiveljung-Lindell A, Giske CG, Hedlund J. Etiology of community-acquired pneumonia: increased microbiological yield with new diagnostic methods. Clin. Infect. Dis. 2010; 50(2): 202-9. [ Links ]
6. Díaz A, Barria P, Niederman M, Restrepo MI, Dreyse J, Fuentes G, et al. Etiology of community-acquired pneumonia in hospitalized patients in chile: the increasing prevalence of respiratory viruses among classic pathogens. Chest. 2007; 131(3):779-87. [ Links ]
7. Beersma MFC, Dirven K, van Dam AP, Templeton KE, Claas ECJ, Goossens H. Evaluation of 12 commercial tests and the complement fixation test for Mycoplasma pneumoniae-specific immunoglobulin G (IgG) and IgM antibodies, with PCR used as the «gold standard». J. Clin. Microbiol 2005; 43(5):2277-85. [ Links ]
8. Wadowsky RM, Castilla EA, Laus S, Kozy A, Atchison RW, Kingsley LA, et al. Evaluation of Chlamydia pneumoniae and Mycoplasma pneumoniae as etiologic agents of persistent cough in adolescents and adults. J. Clin. Microbiol. 2002; 40(2):637-40. [ Links ]
9. Zarogoulidis P, Alexandropoulou I, Romanidou G, Konstasntinidis TG, Terzi E, Saridou S, et al. Community-acquired pneumonia due to Legionella pneumophila, the utility of PCR, and a review of the antibiotics used. Int J Gen Med 2011; 4:15-9. [ Links ]
10. Lee K-Y, Youn Y-S, Lee J-W, Kang J-H. Mycoplasma pneumoniae pneumonia, bacterial pneumonia and viral pneumonia. J Pediatr (Rio J). 2010; 86(6):448-50. [ Links ]
11. Rokosz N, Rastawicki W, Zasada AA, Baczewska-Rej M. Microbiological diagnosis of respiratory infections caused by Legionella pneumophila. Pneumonol Alergol Pol. 2010; 78(1):54-9. [ Links ]
12. Chedid MB, Chedid MF, Ilha DO, Bozzetti MC, Chaves L, Griza D, et al. Community-acquired pneumonia by Chlamydophila pneumoniae: a clinical and incidence study in Brazil. Braz J Infect Dis. 2007; 11(1):75-82. [ Links ]
13. Yong SFY, Tan SH, Wee J, Tee JJ, Sansom FM, Newton HJ, et al. Molecular Detection of Legionella: Moving on From mip. Front Microbiol. 2010;1:123. [ Links ]
14. Ginevra C, Lopez M, Forey F, Reyrolle M, Meugnier H, Vandenesch F, etal. Evaluation of a nested-PCR-derived sequence-based typing method applied directly to respiratory samples from patients with Legionnaires disease. J. Clin. Microbiol. 2009; 47(4):981-7. [ Links ]
15. Loens K, Beck T, Ursi D, Overdijk M, Sillekens P, Goossens H, et al. Development of Real-Time Multiplex Nucleic Acid Sequence-Based Amplification for Detection of Mycoplasma pneumoniae, Chlamydophila pneumoniae, and Legionella spp. in Respiratory Specimens. J Clin Microbiol 2008; 46(1):185-91. [ Links ]
16. Kawanami T, Yatera K, Fukuda K, Yamasaki K, Kunimoto M, Nagata S, et al. Diagnosis of fulminant pneumonia caused by Legionella pneumophila serogroup 8 with the sequence analysis of the 16S rRNA gene. Tohoku J. Exp. Med 2011; 225(1):65-9. [ Links ]
17. Mejuto P, Boga JA, Melón S, Cimadevilla R, Alonso P. Aplicación de técnicas moleculares en el diagnóstico de la neumonía extrahospitalaria. España. Enferm Infecc Microbiol Clin. 2008;26, extraordinario 4, especial congreso: 176. [ Links ]
18. Sethi S, Murphy TF. Bacterial infection in chronic obstructive pulmonary disease in 2000: a state-of-the-art review. Clin Microbiol Rev 2001; 14(2):336-63. [ Links ]
19. Shibli F, Chazan B, Nitzan O, Flatau E, Edelstein H, Blondheim O, et al. Etiology of community-acquired pneumonia in hospitalized patients in northern Israel. Isr Med Assoc J 2010; 12(8):477-82. [ Links ]
20. Ginevra C, Barranger C, Ros A, Mory O, Stephan J-L, Freymuth F, et al. Development and Evaluation of Chlamylege, a New Commercial Test Allowing Simultaneous Detection and Identification of Legionella, Chlamydophila pneumoniae, and Mycoplasma pneumoniae in Clinical Respiratory Specimens by Multiplex PCR. J. Clin Microbiol 2005; 43(7):3247-54. [ Links ]
21. Gullsby K, Storm M, Bondeson K. Simultaneous Detection of Chlamydophila pneumoniae and Mycoplasma pneumoniae by Use of Molecular Beacons in a Duplex Real-Time PCR. J Clin Microbiol 2008; 46(2):727-31. [ Links ]
22. Martínez MA, Ruiz M, Zunino E, Luchsinger V, Avendaño LF. Detection of Mycoplasma pneumoniae in adult community-acquired pneumonia by PCR and serology. J Med Microbiol 2008; 57(Pt 12):1491-5. [ Links ]
23. Contini C, Seraceni S, Cultrera R, Castellazzi M, Granieri E, Fainardi E. Chlamydophila pneumoniae Infection and Its Role in Neurological Disorders. Interdiscip Perspect Infect Dis. 2010; 273-573. [ Links ]
24. Biscione GL, Corne J, Chauhan AJ, Johnston SL. Increased frequency of detection of Chlamydophila pneumoniae in asthma. Eur Respir J 2004; 24(5):745-9. [ Links ]
25. Newcomb DC, Peebles RS Jr. Bugs and asthma: a different disease? Proc Am Thorac Soc. 2009; 6(3):266-71. [ Links ]
26. Gagliardi RJ, Caiaffa-Filho HH. Chlamydia pneumoniae and stroke: is there a direct relationship? Arq Neuropsiquiatr 2009; 67(3A):600-4. [ Links ]
27. Chaturvedi AK, Gaydos CA, Agreda P, Holden JP, Chatterjee N, Goedert JJ, et al.Chlamydia pneumoniae infection and risk for lung cancer. Cancer Epidemiol. Biomarkers Prev. 2010; 19(6):1498-505. [ Links ]
28. García-Fulgueiras A, Navarro C, Fenoll D, García J, González-Diego P, Jiménez-Buñuales T, et al. Legionnaires disease outbreak in Murcia, Spain. Emerging Infect Dis 2003; 9(8):915-21. [ Links ]
29. Benito JR, Montejo JM, Cancelo L, Zalacaín R, López L, Fernández Gil de Pareja J, et al. Community-acquired pneumonia due to Legionella pneumophila serogroup 1. Study of 97 cases. Enferm Infecc Microbiol Clin 2003; 21(8):394-400. [ Links ]
*Autor Correspondiente:Dra. Rosa Guillén, Dpto. de Biología Molecular. Instituto de Investigaciones en Ciencias de la Salud. UNA. Paraguay. Email:rmguillenf@gmail.com. Fecha de recepción: marzo de 2012, Fecha de aceptación: mayo 2012.