Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO
Related links
-
 Similars in
SciELO
Similars in
SciELO
Share
Memorias del Instituto de Investigaciones en Ciencias de la Salud
On-line version ISSN 1812-9528
Mem. Inst. Investig. Cienc. Salud vol.9 no.2 Asunción Dec. 2011
ARTICULO ORIGINAL
Expresión de la proteína p53 en esófago de Barrett y adenocarcinoma esofágico. Experiencia del Departamento de Patología, IICS
Expression of p53 protein in Barrets esophagus and esophageal cancer. Experience of the Department of Pathology, IICS
*Campos S, Figueredo Thiel S, Kasamatsu E
Departamento de Patología. Instituto de Investigaciones en Ciencias de la Salud, Universidad Nacional de Asunción. Paraguay
RESUMEN
El esófago de Barrett constituye el cambio del epitelio escamoso a columnar (metaplasia) secundaria al reflujo gastro-esofágico. El significado clínico es la predisposición a úlceras, sangrado y desarrollo de adenocarcinoma. Se desconoce el periodo necesario para el desarrollo de displasia y la transición a carcinoma, lo que hace necesario contar con indicadores de la progresión neoplásica o de transformación maligna. La proteína p53 participa del control del ciclo celular, síntesis y reparación del ADN y muerte celular programada. Numerosos trabajos describen la acumulación de la proteína p53 en lesiones displásicas de esófago sugiriendo que esta alteración participaría en la tumorgénesis esofágica. Este trabajo tiene como objetivo determinar, la expresión de p53, por inmunohistoquímica en 58 biopsias de esófago de las cuales, 42 correspondieron a esófago de Barrett y 16 a adenocarcinoma esofágico describiendo la frecuencia de expresión de p53, asi como las características clínicas, endoscópicas e histológicas de las lesiones. La expresión de p53 fue positivo en 15/42 (36%) casos de esófago de Barrett, la frecuencia fue mayor en los que presentaban esofagitis y en los casos con displasia que en los que no presentaban estas características. Por otro lado, p53 fue positivo en 9/16 (56%) de los adenocarcinomas. El estudio por inmunohistoquímica de p53 en estas dos entidades podría utilizarse como un indicador que contribuya al mejor manejo de la enfermedad en estos pacientes.
Palabras clave: p53, esófago de Barret, adenocarcinoma, inmunohistoquímica.
ABSTRACT
Barrett's esophagus is the change of the squamous epithelium to columnar (metaplasia) secondary to gastro-oesophageal reflux.The clinical significance is a predisposition to ulcers, bleeding and development of adenocarcinoma.It is not known the time needed for the development of dysplasia and the transition to carcinoma, which makes necessary to have indicators of neoplastic progression or malignant transformation. p53 protein participates in cell cycle control, DNA synthesis and repair and programmed cell death. Numerous papers describe the accumulation of p53 protein in esophageal dysplastic lesions, suggesting that this alteration would participate in esophageal tumorigenesis. The objective of this work was to determine the expression of p53 by immunohistochemistry in 58 esophageal biopsies of which 42 corresponded to Barrets esophagus and esophageal and 16 to esophageal adenocarcinoma, describing the frequency of expression of p53, as well as the clinical, endoscopic and histological characteristics of the lesions. p53 expression was positive in 15/42 (36%) cases of Barrett's esophagus; the frequency was higher in those with esophagitis and in patients with dysplasia than in those without these characteristics. On the other hand, p53 was positive in 9/16 (56%) of adenocarcinomas. The study of p53 in these two entities could be used as an indicator that contributes to a better management of the disease in these patients.
Keywords: p53, Barrett's esophagus, adenocarcinoma, immunohistochemistry.
INTRODUCCION
En 1950, Norman Barrett realizó la primera descripción clínica de la sustitución del epitelio escamoso esofágico normal por un epitelio columnar como consecuencia de la existencia de reflujo gastroesofágico mantenido y patológico. El esófago de Barrett es una metaplasia del epitelio escamoso a columnar, secundario al reflujo esofágico en la zona de uniòn esófago cardial. El significado clínico de esta condición es la predisposición a úlceras esofágicas, sangrado y fundamentalmente al desarrollo de adenocarcinoma. La metaplasia de Barrett se desarrolla en el 6 a 14% de los pacientes con enfermedad por reflujo gastroesofágico. De 0,5 a 1% de éstos pueden desarrollar adenocarcinoma de esófago, entidad que aumenta en incidencia en los últimos años por razones desconocidas (1-3).
El adenocarcinoma asociado al esófago de Barrett se desarrolla en un proceso secuencial que se reconoce morfológicamente por la presencia de metaplasia, displasia de bajo grado, displasia de alto grado y cáncer y aunque esta secuencia está bien caracterizada no se conoce el periodo necesario para el desarrollo de la displasia y la subsecuente transición a carcinoma, lo que hace necesario contar con marcadores objetivos de la progresión neoplásica a fin de tener un mejor conocimiento de este proceso e identificar potenciales marcadores iniciales de la transformación maligna. En este sentido se realizaron numerosos estudios sobre la expresión y los cambios de patrones de expresión de marcadores de proliferación como Ki67, factores de crecimiento y p53 en varios tipos de tumores (3,4).
El gen p53 se localiza en el cromosoma 17p13. El gen p53 codifica un factor de transcripción, la proteína p53, que fue descubierta a fines de los años 70 y participa en el control del ciclo celular, en la síntesis y reparación del ADN y en la muerte celular programada. El producto del gen p53 es un regulador del crecimiento y la proliferación celular; en su forma libre (wild type) la proteína p53 suprime el crecimiento celular, mientras que en la proteína mutada actúa como oncogene. El contexto celular, la interacción con otras proteínas celulares y oncovirales y los cambios en la conformación física del p53, son los responsables de la modulación de las funciones de p53 (5-7).
Las mutaciones del gen p53 usualmente tienen como resultado la acumulación de la proteína p53 y de esta manera el producto del gen puede ser detectado por métodos inmunohistoquímicos. La acumulación de la proteína p53 puede ser detectada en una variedad de tumores como carcinoma de mama, pulmón, testículo, estómago, tumores de tejidos blandos y melanomas. La positividad del p53 ha sido asociada al pronóstico en cáncer colorectal y de mama entre otros; con el desarrollo de metástasis en cáncer de pulmón y con la disminución de la sobrevida en pacientes con carcinoma de mama, colon, estómago y pulmón (5-10).
Numerosos trabajos describen la acumulación de la proteína p53 en lesiones displásicas de esófago sugiriendo que esta alteración podría tener un rol en la tumorgénesis esofágica. Esta acumulación se hace más evidente a medida que aumenta el grado de lesión. La frecuencia de positividad del p53 en esófago de Barrett y adenocarcinomas varía según los autores, entre el 30 y 80%, según el grado de displasia y entre 44 y 90% en adenocarcinomas (8-13).
En nuestro país no existen datos sobre la frecuencia del p53 en estos dos tipos de lesiones esofágicas, y su determinación como un complemento al diagnóstico histopatológico, podría contribuir como un indicador pronóstico, de la posible malignización o progresión de la lesión en estos pacientes.
MATERIALES Y MÉTODOS
Estudio transversal descriptivo de 58 pacientes sometidos a biopsias endoscópicas de esófago con diagnóstico de esófago de Barrett o adenocarcinoma de esófago confirmados histológicamente, provenientes de los Hospitales de Clínicas, Policial, IPS y registrados en el Departamento de Patología del Instituto de Investigaciones en Ciencias de la Salud durante el periodo 2000-2007. Todos los datos e información personal de los pacientes se manejaron de manera confidencial.
Se analizaron las biopsias endoscópicas de esófago incluidas en bloques de parafina en buen estado de conservación y con material suficiente para realizar los cortes necesarios; el diagnóstico de esófago de Barrett, fue confirmado por la presencia de la metaplasia intestinal y cambio de mucina con la coloración del acido peryódico de Schiff (PAS) y Azul de Alcián a pH 2,5.
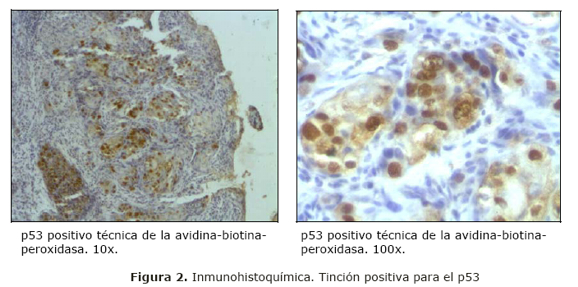
De cada biopsia se realizaron, además de los cortes necesarios para las tinciones de rutina: hematoxilina eosina y PAS, Azul de Alcián y para la Técnica de inmunohistoquímica, 3 cortes de 5 micras en láminas previamente tratadas con poli-L-lisina para asegurar la adherencia de los cortes. Se estudió la variable de interés: presencia de la proteína p53 por la técnica de inmunohistoquímica, utilizando el método del complejo Avidina-Biotina-Peroxidasa (LSAB-2.Kit, Dako, Carpintería California). Luego de desparafinar los cortes, inhibir la peroxidasa endógena y realizar la recuperación antigénica con disolución tampón de citrato 10mM pH6, las láminas se incubaron 30 min. a temperatura ambiente en cámara húmeda con el anticuerpo primario anti proteína p53 humana dilución 1:50 (p53 DO-7, Dako, Carpintería, California). Posteriormente se procedió según las instrucciones del fabricante. En cada determinación se incluyeron cortes de tejido positivo y negativo de control.
La positividad de la reacción fue evaluada por microscopía óptica, se consideró positiva la reacción cuando se encontró más del 10% de las células con la tinción nuclear característica.
Los datos se analizaron por medio de estadística descriptiva.
RESULTADOS
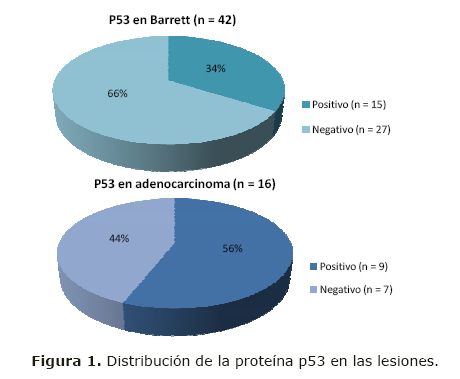
Del total de biopsias analizadas (n=58), 22 (38%) correspondieron a pacientes del sexo femenino y 36 (62%) del sexo masculino. La media de edad fue de 59 años ±13 con un rango de 23 a 86 años. De los casos estudiados 42 (72%) correspondieron a esófago de Barrett, y 16 (28%) a adenocarcinoma de esófago.
El p53 fue positivo en 15/42 (34%) casos de esófago de Barrett. En este grupo, 25/42 (59%) fueron del sexo masculino. La edad promedio en este grupo fue de 59 ±14 años y un rango de 23 a 68 años.
Por otro lado en las biopsias con diagnóstico de adenocarcinoma, el p53 fue positivo en 9/16 (56 %) de las mismas. En este grupo la edad promedio de los pacientes fue de 57 años ± 9 con un rango de edad de 43 a 79 años. Correspondieron al sexo femenino 5 (31%) y al masculino 11(69%), (figuras 1 y 2).
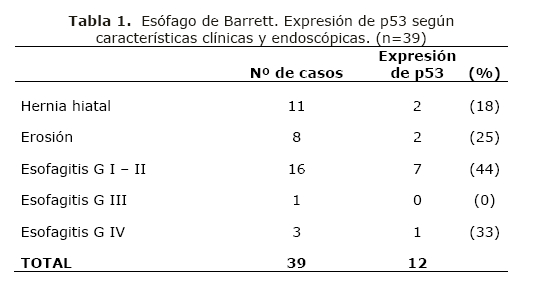
Además en los casos de diagnóstico de esófago de Barret, se analizó la frecuencia de expresión de p53 en relación a los datos clínicos y endoscópicos (erosiones, esofagitis en diferentes grados y hernia hiatal) Si bien no se tuvo esta información en todos los casos, el análisis se realizó con aquellos en que se disponía de los datos. La expresión del p53 en este grupo de biopsias se resume en la tabla 1.
Por otro lado, hemos investigado la frecuencia de expresión de p53 en las alteraciones morfológicas a nivel histológico (grado de displacia) que se presentaron acompañando el diagnostico de esófago de Barrett. De las 42 biopsias con diagnóstico histológico de esófago de Barret, 35 presentaban displasia de bajo grado, 7 displasia de alto grado. En la tabla 2 se presenta la frecuencia de expresión del p53 en los diferentes grados de displasia.
DISCUSION
La mutación del gen p53 se encuentra ocasionalmente en la mucosa metaplásica sin displasia y en displasias de bajo grado, la frecuencia de esta mutación aumenta dramáticamente hasta un 80% en algunas series, en las displasias de alto grado y el adenocarcinoma de esófago. Actualmente en el esófago de Barrett, la displasia es uno de los factores más útiles para predecir la evolución hacia una lesión maligna, sin embargo este criterio no es absoluto. El menor riesgo de desarrollar adenocarcinoma se ve en el esófago de Barrett, sin cambios displásicos o quizás en la displasia de bajo grado y a medida que el grado de displasia aumenta, la posibilidad de desarrollar adenocarcinoma es mayor, muchos estudios han demostrado que esta situación se potencializa si acompañando la displasia se detecta la proteína p53 (1-7).
En este estudio se ha establecido la frecuencia de expresión del p53 en los casos de esófago de Barret y adenocarcinoma, y los resultados obtenidos coinciden con varios estudios, si bien hay series que reportan una mayor frecuencia. Sin embargo, a pesar de la alta frecuencia de mutaciones del p53 en el desarrollo del esófago de Barret y adenocarcinoma, la importancia clínica de estos hallazgos es aún incierta (5-9).
Si bien varios autores reportan una diferencia estadísticamente significativa en la expresión del p53 en displasias de bajo y alto grado, en este estudio no hemos establecido la diferencia de expresión, debido al número de biopsias con estas características. Sería interesante y de utilidad indagar con mayor rigor la asociación entre el p53 y los grados de displasia en estudios prospectivos en nuestros pacientes, ya que son numerosos los estudios que demuestran el incremento de la expresión a medida que la lesión avanza a mayores grados dejando pocas dudas sobre el rol del p53 en la patogénesis tumoral. Por otro lado, los estudios coinciden en el marcado aumento de la expresión del p53 en los casos de displasia de alto grado, que también coinciden con los hallazgos de este estudio en el que encontramos expresión del p53 en displasia de alto grado (6,8-13).
Pocos estudios han examinado el valor pronóstico del p53, en el adenocarcinoma de esófago sin llegar a un consenso en este aspecto, reportando frecuencias entre el 50 y 70%, nuestro resultado en las biopsias de adenocarcinmoa coinciden con estos hallazgos (2, 6,7).
Este estudio en que se analizó la expresión de una oncoproteína en una patología que tiene un modelo secuencial de malignización y en una patología tumoral con un importante pronóstico, podría servir de base para analizar la presencia y el probable rol de esta oncoproteína en estudios posteriores (14-16).
Si bien la limitación de este estudio está dada por el número de biopsias estudiadas, en base a los hallazgos de este estudio y a los que refieren la literatura, consideramos que podría ser importante incluir la determinación del p53 como complemento del estudio histopatológico en todas las biopsias esofágicas con diagnóstico de esófago de Barret, como también en los casos de adenocarcinoma esofágico teniendo en cuenta que, si bien este aspecto es aún controversial, podría ser un indicador pronóstico de utilidad en el manejo clínico de estos pacientes.
REFERENCIAS BIBLIOGRÁFICAS
1. Tselepis C, Perry I, Jankowski J. Barretts oesophagus: disregulation of cell cycling and intercellular adhesion in the metaplasia- dysplasia- carcinoma secuence. Digestion. 2000;61(1):1-5. [ Links ]
2. González MB, Menéndez MJ, Artimez ML, Rodrigo L, López Larrea C, Menéndez MJ et al. Mutation analisis of the p53, APC, and p16 genes in Barretts oesophagus, dysplasia and adenocarcinoma. J Clin Pathol. 1997; 50(3):212-7. [ Links ]
3. Mueller J, Werner M, Sievert JR. Malignant progression in Barrets oesophagus: pathology and molecular biology. Recent Results in Cancer Res. 2000;155:29-41. [ Links ]
4. Ireland AP, Clark GW, DeMeester TR. Barretts oesophagus. The significance of p53 in clinical practice. Ann Surg. 1997; 255(1).17-30. [ Links ]
5. Greenblatt MS, Bennett WP, Hollstein M, Harris CC. Mutations in the p53 tumor suppressor gene: Clues to cancer etiology and molecular pathogenesis. Cancer Res 1994; 54:4855–78. [ Links ]
6. Kim R, Clarke MR, Melhem MF, Yuong MA, Vanbibber MM, Safatle-Ribeiro AV, et al. Expression of p53, PCNA, cerB-2 in Barretts metaplasia and adenocarcinoma. Dig Dis Sci. 1997 Dec; 42(12):2453-62. [ Links ]
7. Reid BJ, Prevo LJ, Galipeau P, Sanchez C, Longton G, Levine DS. Barretts oesophagus: from metaplasia to dysplasia and cancer.Gut 2005; 54(Suppl I):i6–i12. [ Links ]
8. Levine DS. Barretts oesophagus and p53. Lancet 1994; 344:212-3. [ Links ]
9. Younes M, Lechago J, Chakraborty S, Ostrowski M, Bridges M, Meriano F, et al. Relationship between dysplasia, p53 protein accumulation, DNA ploidy and Glut-1 overexpression in Barretts metaplasia. Scand J Gastroenterology. 2000. Feb; 35(2):131-7. [ Links ]
10. Giménez A, de Haro LM, Parrilla P, Bermejo J. Immunohistochemical detection of p53 protein could improve the management of some patients with Barretts oesophagus and mild histologic alterations. Arch Pathol Lab Med.1999. Dec; 123(12):1260-3. [ Links ]
11. Illueca C, Llombart Bosch A, Ferrando C. Factores pronósticos en el esófago de Barrett: estudio inmunohistoquímico y morfométrico de 120 casos. J. Rev. Esp. Enferm. Dig. 2000; 92(11):726-37. [ Links ]
12. Coggi G, Bosari S, Roncalli M, Grazianni D, Bossi P, Viale G et al. P53 protein accumulatión en p53 gene mutatión in esophageal carcinoma. A molecular and immunohistochemical study whith clinicopathologic correlations. Cancer. 1997;79:425-32. [ Links ]
13. Garewall H, Ramsey L, Sharma P, Kraus K, Sampliner R, Fass R. Biomarkers studies in reversed Barretts esophagus. Am J Gastroenterol. 1999; 94(10):2829-33. [ Links ]
14. Klump B, Hsich CJ, Holzmann K, Borchard F, Gaco V, Greschnich A. Diagnostic significance of nuclear p53 expression in the surveillance of Barretts esophagus. A longitudinal study. Gastroenterology. 1999; 37(10): 1005-11. [ Links ]
15. Krishnadath KK, Reid BJ, Wang KK. Biomarkers in Barrett esophagus. Mayo Clin Proc 2001; 76:438–46. [ Links ]
16. Aujeský R, Hajdúch M, Neoral C, Král V, Lubuká L, Bohanes T, et al.p53 – Prognostic factor of malignant transformatión of Barrett`s esophagus Biomed. Papers 2005:149(1), 141–4. [ Links ]
17. Hulley SB, Cummings SR. Diseño de la Investigación Clínica. Un enfoque epidemiológico. Barcelona: Doyma: 1993. [ Links ]
*Autor Correspondiente:Dra.Soledad Campos, Dpto. de Patología. Instituto de Investigaciones en Ciencias de la Salud, Universidad Nacional de Asunción. Río de la Plata y Lagerenza. Asunción-Paraguay
Email: patología@iics.una.py, Tel/Fax: 59521480185
Fecha de recepción: Octubre de 2011, Fecha de aceptación: Noviembre de 2011