Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO
Related links
-
 Similars in
SciELO
Similars in
SciELO
Share
Memorias del Instituto de Investigaciones en Ciencias de la Salud
On-line version ISSN 1812-9528
Mem. Inst. Investig. Cienc. Salud vol.8 no.2 Asunción Dec. 2010
ARTICULO ORIGINAL
Frecuencia de los patrones de anticuerpos anti-nucleares en pacientes con sospecha clínica de LES
Frequency of antinuclear antibody patterns in patients with SLE clinical suspicion
*Carpinelli MM, Giménez V, Ferreira L, Rovira C, Picaguá E, Granados E
Departamento de Inmunología. Instituto de Investigaciones en Ciencias de la Salud. Universidad Nacional de Asunción (UNA).Paraguay
RESUMEN
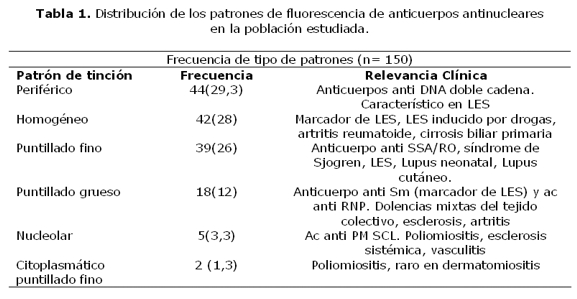
Las enfermedades autoinmunes son alteraciones de los mecanismos de tolerancia inmunológica, con producción de anticuerpos contra antígenos propios, como los anticuerpos antinucleares (ANA), que detectados por inmunofluorescencia indirecta, permiten reconocer varios patrones nucleares y citoplasmáticos, como en el Lupus Eritematoso Sistémico (LES). El objetivo del estudio fue describir los patrones de tinción de ANA en sueros de pacientes con sospecha clínica de LES, que concurrieron al Instituto de Investigaciones en Ciencias de la Salud, durante el año 2008. En este estudio observacional descriptivo, se analizaron 150 sueros positivos para ANA, codificados, respetando la confidencialidad de los mismos. Para la determinación de ANA se utilizaron láminas con células HEp-2 (BIO-RAD-USA), y el conjugado fue anti human IgG de Sigma (USA); la técnica fue inmunofluorescencia indirecta. Del total de 150 pacientes estudiados, 134 (89%) fueron mujeres y 16 (11%) hombres, cuyas edades estaban comprendidas entre 11 y 87 años. De los sueros positivos analizados para ANA, 44 (29%) correspondieron al patrón periférico, 18(12%) puntillado grueso, 39(26%) puntillado fino, 42(28%) homogéneo, 5(3%) nucleolar y 2(1.3%) citoplásmico puntillado fino. En este estudio se encontró en mayor porcentaje el patrón periférico, seguido del homogéneo y puntillado fino, los cuales se hallan asociados a pacientes con LES, indicando un pronóstico poco favorable para estos pacientes.
Palabras claves: anticuerpos antinucleares, patrones de tinción, células HEp-2.
ABSTRACT
Autoimmune diseases are alterations of the immunological tolerance mechanisms, with production of antibodies against self-antigens, such as antinuclear antibodies (ANA), which are detected by indirect immunofluorescence, and allow the recognition of several nuclear and cytoplasmic patterns, as shown in the systemic lupus erythematosus (SLE). The objective of this study was to describe the ANA staining patterns in sera of patients with clinical suspicion of SLE that attended the Instituto de Investigaciones en Ciencias de la Salud during 2008. In this descriptive observational study, 150 coded positive ANA sera were analyzed, respecting the confidentiality of patients. ANA determination was made by indirect immunofluorescence using slides with HEp-2 cells (BIO-RAD-USA) and a antihuman-IgGfluorescein conjugatefrom Sigma (USA). Of the 150 studied patients, 134 (89%) were females and 16 (11%) males with ages between 11 and 87 years. Of the ANA positive sera analyzed, 44 (29%) showed peripheral patterns, 18 (12%) coarse speckled patterns, 39 (26%) fine speckled patterns, 42 (28%) homogeneous patterns, 5 (3%) nucleolar patterns and 2 (1.3%) fine speckled cytoplasmic patterns. In this study, the peripheral pattern was found in greater percentage, followed by homogeneous and fine speckled patterns, which are associated to patients with SLE, indicating an unfavorable prognosis for these patients.
Keywords: antinuclear antibodies, staining patterns, Hep-2 cells.
INTRODUCCION
Los anticuerpos antinucleares circulantes (ANA) son un grupo de autoanticuerpos no específicos dirigidos contra componentes del núcleo celular y por lo tanto muy útiles como marcadores, por lo que se constituye como el análisis de primera elección en el diagnóstico para una variedad de enfermedades autoinmunes y enfermedades del tejido conectivo incluyendo Lupus Eritematoso Sistémico (LES) y Síndrome de Sjogren (1).
Pueden mostrar múltiples manifestaciones en órganos, por lo que diferenciar los variados perfiles de los autoanticuerpos es esencial, ya que juegan un papel muy importante en el diagnósticode enfermedades sistémicas y órgano-específicas.
Las enfermedades asociadas con anticuerpos están directamente relacionadas con varios antígenos intrínsecos localizados en las células nucleares o citoplasmáticas.
La presencia de anticuerpos direccionados para antígenos propios es una característica de las dolencias autoinmunes ya que los autoanticuerpos son inmunoglobulinas normales, que son parte del repertorio del sistema autoinmune de personas saludables. Siendo así presentan significado patológico apenas se presente la dolencia, cuando encajan en criterios diagnósticos que utilizan parámetros, no solo laboratoriales, sino también clínicos, histológicos y radiológicos (2).
En 1957 es difundido el método de la inmunofluorescencia indirecta (IFI), que es el método de elección, para el rastreo inicial de ANAs en LES y otras enfermedades del tejido conectivo (3-4). Los substratos inicialmente utilizados fueron macerados de hígado y riñón de rata; actualmente vienen empleándose líneas celulares mantenidas en cultivo. Las células Hep-2 son células de carcinoma laríngeo humano, en estado de reposo y en varios estados de mitosis, utilizadas como sustrato para la detección de posibles autoanticuerpos presentes en el suero. La tinción fluorescente de los cromosomas en estas células mudadizas indica la presencia de anticuerpos que tienen afinidades antigénicas diversas y explican los cuatro patrones de inmunofluorescencia del núcleo.
Las ventajas de las células Hep-2 son: poseen antígenos humanos no encontrados en tejidos de roedores y en mayor concentración, los antígenos SSA/Ro (partículas de proteína RNA asociadas al núcleo), y centroméricos están presentes en grandes cantidades en este sustrato, presentan todas las fases de división celular, poseen varios nucleolos, tienen un citoplasma rico en fibrillas y organelas y permite el reconocimiento de mas de 30 patrones nucleares y citoplasmáticos (5,6).
Los resultados de FAN-Hep-2 (inmunofluorescencia con cél Hep-2) se dan de acuerdo a patrones morfológicos distintos y con cantidad de anticuerpos determinado por el título.
La técnica de IFI, mencionada más arriba, se basa en la unión de los anticuerpos antinucleares presentes en el suero del paciente, con varios sustratos celulares fijados en láminas que contienen los antígenos nucleares y citoplasmáticos. Los anticuerpos reconocen antígenos localizados en el núcleo, antígenos del citoplasma o de las membranas celulares, además de proteínas nucleares no histonas y anticuerpos órgano-específicos (3).
La sensibilidad elevada del método de ANA-IFI para el LES y para la detección de especificidades antinucleares, junto con su fácil realización y relativamente bajo costo indican que este método posee todas las características para ser empleado como prueba de inicio del diagnóstico inmunológico de las enfermedades del tejido conectivo (4).
Además del valor del título de la prueba de ANA es importante evaluar los distintos tipos de ANA. Algunos tipos se asocian con determinadas enfermedades. Hay cinco tipos básicos de ANA: moteados, homogéneos, periféricos (anillo), centroméricos y nucleolares. El modelo moteado se correlaciona con anticuerpos frente a varias fibronucleoproteínas y se observa en enfermedades mixtas del tejido conectivo (TMTC), lupus eitematoso sistémico (LES) y enfermedades del sistema periférico (ESP) (7).
Los modelos homogéneo y periférico (8), que se correlacionan con anticuerpos frente al ADN nativo (ADNn) [o ADN de doble hélice (ADNdh)], se asocian con LES; estos dos modelos pueden coexistir. El modelo centromérico es característico del síndrome CREST (calcinosis, fenómeno de Raynaud, dismotilidad esofágica, esclerodactilia y telangiectasias) (9-13). Finalmente, los anticuerpos dirigidos contra el ARN nucleolar producen un modelo nucleolar (14) y se asocian con LES y ESP.
La frecuencia del ANA sérico en la población varía en función de la edad y del sustrato antigénico usado, ya que el número de positivos aumenta con la edad (4).
Nuestro objetivo fue determinar la frecuencia de los patrones de tinción de anticuerpos antinucleares (ANA) en sueros de pacientes con sospecha clínica de enfermedad autoinmune y evaluar la utilidad de los patrones de tinción en el diagnostico.
MATERIALES Y MÉTODOS
En este estudio observacional, descriptivo de corte transverso, fueron estudiados 150 individuos de ambos sexos, con edad comprendida entre 11 y 87 años que concurrieron al Instituto de Investigaciones en Ciencias de la Salud (IICS), desde febrero a diciembre del 2008, para el análisis de anticuerpos antinucleares con sospecha clínica de enfermedad autoinmune. Se les extrajo sangre venosa, sin anticoagulante y se separó el suero, que se conservó en viales rotulados, congelándolos a -20º C hasta el momento del procesamiento.
Para la determinación de anticuerpos antinucleares, se utilizó la técnica de inmufluorescencia indirecta (IFI). Las muestras y los controles positivos y negativos diluidos, (control interno, preparado en el laboratorio de Inmunología del IICS), fueron incubados sobre láminas con células Hep-2 (antígeno para ANA), los anticuerpos antinucleares presentes se unieron al autoanticuerpos específico; la reacción se visualizó con suero anti IgG humano marcado con fluoresceína (conjugado de Sigma-USA). Se consideró como reacción positiva la presencia de fluorescencia en los núcleos o citoplasmas de las células observadas, teniendo en cuenta los diferentes patrones de tinción.
Análisis estadístico: Los datos fueron cargados en una planilla electrónica (Excel) y analizados mediante el paquete estadístico Epi Info 3.5.1 2008.
Se aplicó estadística descriptiva para el análisis de los datos.
Los resultados de la prueba, fueron entregados al médico y/o los pacientes y se mantuvo la confidencialidad de los resultados.
RESULTADOS
De los pacientes estudiados el 89,3% (134/150) fueron del sexo femenino y el 10,7% (16/150) del masculino, con edades comprendidas entre 11 y 87 años. La media de edad del sexo femenino fue de 38 años y del masculino de 46 años.
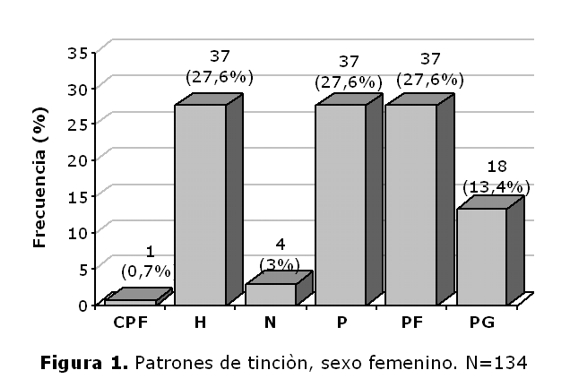
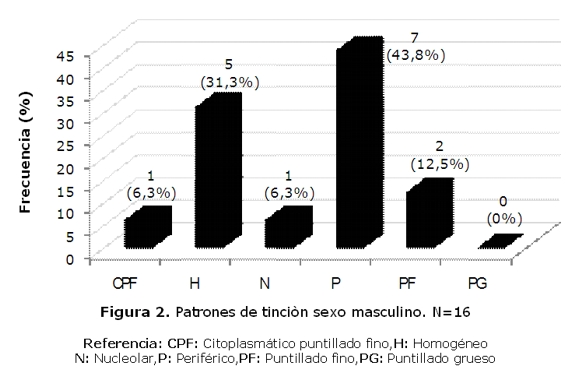
De los 150 pacientes 29,33% (44/150), presentaron patrón periférico, 12% (18/150), patrón puntillado grueso, el 26% (39/150) patrón puntillado fino, 28% (42/150) patrón homogéneo, 3,34% (5/150) patrón nucleolar y 1,33% (2/150) patrón citoplasmático puntillado fino (tabla 1). En el sexo femenino predominaron los patrones homogéneo, periférico y puntillado fino, mientras que en el masculino el periférico (figuras 1 y 2).
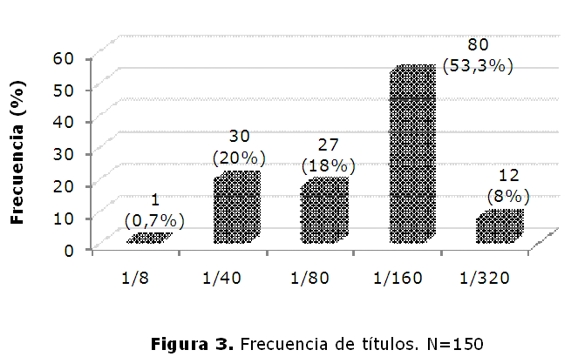
Los títulos mas elevados se observaron en el patrón periférico 32,5% (26/80) y el puntillado fino 27,5%(22/80). Los títulos mas bajos se observaron en los patrones nucleolar (3,34% 5/150) y citoplasmático puntillado fino (1,33% 2/150).
El titulo que mas predominó es de 1:160, 53,3% (80/150), que se observó con diferentes patrones (figura 3).
DISCUSION
La detección de los anticuerpos antinucleares aporta información muy valiosa para la evaluación diagnóstica de los pacientes con enfermedades autoinmunes. El conocimiento del valor predictivo de la prueba de ANA y la magnitud de su título y el tipo son fundamentales para la evaluación del resultado de esta prueba (2).
Además, algunos anticuerpos específicos se relacionan con algunas enfermedades y la presencia de estos anticuerpos tiene consecuencias muy importantes en múltiples órganos (8).
El título de una prueba positiva de ANA es importante para el diagnóstico. Un título bajo tiene menos importancia que un título alto. Los individuos sanos tienen títulos negativos o bajos. Los pacientes que generalmente tienen títulos elevados, son los casos sistémicos. Pueden observarse títulos intermedios o altos en familiares no afectados, de individuos con enfermedades autoinmunes, en personas mayores (11,12), en mujeres gestantes (13), en pacientes con infecciones crónicas (14,15), en pacientes con neoplasias (14,15) y en individuos sanos (11,16). Las frecuencias de individuos sanos con títulos de ANA 1:80, 1:160 y 1:320 son del 13, 5 y 3%, respectivamente. Los títulos tienen que ver con la actividad y el tipo de enfermedad, no con el sustrato utilizado, y la interpretación depende de la clínica y del patrón de tinción. Por lo tanto, un título > 1:160 es significativo para el diagnóstico de pacientes con dichas enfermedades (8).
La diversidad de los patrones morfológicos de los autoanticuepos depende de las manifestaciones clínicas de las diferentes enfermedades autoinmunes, del estado del paciente y por ende, la cantidad de anticuerpos ANA-IFI, han demostrado la variedad esperada de patrones de fluorescencia. En cuanto a la frecuencia de los mismos, se encontró que en los hombres predominaba el patrón periférico, asociado fuertemente a LES, mientras que en las mujeres se distribuyeron en forma equitativa entre el periférico, el homogéneo y el puntillado fino lo cual indicaría mas diversidad en las patologías como se indica en la tabla 1. El 53.3% de los pacientes presentaron títulos de 1:160, lo cual puede servir como marcador inicial para el seguimiento y monitoreo de la concentración de anticuerpos, ya que el aumento de los títulos se asocia con un aumento de la actividad de la enfermedad generalmente(14).
Nuestros resultados enfatizan y confirman la importancia de la investigación clínica dirigida a alcanzar la utilización más apropiada de las determinaciones laboratoriales de anticuerpos antinucleares los diferentes patrones y sus frecuencias para diagnosticar y pronosticar las enfermedades autoinmunes.
REFERENCIAS BIBLIOGRÁFICAS
1.Phan TG, Ng WW, Bird D, Smithers K, Wong V, Gallagher K, et a. High-Quality, Cost Effective Strategy for detección of Autoantibodies to extractable Nuclear Antigens. Clin Diag Lab Immunol 2001; 8 (3) 471-74. [ Links ]
2. Kern P, Kron M, Huesche R. Measurement of Antinuclear Antibodies: Assesment of different test Systems. Microbiology Jan 2000; vol 7 nº 1: p. 72-8. [ Links ]
3.Damoiseaux JG, Tervaert JW . From ANA to ENA: How to proceed?. Autoinmun Rev 2006; 5 (1): 10-7. [ Links ]
4.James K, Carpenter AB, Cook L, Marchand R, Nakamura RM. Development of the Antinuclear and Anticytoplasmic Antibody Consensus Panel by the Association of Medical Laboratory Inmunologists. Clin Diagn Lab Immunol. 2000 May;7(3):436-43. [ Links ]
5.Nesher G, Margalit R, Ashkenazi YJ. Antinuclear Envelope Antibodies: Clinical Associations. Semin Arthritis Rheum. 2001 Apr;30(5):313-20 [ Links ]
6.Gniewek RA, Stites DP, McHugh TM, Hilton JF, Nakagawa M. Comparision of Antinuclear Antibody Testing Methods; Inmunofluorescence Assay versus enzymeinmunoassay. Clinical and Diagnostic Laboratory Inmunology Mar 1997; 4(2): 185-88. [ Links ]
7.Kiuttu J, Hartikainen AL, Makitalo R, Ruuska P. The outcome of pregnancy in antinuclear antibody-positive women. Gynecol Obstet Invest 1994; 37: 160-63. [ Links ]
8.Sontheimer RD, McCauliffe DP, Zappi E, Targoff I. Antinuclear antibodies: clinical correlations and biologic significance. Adv Dermatol 1991; 7: 3. [ Links ]
9.Fernández-Madrid F, Mattioli M. Antinuclear antibodies (ANA): immunologic and clinical significance. Semin ArthrRheum 1976; VI: 83-124. [ Links ]
10.Tan EM, Feltkamp TEW, Smolen JS, Butcher B, Dawkins R, Fritzler MJ et al. Range of antinuclear antibodies in healthy individuals. Arthritis Rheum. 1997; 40:1601-11 [ Links ]
11.Bernstein RM, Steigerwald JC, Tan EM. Association of antinuclear and antinuclear antibodies in progressive systemic sclerosis. Clin Exp Immunol 1982; 48: 43-51. [ Links ]
12.Hahn BH. Antibodies to DNA. N Engl J Med 1998; 338: 1359-68. [ Links ]
13.Suarez-Almazor ME, Gonzalez-Lopez L, Gamez-Nava JI, Belseck E, Kendall CJ, Davis P. Utilization and predictive value of laboratory tests in patients referred to rheumatologists by primary care physicians. J Rheumatol. 1998;25:1980- 5. [ Links ]
14.Ulvestad E, Kanestrom A, Madland TM, Thomassen E, Haga HJ, Vollset SE. Evaluation of diagnostic test for antinuclear antibodies in rheumatological practice. Scand J Inmunol 52(3):309-5. [ Links ]
15.Nishioka M, Morshed SA, Parveen S, Ming C. Heterogenity of antinuclear antibodies in autoimune liver diseases. In: Krawitt EI, Wiesner RH, Nishioka M, editores. Autoimune liver diseases, 2nd edition. Amsterdam:ELSEVIER;1998.p .179-209 [ Links ]
16.Bizzaro N, Tozzoli R, Tonutti E, Piazza A, Manoni F, Ghirandello A et al. Variability between methods to determine ANA, anti-dsDNA and anti-ENA autoantibodies: a collaborative study with the biomedical industry. J Inmunol Methods 1998; 219(1-2): 99-107. [ Links ]
*Autor Correspondiente:Dra María Mercedes Carpinelli. Dpto. de Inmunología
Instituto de Investigaciones en Ciencias de la Salud. Río de la Plata y Lagerenza. Asunción-Paraguay
Email: ihumoral@iics.una.py.Fecha de recepción: Octubre de 2010, Fecha de aceptación: Noviembre de 2010