Serviços Personalizados
Journal
Artigo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares em
SciELO
Similares em
SciELO
Compartilhar
Memorias del Instituto de Investigaciones en Ciencias de la Salud
versão On-line ISSN 1812-9528
Mem. Inst. Investig. Cienc. Salud v.7 n.2 Asunción dez. 2009
ARTICULO ORIGINAL
La reactogenicidad y los aspectos inmune específicos de la vacuna pentavalente combinada: DTPw-HepB-Hib en el lactante menor de un año en el Hospital Distrital de Lambaré, Paraguay en 2007-2008
The reactogenicity and specific immune aspects of the combined pentavalent vaccine: DTPw-HepB-Hib in breastfed babies under one year of age that attended the District Hospital of Lambaré, Paraguay in 2007 and 2008
*Achucarro CI-II, Carpinelli MMI Chirife SIII, Rodas JI, Arbo AII, Garcete LII, Chirico MII, Cabral MI, Alborno RMI, Balmaceda MAI, Montero VIII, Romero RIII, Leguizamón MAI
IInstituto de Investigaciones en Ciencias de la Salud, Universidad Nacional de Asunción (UNA). Paraguay
II Facultad de Ciencias Médicas, Universidad Nacional de Asunción (UNA).Paraguay
III Hospital Distrital Lambaré, Ministerio de Salud Pública y Bienestar Social. Paraguay
RESUMEN
La vacunación rutinaria de difteria, pertussis y tétanos a células enteras (DPTw) está presente desde 1940 y con elevadas coberturas en muchos países del mundo. La Organización Mundial de la Salud ha aprobado el uso universal de la vacuna anti-hepatitis B (HB) y combinaciones con DPT, en los últimos años ha sido incorporada la vacuna anti-Haemophilus influenzae tipo b (Hib) en programas de vacunación del niño. Es aplicada en Paraguay desde el 2002 a través del Programa Ampliado de Inmunizaciones del Ministerio de Salud Pública y Bienestar Social. Determinamos la reactoinmunogenicidad secundaria a la vacunación primaria pentavalente combinada en infantes concurrentes al Hospital Distrital de Lambaré–Paraguay en los años 2007-2008. Estudio longitudinal, observacional prospectivo de los efectos secundarios y los aspectos inmune- específicos de la vacuna Berna DTPw-HepB-Hib (QUINVAXEMTM) en lactantes menores de un año, a los 2 meses de edad, datos basales y post vacunales (1 mes luego de 3ª dosis). Efectos locales: 30(75%); rubor 17 (42.5%); tumefacción (menos 20 mm); 13 (32.5%); calor local 11 (27.5%). Efectos generales: fiebre: 37 (92.5%) llanto fuerte y persistente: 32(80%); irritabilidad: 23 (57.5%); hiporreactividad 16 (40%), anorexia 8 (20%); Inmunogenicidad: antes de la 1ª dosis; antitetánica IgG (+) 38/40 (95%), anti-difteria (+) IgG 29/40 (72.5%); anti-HBsAg 0/40 (0%) negativos. Respuesta post-vacuna penta comb. (7m. edad): antitetánica IgG 14/14 (100%) (+); anti-difteria IgG 12/14 (83%) (+); anti-HBsAg 14/14 (100%) positivos. Se evidencia la reactogenicidad de grado variable y decreciente. Niveles de anticuerpos de los componentes DT, satisfactorios y la Hep B excelentes.
Palabras claves:lactantes, vacunación pentavalente combinada, reactogenicidad, inmunogenicidad.
ABSTRACT
The combined cellular pentavalent vaccine is one the greatest achievements of human kind in the 20th century and is still successful in the 21st century. It is made up of five components and protects against the following diseases: diphtheria, tetanus, pertussis, hepatitis B and Haemophilus influenzae type b. The vaccine provides specific active immunization against infections caused by Corynebacterium diphtheriae, Clostridium tetani, Bordetella pertussis, Haemophilus influenzae type B and the Hepatitis B virus in children from six weeks of age. In Paraguay, it has been used since 2002 through the Widened Program of Immunization (PAI in Spanish) of the Ministry of Public Health. The objective of this work was to determine the secondary reactoinmunogenicity to the primary combined pentavalent vaccination in children attending the District Hospital of Lambaré, Paraguay in 2007 and 2008. This is a longitudinal, prospective observational study to evaluate the secondary effects and immune-specific aspects of the Berna DTPw-HepB-Hib combined pentavalent vaccine (QUINVAXEMTM) applied to breastfed babies under one year old, of both sexes, all races, origins and nutrition statuses in the Hospital of Lambaré. The vaccination was free, according to PAI's guidelines and by consecutive sampling previous written consent of the parents, at 2 months of age. Data were collected at baseline an post-vaccination after one month and a third dose. In a total population of 40 breastfed babies, good nutrition was found in 36 (90%). Local effects were seen in 30 (75%) distributed as follows: blush in 17 (42.5%), tumefaction (less than 20 mm) in 13 (32.5%) and local heat in 11 (27.5%). General effects were distributed as follows: fever in 37 (92.5%), loud and persistent cry in 32 (80%), irritability in 23 (57.5%), hyporeactivity in 16 (40%), anorexia in 8 (20%), hypotonicity and allergy, 2 each (5%), convulsions and paralysis in none. The effects are an average after the three doses with a decreasing trend at the end. The immunogenicity basal data before the 1st dose were as follows: antitetanic IgG (+) 38/40 (95%), antidiphtheria IgG (+) 29/40 (72.5%) and anti HBs Ag (-) 0/40 (0%). Post - vaccination responses (at 7 months old) were as follows: antitetanic IgG (+) 14/14 (100%), antidiphtheria IgG (+) 12/14 (83%) and anti HBs Ag (+) 14/14 (100%). These results show a reactogenicity of variable and decreasing degree. The antibodies levels of the DT components were satisfactory and those of Hep B excellent.
Keywords:Breastfed babies, combined pentavalent vaccination, reactogenicity, immunogenicity.
INTRODUCCIÓN
La vacuna pentavalente combinada (DTPw-HepB-Hib) está constituida por varios componentes: Vacuna DPT (antidiftérica–antipertussis–antitetánica); La Hep B (antihepatitis B) y la Hib (antihemophillus influenzae tipo b); protege contra cinco enfermedades: Difteria, Pertussis, Tétanos, Hepatitis B y Haemophillus Influenzae tipo b. Su uso está indicado desde las seis semanas de edad (1 y 1/2 mes de edad) hasta los seis años de edad. No se la debe usar en recién nacidos y en mayores de seis años (1).
La combinación de vacunas, protege contra muchas enfermedades o subtipos de las mismas simultáneamente. Su apropiado uso facilitó la erradicación de enfermedades mortales como la viruela y la poliomielitis así como la prevención de millones de muertes (1-3) anuales en el mundo como el sarampión, difteria, pertussis, hepatitis A y B, Hib, entre otros (1-3).
Varias asociaciones vacunales fueron probadas con éxito con el objeto de integrar la vacuna antiHib en los programas nacionales a un costo menor (2) como la vacuna Hib + DPT + Hep B o vacuna pentavalente aplicada actualmente en el Paraguay.
En recientes estudios, los familiares, médicos pediatras y/o de familia expresan que aumentaron los efectos secundarios, disminuyeron el número de las inyecciones/ pero, se necesita información adicional sobre la seguridad de las vacunas asociadas o combinadas (4,5).
Los factores que influyen sobre la reactogenicidad son: la dosis, el individuo, la población, grupo étnico, lactancia materna y otros (6).
Numerosos estudios han demostrado que los eventos adversos son los mismos en las vacunas combinadas como en las separadas, generalmente estos efectos reflejan el perfil de seguridad de los componentes reactivos, ejemplo: fiebre y rash en la vacuna antisarampionosa y la artralgia en la vacuna combinada de la rubéola (7).
No obstante, debemos enfatizar que la Food and Drug Administration (FDA) de los Estados Unidos, requiere testificaciones rigurosas a fin de concluir sobre la seguridad y eficacia de las vacunas y en beneficio de las vacunas combinadas con pocas inyecciones a fin de prevenir un gran número de enfermedades graves (8).
Meyerhoff presenta los resultados del método WTP (willigness to pay) utilizado para estimar el precio intangible del dolor y distress emocional en los padres y los pacientes a fin de reducirlos (8). La base de datos para notificación de las reacciones adversas a las vacunas (RAV) ayudó a comparar en forma sencilla los sistemas de vigilancia de las vacunas combinadas en los países participantes de Europa con la conclusión de que los problemas identificados pueden mejorarse y resolverse con la normalización e intensificación de la colaboración entre los países a nivel internacional y en el nivel nacional (9).
La disminución del costo de los programas de inmunizaciones con vacunas combinadas es necesario a fin de reducir el número de inyecciones y aumentar la cobertura con un esquema aceptable disminuyendo el síndrome del Acerico, o almohadilla (10-15).
La vacunación de la niñez es uno de los mayores eventos en la Salud Pública y la Pediatría que tiene por fin proteger a los niños/as e interrumpir la transmisión de la enfermedad (16-18).
Los programas de vacunación deben abarcar la cobertura requerida para bloquear la diseminación de las enfermedades en especial las más graves, como las producidas por el Hib. Los resultados de un programa de vacunación son medidos y/o evaluados a través del monitoreo de la prevalencia de la enfermedad, la cobertura de la vacunación regular, continua y si es posible con el dosaje de los anticuerpos.
El Programa Ampliado de Inmunizaciones (PAI) se crea en 1977 en casi todos los países de las Américas impulsado por la OPS/OMS con el objetivo de disminuir la morbi-mortalidad de las enfermedades prevenibles por vacunas como la poliomielitis, tétanos, tos ferina , difteria y sarampión y formas graves de la tuberculosis (16-18).
La vacunación y la vigilancia epidemiológica constituyen las estrategias fundamentales del Programa. El fortalecimiento de los Programas Nacionales se logró con el desarrollo de metodologías para evaluaciones y la OPS/OMS desarrolló con dicho fin para mejorar el proceso de tomas de decisiones (18,19).
La OPS/OMS desde 1996 retomó las evaluaciones internacionales para garantizar la sostenibilidad de los logros del PAI, identificar fortalezas y debilidades, enfrentar nuevos retos, así como adaptarse a las demandas de nuevas vacunas en el futuro (19). La primera evaluación internacional se realizó en nuestro país del 23 de noviembre al 3 de diciembre de 1999, promovida por la OPS/OMS (19).
La vacunación en todo el país se implementa según el carnet de vacunación nacional del MSP y BS con la Dirección del Programa Nacional de Salud y el PAI (16-18).
Desde el año 2.000 el MSP y BS implementó en nuestro país el esquema de vacunación con la pentavalente que incluye la DTPw/HepB y Hib.
Según datos de OPS/OMS sobre inmunización de las Américas (17), el porcentaje de cobertura en los menores de 1 año para la DPT-3, Hib-3, Hep B-3 y para los 1 año de edad el nivel es de alrededor de 75% para nuestro país en contraste con los datos de Argentina, Brasil, Chile y Uruguay cuyo porcentaje de cobertura oscila entre 95 a 99%. Los casos confirmados de meningitis por Hib son de 10 casos para el año 2004 y de 25 casos para el año 2006. Todo esto nos indica la cobertura limitada de la vacunación pentavalente para la niñez de nuestro país en el contexto del MERCOSUR (19).
La protección conferida por las vacunas combinadas como la vacuna pentavalente (DTPw + HepB+Hib) es un evento muy importante porque interrumpe la transmisión y controla las enfermedades prevenibles como difteria, tétanos, pertussis, hepatitis B y Haemophilus influenzae tipo b.
La mayoría de nuestros niños (50-60%) son desnutridos o con riesgo de desnutrición (20-30%); en ellos la respuesta inmunológica y la reactogenicidad son variables; por este motivo debemos probar a fin de confiar en la vacuna (20). Es necesario medir y determinar algunos aspectos importantes como la cobertura, la reactogenicidad e inmunogenicidad de la vacuna pentavalente con énfasis la anti-Hib (21).
La introducción y generalización del uso de las vacunas combinadas como la pentavalente (Pentaciq:DPT+HepB+Hib) y otras son responsables del hecho significativo de disminución de las graves enfermedades como el tétanos, la difteria, la pertussis, la hepatitis B y las por Haemophilus influenzae tipo b.
En el Paraguay, Arbo y Basualdo refieren que en un estudio de cinco años (1991-1995) realizado en el Instituto de Medicina Tropical la infección meníngea se diagnosticó en el 80% y la mortalidad fue de 13%, con mayor frecuencia en los menores de 12 meses. Si sobreviven a la meningitis quedan con déficits neurológicos tales como retardo mental y pérdida auditiva; hidrocefalia por Hib (21). A fin de prevenir las reemergencias desalentadoras en ciertas oportunidades y que tenemos la obligación de revertirlas, se estudió la reactogenicidad la inmunogenicidad secundarias a la vacunación primaria pentavalente combinada en lactantes concurrentes al Hospital Distrital de Lambaré durante los años 2007-2008.
MATERIALES Y METODOS
Estudio observacional, longitudinal y prospectivo niños/as menores de 24 meses de edad, ambos sexos, y cualquier estado de nutrición y raza, procedentes de todo el país, quienes consultaron y recibieron las 3 dosis primarias de la vacuna pentavalente en el Hospital Distrital de Lambaré en los años 2007-2008.
Se excluyeron a niños/as con: prematurez, enfermedad aguda; moderada o severa, con inmunodeficiencias o con tratamiento inmunosupresor, desordenes neurológicos: convulsiones, hipotonía e hipertonía, llanto persistente, con reacciones de hipersensibilidad o alérgicos, fiebre (40° o más) en el momento del estudio, cuyos padres o familiares no permiten el estudio o no concurrieron a los controles posteriores. Fueron seleccionados en forma consecutiva aquellos que reunieron los criterios de inclusión y concurrieron al Hospital Distrital Lambaré para vacunación y citados a los 1 mes de la 3ra dosis. Los niños/as lactantes con 3 dosis de vacuna pentavalente (2-4-6 meses); cada dos meses de edad y un mes luego de la 3ra dosis (7 meses de edad). A todos se les extrajo 2 ml de sangre para estudio serológico.
Las vacunas aplicadas fueron DTPw-HB/Hib pentavalente (QUINVAXEMTM) desarrolladas y manufacturadas por Berna Biotech.
ANALISIS DE INMUNOGENICIDAD
Obtención de la muestra: los sueros fueron almacenados a -20 °C, por el Método de ELISA para hepatitis, difteria, inmunoglobulina y anti HBs Ag.
TÉTANOS
Determinación de anticuerpos IgG Elisa indirecto. Se midió el nivel sérico de IgG con un kit comercial (ORGENICS ISRAEL). El kit contenía 1 control positivo, 1 cut off control, 1 control negativo, 6 calibradores, microplacas con antígeno tetánico purificado.Las muestras, los controles y los calibradores fueron incubados en las placas para permitir que los anticuerpos específicos presentes en las muestras, reaccionen con el antígeno.
Una anti- IgG humana conjugada con peroxidasa se agregó y reaccionó con la IgG specífica. Se agregó el sustrato enzimático y el cromógeno y se dejó que el color se desarrolle. Luego de añadir el reactivo de paro, el cambio de color se cuantificó por lectura de densidad óptica a 450 nm.
DIFTERIA
Determinación de anticuerpos IgG Elisa indirecto: Se midió el nivel sérico de IgG con un kit comercial (ADALTIS EIAgen, Italia). El kit contenía 4 calibradores, microplacas cubiertas con C. Diphtheriae, toxinas. Las muestras y los calibradores fueron incubados en los pocillos para permitir que los anticuerpos específicos presentes en las muestras reaccionen con el antígeno (toxinas). Una anti IgG humana conjugada con HRP en buffer se agregó y reaccionó con la IgG específica. Se agregó el sustrato enzimático y el cromógeno y se dejó que el color se desarrolle. Luego de añadir el reactivo de paro el cambio de color se cuantificó por lectura de densidad óptica a 450 nm.
HEPATITIS B (HBsAb)
Determinación de anticuerpos totales. Elisa indirecto.
Se midió el nivel sérico de anticuerpos totales con un kit comercial (orgenics-Israel). El Kit contenía 5 calibradores, a suero control, microplasas cubiertas con HBsAg, inactivados por calor, de los 2 subtipos (ad y ay) de humanos.
Las muestras diluidas, los calibradores y el control fueron incubados en las placas para permitir que los anticuerpos presentes en las muestras reaccionen con el antígeno.
Un conjugado enzimático con HBSAg purificado para los 2 subtipos y marcado con HRP, 5% BSA 10nM tris buffer, sulfato de gentamicina y 0.1% kathon GC como preservante se agregó y reaccionó con los anticuerpos específicos.
Se agregó el sustrato enzimático y el cromógeno y se dejó que el color se desarrolle. Luego de añadir el reactivo de paso, el cambio de color se cuantifico por lectura de densidad óptica, a 450 nm.
Vacunas y vacunación
Se utilizó la vacuna líquida pentavalente combinada (QUINVAXEMTM) de Berna: DTPw-Hib-HepB conteniendo: toxoide diftérico – toxoide tetánico-suspensión celular inactivada de Bordetella pertussis– Hib PRP oligosacárico conjugado– HepBAgS.
Según normas del PAI del MSP y BS, cada dosis de vacuna fue inyectada en el cuadrante supero externo del muslo con jeringa y agujas estériles desechables. Se administró la vacuna Sabin oral (OPV) el mismo día.
Los lactantes fueron observados en el lugar de vacunación hasta 30 minutos después, detectándose algunas reacciones inmediatas. Los padres continuaron la observación los 3 días posteriores con la indicación de contactar con el Hospital Distrital de Lambaré ante la aparición o persistencia de los síntomas y/o signos locales y/o generales.
Luego de las tres dosis fueron entrevistados por la enfermera, quien llenó y controló los formularios que fueron entregados el primer día a las madres.
ASUNTOS ESTADÍSTICOS Y ANÁLISIS DE LOS DATOS
Los datos recolectados fueron cargados en planillas electrónicas y procesadas por el programa EPI-INFO 2002. Se aplico estadística descriptiva, presentándose frecuencias relativas, tablas y gráficos de barras
CONTROL DE CALIDAD Y PRETEST: Se realizó con 10 niños a fin de realizar los ajustes necesarios de la investigación.
Asuntos éticos: El protocolo fue aprobado por el Comité de Ética del IICS. Se contó con los consentimientos informados de los padres, tutores u otro familiar de los niños/as incluidos en el estudio. El estudio fue gratuito para los niños/as y familiares, con el beneficio de las vacunaciones a fin de evitar enfermedades prevenibles por este medio. Además se guardó el secreto médico con el cuidado del anonimato del niño y su familia con el respeto que se merecen. Todos los datos fueron manejados en forma confidencial por los autores.
RESULTADOS
De los 40 pacientes lactantes estudiados, 24 fueron del sexo femenino 24/40 (60%) y 16 (40%) del sexo masculino. Edad promedio 2 m 3 días. Todos de raza blanca; 90% con buen estado nutricional; procedente del área de influencia del Hospital Distrital de Lambaré en la 1ra. y 2da. Fases de estudio. Tabla 1.
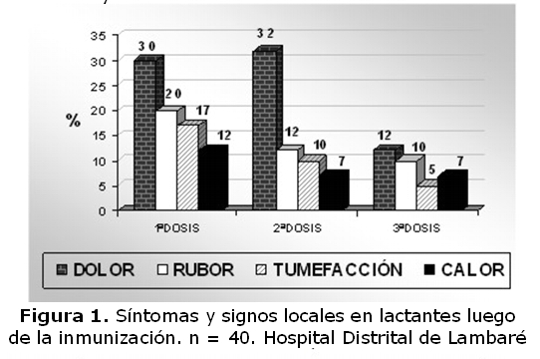
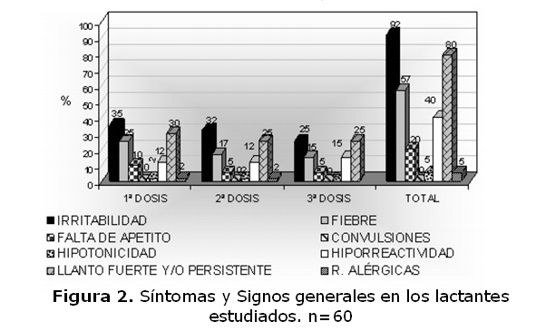
En cuanto a la reactogenicidad, no se presentó ninguna reacción inmediata a la vacuna pentavalente excepto el dolor en el 40% de los casos. Durante los tres días posteriores a la vacunación, el 40% de los lactantes presentó síntomas locales y 60% algún síntoma y signo general como irritabilidad, falta de apetito, hipotonicidad, llanto fuerte y persistente y fiebre.
La frecuencia y severidad de cada síntoma y signo local y general se presentan en las figuras 1 y 2. Los eventos disminuyeron y desaparecieron totalmente en 24 a 8 hs. luego de cada dosis. No se registró ningún evento adverso grave en ninguno de los tres grupos del estudio luego de 1ª - 2ª y 3ª dosis.
Inmunogenicidad
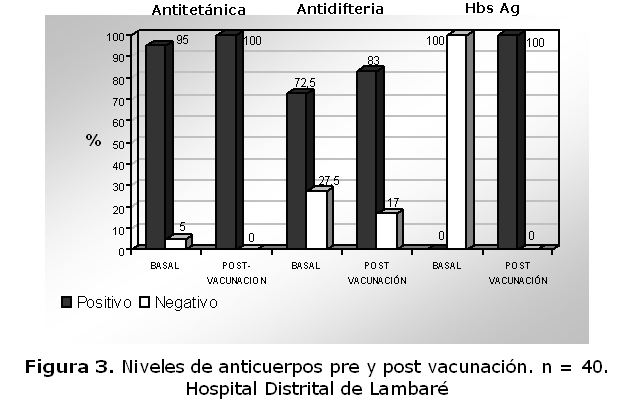
Anticuerpos antidiftéricos: en cuanto a la inmunogenicidad (figura 3), los anticuerpos antidiftéricos se presentaron en el 28% de los lactantes, previa a la vacunación pentavalente. Siete meses después, post vacuna o sea, luego de las tres dosis (2-4-6 m y 1 mes después de la 3ª dosis) de la pentavalente, 83% de los lactantes tenían títulos protectores.
Anticuerpos antitetánicos: el 95% de los lactantes presentaron anticuerpos previos a la vacunación. Siete meses después (1 mes luego de 3ª dosis), 100% de los lactantes tuvieron niveles protectores.
Anticuerpos antihepatitis B: Ninguno de los lactantes, presentó anticuerpos anti hepatitis B previos a la vacunación. Siete meses después (1 mes luego de la 3ª dosis): Se observó un repunte evidente, 100% de los lactantes presentó niveles protectores óptimos, (figura 3).
DISCUSIÓN
Los resultados muestran la formulación de la vacuna pentavalente combinada (QUINVAXEMTM) con sus cinco componentes: antitetánica-antidiftérica–antipertussis W anti-Hep B y anti Hib) de los cuales se estudió las antitetánica – antidiftérica y la anti Hep B que presentan un adecuado perfil de seguridad y una buena respuesta de anticuerpos a los tres constituyentes de la vacuna.
La evaluación de los anticuerpos pre-vacuna destaca que los lactantes tenían anticuerpos antitetánicos, 95%; antidiftérica, 73% y antihepatitis B 0%.
La vacunación pentavalente combinada en los tres grupos de anticuerpos estudiados post vacuna muestra una excelente respuesta inmune en todos los lactantes, lográndose una seropositividad del 100% para la antitetánica y anti HBs Ag y un importante aumento de anticuerpos para la antidiftérica (83%).
Los niveles de anticuerpos evaluados: antidiftérica, antitétanos y antihepatitis B son considerados indicadores de protección contra las enfermedades citadas; al comparar los anticuerpos del antes y 1 mes después de la 3ª dosis de la vacunación se observaron aumentos en los grupos de lactantes vacunados; comparable con los datos de Trenaghi y col. (19) quienes hallaron: anticuerpos antitetánicos 95% basal; 100% post dosis 3. Anticuerpos antidiftéricos 48 % basal y 98.8% post dosis 3 y anticuerpos anti-HBs 5.4% basal y 99% post dosis 3.
La vacuna pentavalente combinada es altamente inmunogénica para los toxoides tetánico y diftérico con serorespuesta del 100% con aumento de los títulos de anticuerpos (pre y postvacuna). El incremento observado de los anticuerpos de los lactantes inicialmente seropositivos son similares a los observados en otros estudios y sugiere una respuesta positiva tipo Booster (1,19) en los países de Costa Rica, Argentina, Colombia, República Dominicana y Nicaragua.
Los resultados de nuestro estudio evidencian la reactogenicidad de la vacuna pentavalente combinada de grado variable pero leve en sus expresiones clínicas locales y/o sistémicas con tratamiento ambulatorio, sin internación ni secuelas.
Los niveles de anticuerpos de los componentes antitetánica, antidiftérica y antihepatitis B de la vacuna pentavalente combinada: tétanos-Hep B fueron excelentes; pero para la antidifteria no se obtuvo el resultado óptimo esperado luego de completar las tres dosis primarias, lo que preocupa por los brotes ocurridos en años anteriores en nuestro país. Necesitamos fortalecer la vacunación primaria con los aumentos de cobertura y las dosis de refuerzos además asegurar el uso de vacunas de alta calidad con prácticas efectivas para mejorar la confianza de los beneficiarios con un futuro venturoso en la lucha contra las enfermedades que previenen.
En base a los resultados obtenidos en este trabajo, se recomienda que:
- La vacuna pentavalente combinada, evaluada en este estudio es conveniente considerar su uso programático o mediante campañas de vacunación a los lactantes antes de cumplir los dos años de edad con el refuerzo o la 4ª dosis.
- Completar la inmunización en la etapa de enseñanza escolar básica primaria es factible en nuestro país, al considerar los índices de escolaridad alcanzados en los últimos años según el Ministerio de Educación y Cultura.
- Otras estrategias útiles serian la vacunación del personal del área de salud por su mayor riesgo de infección y diseminación, así como potenciar las campañas de vacunación de las mujeres en edad fértil para prevenir las enfermedades en los lactantes pequeños.
- Las campañas de vacunación en adultos realizadas en nuestro país indican la posibilidad de avanzar en la prevención de enfermedades infecciosas, gracias a la planificación de programas en grupos etéreos no tradicionales como son los escolares mayores, adolescentes, adultos jóvenes y los adultos mayores.
BIBLIOGRAFÍA
1. Faingezicht I, Avila-Aguerro ML, Cervantes Y, Fourneau M, Costa JA. Primary and booster vaccination with DTPw-HB/Hib pentavalent vaccine in Costa Rican children who had received a birth dose of hepatitis B vaccine. Rev Panam Salud Pública/Pan Am J Public Health 2002; 12(4): 247-57. [ Links ]
2. Campbell JD, Lagos R, Levin MM, Losonsky GA. Standard and alternative regimens of Haemophilus influenzae type b conjugate vaccine (polyribosylribitol phosphate-tetanus toxoid conjugate vaccine) elicit comparable antibody avidities in infants. Pediatr Infect Dis J 2002; 21: 822-6. [ Links ]
3. Rennels M. Combination vaccines. Pediatr Infect Dis J 2002: 21: 255-6. [ Links ]
4. Madhi SA, Petersen K, Khoosal M, Huebner R, Mbelle N, Mothupi R. et al. Reduced effectiveness of Haemophilus influenzae type b conjugate vaccine in children with a high prevalence of human immunodeficiency virus type 1 infection. Pediatr Infect Dis J 2002; 21: 315-21. [ Links ]
5. Nicol M, Huebner R, Mothupi R, Kayhty H, Mbelle N, Khomo E. Haemophilus influenzae type b conjugate vaccine diluted tenfold in diphtheria-tetanus-whole cell pertussis vaccine: a randomized trial. Pediatr Infect Dis J 2002; 21: 138-41. [ Links ]
6. Greenberg DP, Wong V, Partridge S, Howe B, Ward J. Safety and immunogenicity of a combination diphtheria-tetanus toxoids-acellular pertussis-hepatitis B vaccine administered at two, four and six months of age compared with monovalent hepatitis B vaccine administered at birth, one month and six months of age. Pediatr Infect Dis J 2002; 21(8): 769-76. [ Links ]
7. Jackson LA, Carste B, Malais D, Froeschle J. Retrospective population-based assessment of medically attended injection site reactions, seizures, allergic responses and febrile episodes after acellular pertussis vaccine combined with diphtheria and tetanus toxoids. Pediatr Infect Dis J, 2002; 21: 781-5. [ Links ]
8. Halsey NA. Safety of combination vaccines: perception versus reality. Pediatr Infect Dis J 2001; 20: S40-4. [ Links ]
9. Yeh SH, Ward J. Strategies for development of combination vaccines. Pediatr Infect Dis J 2001; 20:S5-9. [ Links ]
10. Hinman AR. Perspectives on the state of combination vaccines: summary of the rapporteur for the international symposium on combination vaccines. CID 2001: 33(suppl.4) S372-5. [ Links ]
11. Taranger J, Trolifors B, Bergfors E, Knutsson N, Sundh V, Largergar DT. et al. Mass vaccination of children with pertussis toxoid-decreased incidence in both vaccinated and nonvaccinated persons. CID 2001; 33(7): 1004-10. [ Links ]
12. Decker MD. Principles of pediatric combination vaccines and practical issues related to use in clinical practice. Pediatr Infect Dis J 2001; 20: S10-18. [ Links ]
13. Glode M. Combination vaccines: practical considerations for public health and private practice. Pediatr Infect Dis J 2001; 20: S19-22. [ Links ]
14. Madore D. Characterization of immune response as an indicator of Haemophilus influenzae type b vaccine efficacy. Pediatr Infect Dis J 1998; 17: S207-10. [ Links ]
15. Department of Vaccines and Biologicals. Vaccines & Biologicals. Annual Report 2000. Geneva: WHO. 2001. [ Links ]
16. Organización Panamericana de la Salud. Evaluación Internacional del Programa ampliado de inmunizaciones en Paraguay. Asunción Paraguay: MSP y BS – OPS/OMS. 1999. [ Links ]
17. Department of Immunization, Vaccines and Biologicals. Inmunization in practice, a practical guide for health staff. Geneva 27, Switzerland: WHO-UNF. 2004. [ Links ]
18. Calvo N, Morice A, Saenz E, Navas L. Uso de encuestas en escolares para la evaluación de la cobertura y oportunidad de la vacunación en Costa Rica. Rev Panam Salud Pública 2004;16(2), 118-24. [ Links ]
19. Trenaghi M, López P, Rocha C, Rivera L, David MP, Ruttimann R, et al. A news DTPw-HB/Hib combination vaccine for primary and booster vaccination of infants in Latin America. Rev Panam Salud Pública 2006:19(3):179-88. [ Links ]
20. Delgado Rubio A. Implementación de la vacuna hexavalente en calendario vacunal. An Pediatría 2003; 58(5): 56-62. [ Links ]
21. Arbo A, Basualdo W. Características de la infección invasora por Haemophilus influenzae tipo b en Paraguay. Rev Panam Salud Pública 2004; 16(1): 64-5. [ Links ]
*Autor Correspondiente:Dra. Carmen Achucarro
Instituto de Investigaciones en Ciencias de la Salud. Río de la Plata y Lagerenza. Asunción-Paraguay
Email: editorial@iics.una.py