Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO
Related links
-
 Similars in
SciELO
Similars in
SciELO
Share
Memorias del Instituto de Investigaciones en Ciencias de la Salud
On-line version ISSN 1812-9528
Mem. Inst. Investig. Cienc. Salud vol.7 no.1 Asunción June 2009
ESPECIFICACIONES TECNICAS
Mantenimiento y titulación del virus de dengue para obtención de antígeno viral
Maintenance and titration of dengue virus for the obtainment of viral antigens
*Roig CI, Aquino VII, Guillén II, Rojas AI, Picaguá EIII, Acosta MEI, Aria LI, Meza TI, Nara EIV
IDepartamento de Producción Bioquímica, Instituto de Investigaciones en Ciencias de la Salud,
IICentro de Pesquisa en Virología, Facultad de Ciencias Farmacéuticas, Universidad de San Pablo. Brasil
IIIDepartamento de Inmunología, Instituto de Investigaciones en Ciencias de la Salud. Universidad Nacional de Asunción (UNA). Paraguay
IVDepartamento de Biología Molecular, Instituto de Investigaciones en Ciencias de la Salud Universidad Nacional de Asunción (UNA). Paraguay
RESUMEN
El dengue es un grave problema de salud pública que no posee vacuna ni tratamiento específico. El método de diagnóstico más utilizado es el serológico, específicamente, la detección de anticuerpos IgM anti-dengue. Los antígenos virales utilizados en este método pueden ser preparados en cultivo de células de Aedes albopictus (C6/36). El objetivo de este trabajo fue el mantenimiento de los cuatro serotipos virales (D1 (RIO), D2 (RIO), D3 (H-87), D4 (BV)) en células C6/36 para la futura preparación de antígenos virales. Las células C6/36 fueron cultivadas en medio L-15 con 10% de SFB a 28ºC, e infectadas con 50 ml de cada uno de los serotipos virales por 5 a 7 días. Una vez confirmada la infección por inmunoflurescencia indirecta, los virus fueron titulados por la técnica de placa de lisis. Los títulos de los serotipos fueron D1 (RIO) (2,9 x 106 PFU/ml), D2 (RIO) (4,4 x107 PFU/ml), D3 (H87) (6,4 x 107 PFU/ml) y D4 (BV) (5,1 x106 PFU/ml). La producción de antígenos virales es de gran importancia dado que los mismos pueden ser utilizados en diversos métodos diagnósticos.
Palabras claves: Dengue, cultivo celular, antígeno.
ABSTRACT
Dengue is a serious public health problem that has neither vaccine nor specific treatment. Serology is the most frequently used diagnosis method, specifically the anti-dengue IgM detection. The viral antigens employed in this method could be prepared from Aedes albopictus cell cultures (C6/36). The objective of this study was to maintain the four viral serotypes (D1 (RIO), D2 (RIO), D3 (H-87), D4 (BV)) on C6/36 cells for the preparation of viral antigen in the future. The C6/36 cells were cultured in L-15 medium supplemented with 10% FCS, infected with 50 µl of each viral serotype and then incubated for 5-7 days at 28°C. After confirmation of the infection by indirect immunofluorescence (IIF), viral titration was performed by lysis plaque assay. The serotypes titres obtained were as follows: [2.9 x 106 PFU/ml] for D1 (RIO), (4.4 x107 PFU/ml) for D2 (RIO), (6.4 x 10 7 PFU/ml) for D3 (H87) and (5.1 x106 PFU/ml) for D4 (BV). The production of viral antigens is very important because they could be used in several diagnosis methods.
Keywords: Dengue, cell culture, antigen.
DESARROLLO
El linaje celular C6/36 de A. albopictus fue mantenido en medio Leivobitz-15 (L-15) suplementado con 10 % suero fetal bovino (SFB) a 28ºC. Luego de formada la monocapa de células C6/36, se desechó el sobrenadante, se lavaron las células una vez con PBS y fueron infectadas con 50 ml de cada uno de los cuatro serotipos virales (D1 (RIO), D2 (RIO), D3 (H-87), D4 (BV)); un virus por frasco. Las células se incubaron por una hora a 28ºC con agitación cada quince minutos, luego se le agregó medio L-15 al 2% de SFB y se incubó a 28ºC entre 5 a 7 días. Como resultado de la infección de las células C6/36 se pudo observar el efecto citopático producido, evidenciado por la destrucción de la monocapa celular.(Fig. 1b) En la Fig. 1a se observa la integridad de la monocapa de células sin infectar utilizadas como control.
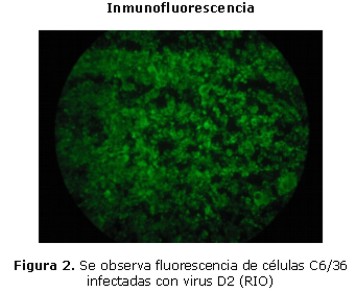
Para la confirmación de la infección se realizó una inmunofluorescencia indirecta al cuarto día post-infección, para ello se tomaron 200 µl del sobrenadante de las células C6/36 infectadas con los diferentes serotipos de dengue, se centrifugó, se desechó el sobrenadante y se tomó 10 µl del sedimento que se depositó en los orificios de una lámina. Una vez seca la lámina se fijó con acetona por 10 minutos, posteriormente se lavó dos veces con PBS y una vez con agua destilada. Una vez seca la lámina se incubó con PBS conteniendo tritón al 0,2% en hielo por 5 minutos. Nuevamente la lámina fue lavada dos veces con PBS y una vez con agua destilada. Se adicionó 20 µl de líquido inmune ascítico de ratón a cada orificio de la lámina y esta se colocó en cámara húmeda a 37ºC durante 30 minutos. Finalmente, se lavó 2 veces con PBS por 5 minutos y una vez con agua destilada. Una vez seca la lámina se agregó 15 µl del Anticuerpo anti-IgG de ratón conjugado con FITC (Sigma, EEUU) con dilución 1/50 incubándose en cámara húmeda a 37ºC por 30 minutos, luego se realizaron dos lavados con PBS y uno con agua destilada; se dejó secar la lámina a temperatura ambiente. Por último se agregó una gota de glicerina tamponada y se observó la inmunofluorescencia en las células infectadas en un microscopio de inmunofluorescencia (16) (Olympus, Japón). En la Fig. 2 se observa la fluorescencia de células C6/36 infectadas con virus de Dengue 2 (RIO).
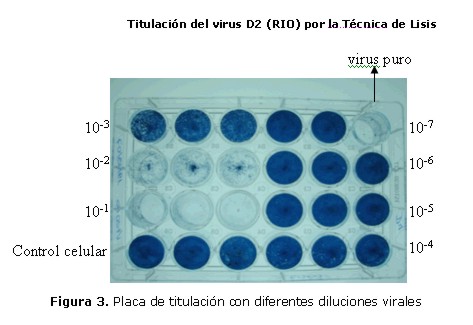
La titulación viral se llevó a cabo por la técnica de formación de placas de lisis utilizando células VERO E6 pues en ellas se observa mejor el efecto citopático a causa de la infección viral, las células fueron cultivadas en medio MEM a 37ºC suplementado con 1% estreptomicina, 1% penicilina, 1% anfotericina y con 10% SFB. Una vez formada la monocapa celular, se tripsinizó a las células y la suspensión celular obtenida se cuantificó y fue ajustada la concentración celular a 2 x 105 células por pocillo en medio MEM con 10% de SFB y fueron posteriormente incubadas a 37ºC y 5 % de CO2 por 24 horas, hasta formar nuevamente la monocapa. Luego el sobrenadante de las células fue desechado y las células adheridas fueron lavadas tres veces con PBS. Los pocillos fueron completados con 400 µl de medio conteniendo diferentes concentraciones del virus, o medio sin SFB como control celular, se incubó la placa por una hora a 37ºC en estufa con 5% de CO2, agitando la placa cada 15 min. Posteriormente se aspiró cuidadosamente la suspensión viral, se agregó 500 µl de Carboxi Metil Celulosa (CMC) (Sigma- EEUU) al 1% en medio MEM más 2% SFB, se incubó por 7 días a 37ºC y con 5% de CO2 luego, se aspiró el sobrenadante manteniendo la integridad del tapete celular, se fijaron y colorearon las células con 200 µl del colorante Naftol Blue Black (Sigma-EEUU) por 40 minutos a temperatura ambiente en agitador, finalmente se aspiró el colorante; y las placas se dejaron secar a temperatura ambiente y se cuantificó la cantidad de placas presentes por microscopía. En la placa de titulación viral (Fig. 3) se puede apreciar las diferentes diluciones del virus D2 (RIO) por triplicado, donde se destaca el efecto citopático a diferentes diluciones virales. En los controles celulares se observa la monocapa de células intacta. A diluciones virales más bajas (10-1, 10-2, y virus puro) se observa la destrucción completa de las monocapas de células, a diluciones más altas (10-3 y 10-4) se observa una destrucción parcial de las monocapas, finalmente a diluciones donde el virus se encuentra aún más diluido se puede observar el efecto citopatico solamente con el microscopio. El título viral se expresó en unidades formadoras de placas/ml (PFU/mL), así los títulos de los serotipos fueron D1 (RIO) (2,9 x 106 PFU/ml), D2 (RIO) (4,4 x107 PFU/ml), D3 (H87) (6,4 x 107 PFU/ml) y D4 (BV) (5,1 x106 PFU/ml).
CONCLUSIÓN
Los títulos virales obtenidos de los diferentes serotipos de dengue son óptimos para la producción de antígenos virales que pueden ser utilizados en diferentes técnicas como ELISA Indirecto, ELISA de captura de IgM (MAC-ELISA) e Inmunofluorescencia Indirecta. Por consiguiente el mantenimiento de estas semillas virales es de suma importancia para la producción de los antígenos.
AGRADECIMIENTOS
A la Mst. Vanesa Menjon Muller, por su colaboración
Al Técnico Superior Oscar Riveros por su colaboración durante el estudio.
A la Agencia de Colaboración Internacional Japonesa (JICA) y
Al Prof. Dr. Jorge Rodas Director del Instituto de Investigaciones en Ciencias de la Salud (IICS).
BIBLIOGRAFÍA
1. Siler A, Lanciotti RS, Calisher CH, Gubler DJ, Chang GJ, Vorndam AV. Rapid detection and typing of dengue viruses from clinical samples by using reverse transcriptase-polymerase chain reaction. J Clin Microbiol 1992;30(3): 545-51. [ Links ]
2. Kimura R, Hotta S. On the inoculation of dengue virus into mice. Nippon Igaku 1994; 3379: 629-33. [ Links ]
3. Rigau-Pérez JG. The early use of break-bone fever (quebranta huesos, 1771) and dengue (1801) in Spanish. Am. J. Trop. Med. Hyg 1998; 59(2): 272-4. [ Links ]
4. Fonseca BAL, Gomes-Ruiz AC, de Paula SO, Nascimento RT. SYBR green and TaqMan real-time PCR assays are /equivalent for the diagnosis of dengue virus type 3 infections. J Med Virol 2006; 78:760-63 [ Links ]
5. Poersch CO, Pavoni DP, Queiroz MH, Borba L, Goldenberg S, Santos CND, et al. Dengue virus infections: comparison of methods for diagnosing the acute disease. J Clin Virol 2005; 32: 272–77 [ Links ]
6. Innis BL. Dengue and dengue haemorrhagic fever. In Porterfield JS eds. Exotic viral infection. London: Chapman and Hall; 1995. P.103-46. [ Links ]
7. Guzmán MG, Kourí G. Advances in dengue diagnosis. Clin Diagnostic Lab Immunol 1996;3(6):621-7. [ Links ]
8. Marianneau P, Megret F, Olivier R, Morens D, Deubel V. Dengue1 virus binding to human hepatoma HepG2 and simian Vero cell surface differs. J.Gen Virol 1996;77:2547-54. [ Links ]
9. Anderson R, King AD, Innis BL. Correlation of E protein binding with cell susceptibility to dengue 4 virus infection. J Gen Virol 1992; 73:2155-9. [ Links ]
10. Després P, Frenkiel MP, Deubel V. Differences between cell membrane fusion activities of two dengue type 1 isolates reflect modifications of viral structure. Virology 1993; 196:209-19. [ Links ]
11. Guirakhoo F, Heinz FX, Mandl CW, Holzman H, Kunz C. Fusion activity of flavivirus: Comparison of mature and immature (prM- containing) tick borne encephalitis virions. J Gen Virol 1991;72:1323-9. [ Links ]
12. WHO. Dengue, dengue hemorrhagic fever and dengue shock syndrome in the context of the integrated management of childhood illness; Washington: World Health Organization; 2005. [ Links ]
13. Díaz FJ, Black WC 4th, Farfán-Ale JA, Loroño-Pino MA, Olson KE, Beaty BJ. Dengue Virus Circulation and Evolution in Mexico: A Phylogenetic Perspectiva. Arch Med Res. 2006; 37(6):760-73 [ Links ]
14. Pozzoli L, Guillén Y, Franco L, Russomando G, Nara E, Candia N et al. Niños de 1 a 5 años de edad susceptible a adquirir dengue hemorrágico en localidades rurales del paraguay. Estudio preliminar. Archivo de Alergia e Inmunologia Clínica 2002; 33(2): 76. [ Links ]
15. MSPBS. Boletín epidemiológico semanal. MSPBS 2006; 4(14):1 [ Links ]
16. Uhl JR, Cocckerill FRI.The fluorescence resonance energy transfer system. In: Persing DH, Tenover FC, Versalovic J, Tang YW, Unger ER, Relman DA (ed). Molecular microbiology diagnostic principles and practice. Washington DC: ASMpress; 2004. p. 295-306. [ Links ]
*Autor Correspondiente: Bioq Carmen Roig, Departamento de Producción Bioquímica
Instituto de Investigaciones en Ciencias de la Salud. Río de la Plata y Lagerenza. Asunción-Paraguay
Email: produccion@iics.una.py