Serviços Personalizados
Journal
Artigo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares em
SciELO
Similares em
SciELO
Compartilhar
Memorias del Instituto de Investigaciones en Ciencias de la Salud
versão On-line ISSN 1812-9528
Mem. Inst. Investig. Cienc. Salud v.6 n.1 Asunción jun. 2008
ARTICULO DE REVISION
Marcadores ecográficos de cromosomopatías en el I trimestre de la gestación: translucencia nucal
Ultrasound markers of chromosomal defects in the first trimester: nuchal translucency
*Ruoti Cosp MI, González de Agüero Laborda RII, Espinosa AIII, Beltrán Peñaloza PIV, Gallo Vallejo MV, Fabre González EVI
ICátedra de Ginecología y Obstetricia, Facultad de Ciencias Médicas, UNA.
IIEcografía y Diagnóstico Prenatal, Hospital Clínico Universitario "Lozano Blesa", Zaragoza, España.
IIIInstituto de Diagnóstico Ecográfico "Matersur", Bahía Blanca, Argentina.
IVHospital de Ginecología y Obstetricia de Monterrey, México.
VUnidad de Medicina Fetal Hospital Universitario "Carlos Haya" y Hospital Internacional Xanit, Málaga, España.
VIDepartamento de Ginecología y Obstetricia, Hospital Clínico Universitario "Lozano Blesa", Zaragoza, España.
RESUMEN
El examen ecográfico detallado de la anatomía fetal permite detectar por un lado las malformaciones y por otro los marcadores ecográficos de cromosomopatías. Analizando especialmente a la translucencia nucal, que representa el grosor del espacio econegativo localizado entre la piel y el tejido blando subcutáneo del embrión a nivel cervical, visualizado entre las semanas 11 a 13+6 de gestación. Se debe utilizar un equipo de ultrasonografía capaz de aumentar lo suficiente la imagen como para que la cabeza y la parte superior del tórax del feto ocupen el monitor y permita diferenciar medidas de hasta 0,1 mm, por vía abdominal o vaginal, situando los calipers en una posición dentro-dentro y evitando confundir la presencia del amnios como un valor alterado de la medida.
La translucencia nucal se comporta como el marcador primario por excelencia en el I trimestre del embarazo, en gestaciones únicas o múltiples, de bajo o alto riesgo genético, no solo para discriminar las cromosomopatías, sino también por su importante asociación en fetos euploides con mayor probabilidad de padecer malformaciones severas, sobre todo cardíacas. Sin embargo, la valoración óptima del riesgo incluye la consideración de otros factores, entre ellos la edad materna, antecedentes familiares y marcadores bioquímicos.
Palabras claves: Marcadores ecográficos, I trimestre, translucencia nucal
ABSTRACT
The detailed sonographic evaluation of the fetal anatomy enables the detection of malformations as well as ultrasound markers of chromosomal defects, specially analyzing the nuchal translucency, which represents the thickness of the sonolucent area located between the skin and the subcutaneous interface of the embryo at cervical level, observed between 11 and 13+6 weeks. It should be used an ultrasound equipment that is able to enlarge the image enough so that the fetus occupies 3/4 of the monitor and allows the differentiation of measurements of up to 0.1 mm, by abdominal or vaginal vias, placing the calipers in an in-in position without mistaking the presence of amnios as an altered measurement. The nuchal translucency acts as the best primary marker in the first trimester of single or multiple pregnancies, of low or high genetic risk, not only to discriminate the chromosomal defects but also for its important association to euploid fetuses with a greater probability of having severe malformations, mostly cardiac. However, the best risk assessment includes the consideration of other factors, including maternal age, family history and biochemical markers.
Keywords: ultrasound markers, first trimester, nuchal translucency.
INTRODUCCIÓN
El advenimiento de la ecografía en la Medicina Fetal constituye hoy en día una de las herramientas más importantes en el avance del conocimiento tanto de la anatomía y fisiología fetal como embrionaria, permitiendo que el feto pase de ser un desconocido para el obstetra a introducir el concepto del feto como un verdadero paciente.
El examen ecográfico detallado de la anatomía fetal permite detectar por un lado las malformaciones, "anomalías morfológicas o estructurales de un órgano o sistema resultante de un desarrollo intrínsecamente anormal" (1) y por otro, los marcadores ecográficos de cromosomopatías,"alteraciones que no pueden ser catalogadas como malformaciones, pero que constituyen signos de alerta que obligan a descartar la presencia de una alteración cromosómica fetal" (2).
La estrecha asociación entre las anomalías cromosómicas y las malformaciones, justifica que un alto porcentaje de fetos con cariotipo anormal puedan ser identificados en el curso de un estudio ecográfico detallado.
Considerada la ecografía como técnica de cribado, uno de sus objetivos es la selección de un subgrupo de la población sobre quienes aplicar técnicas de estudio citogenético fetal. Por lo tanto tras el estudio ecográfico, podremos asignar un riesgo teórico individual de albergar un feto cromosómicamente anormal e indicar la necesidad de un procedimiento invasivo, a partir de un valor arbitrario decidido previamente.
A lo largo de la presente revisión, analizaremos la Translucencia nucal como marcador ecográfico del primer trimestre de la gestación.
Translucencia nucal (TN)
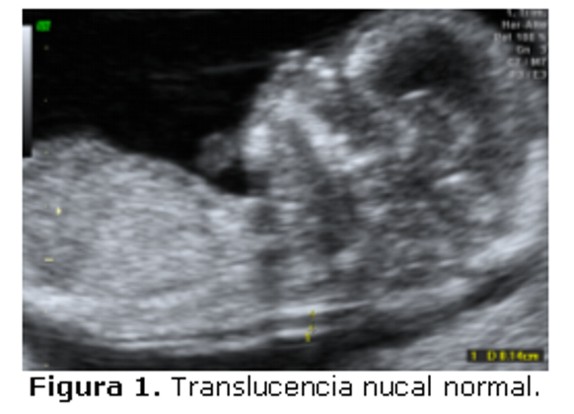
Representa el grosor del espacio econegativo localizado entre la piel y el tejido blando subcutáneo del embrión a nivel cervical, visualizado entre las semanas 10 a 14 de gestación (Figura 1).
Sugerido inicialmente por Szabó et al (3) en 1990 como marcador precoz de trisomía 21, en el momento actual ha demostrado su efectividad en el cribado global de las principales trisomías autosómicas, la 21, 18 y 13, en las menos frecuentes, como la trisomía 10 y en las cromosomopatías sexuales y polipolidías. Además está relacionada con otros tipos de alteraciones como cardiopatías, displasias esqueléticas y síndromes genéticos no cromosómicos, entre otros (4).
A lo largo del tiempo recibió varias denominaciones como edema nucal o sonolucencia nucal, pero fue Nicolaides et al (5) quien introdujo posteriormente el término, siendo el único marcador ecográfico de cromosomopatías del primer trimestre que ha demostrado ser útil en el cribado poblacional, tanto de alto como de bajo riesgo y en gestaciones únicas como múltiples(6,7).
Puede desaparecer a lo largo del segundo trimestre, pero en algunos fetos progresar a engrosamiento de la nuca o pliegue nucal, aunque ambos, translucencia y pliegue nucal se comportarían como marcadores de cromosomopatías independientes (8).
Zoppi et al (9) analizando TN aumentadas entre las semanas 11 y 14 en dos medidas separadas al menos por una semana, informaron en fetos con cromosomopatías que la segunda medida podría estar igual o incluso ser superior, a diferencia de lo que sucedía en los fetos cromosómicamente normales, en que en la segunda tiende a ser inferior.
Fisiopatología
El líquido nucal fetal procede embriológicamente del sistema linfático paracervical, el cual desemboca en la vena yugular interna, pudiéndose encontrar en forma de colección fisiológica (grosor inferior a 3 mm) en el 40% de fetos en el primer trimestre (10). Sin embargo, existen dudas respecto al mecanismo de producción de las colecciones patológicas en esta zona.
Algunos han propuesto que simplemente es una variación del desarrollo normal del sistema linfático, fallo en su drenaje, y/o ausencia o disminución de movimientos fetales con acumulación transitoria de líquido (11,12).
Otros autores, dado que se relaciona con defectos cardiacos como analizaremos mas adelante, suponen que depende de la disminución de la circulación y de la función cardiaca o que se debe a una congestión venosa, compresión mediastínica, a alteraciones en la composición de la matriz extracelular, anemia o hipoproteinemia del embrión o bien a infecciones congénitas, pero todas estas hipótesis no han sido aún confirmadas (13-19).
Consideraciones metodológicas de la medición
A fin de obtener resultados homogéneos en sus mediciones, la Fetal Medicine Foundation, pioneros destacados en la técnica, han definido los criterios que se han convertido en el estándar para la medición de la TN (20).
Estas recomendaciones incluyen efectuar el examen entre las 11 y 14 semanas de gestación (longitud cráneo caudal [LCC] de 45 a 84 mm), con un equipo de ultrasonografía capaz de aumentar lo suficiente la imagen como para que el feto ocupe las 3/4 partes del monitor y permita diferenciar medidas de hasta 0,1 mm.
La vía abdominal o vaginal puede ser indistintamente utilizada. La primera permite mayores variaciones del ángulo del transductor facilitando su medición, pero la vía vaginal consigue mejores imágenes cuando el tejido adiposo es abundante. Para Braithwaite et al (21) su utilización solo fue necesaria en el 5% de las exploraciones.
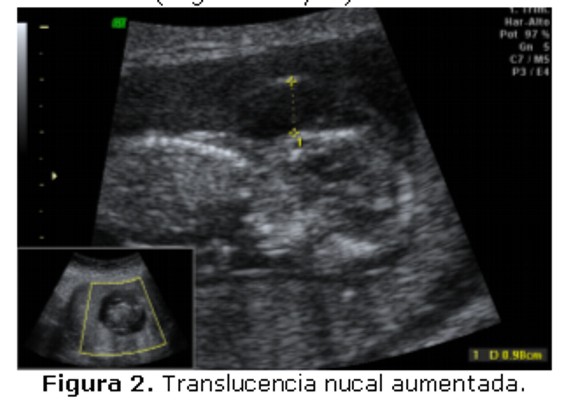
La medición se realiza en un corte sagital y medio, indistintamente si el dorso es superior o inferior, pero sobre todo cuando el embrión se encuentre en actitud indiferente, la calota no debe estar flexionada ni deflexionada (Figuras 1 y 2).
Whitlow et al (22), estimaron un incremento de en 0,62 mm cuando la cabeza fetal se encuentra deflexionda y disminución en 0,4 mm cuando se encuentra flexionada.
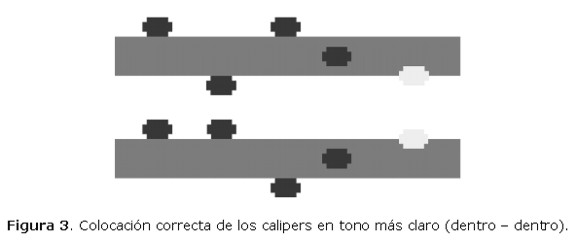
Situando los calipers en una posición dentro-dentro (Figura 3), se mide la mayor zona econegativa entre el hueso occipital y el tejido blando que precede a la columna cervical. Se realizan varias mediciones tomándose como válida la mayor de ellas.
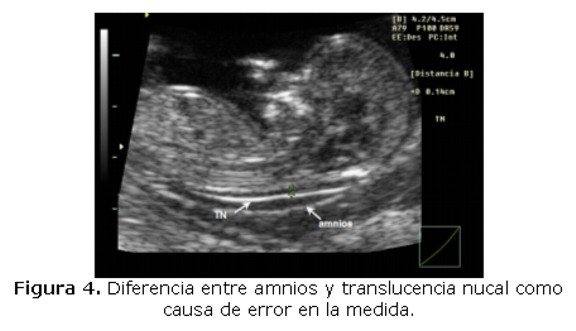
Uno de los cuidados a considerar es distinguir la piel del embrión y el amnios, ya que a estas edades gestacionales ambas estructuras aparecen como membranas delgadas, originado falsos positivos en manos de ecografistas con poca experiencia (Figura 4). En estos casos, es necesario provocar movimientos al embrión para que modifique su posición y se separe del amnios.
Finalmente, tener en cuenta la posibilidad que el cordón umbilical se encuentre muy próximo al cuello fetal (5 a 10% de los casos), que originarían falsos positivos. Para Schaefer et al (23) este hecho incrementaría su medida en 0,8 mm. En los casos en que no se logra alejar el cordón de la zona de medición mediante la provocación de movimientos al feto, es más apropiado tomar como referencia final la medida más pequeña de todas las realizadas por encima y por debajo del cordón (20).
En la tabla 1 se resumen los factores claves para la medida correcta de la translucencia nucal.
Ecografía 3D y TN
La utilización de la ecografía 3D en el rastreo rutinario de la TN fue propuesta por algunos autores ya que permite obtener una vista medio-sagital casi perfecta en la mayor parte de los fetos (24).
La tecnología 3D ofrece una medida volumétrica de la región nucal y una diferenciación clara de la membrana amniótica (25), posibilita rotar el volumen en tres planos ortogonales, almacenarlo e inspeccionarlo posteriormente, todo ello inclusive cuando el feto adopta una posición desfavorable para la ecografía bidimensional. Destacar además la utilización de menor tiempo en la adquisición de la imagen como en su medición (26).
Sin embargo, a pesar de que no se han reportado diferencias intraobservador ni interobservador con esta tecnología, para algunos autores la medida obtenida es infravalorada cuando se la compara con la ultrasonografía convencional y para otros es sobrevalorada, pero de todos modos estos valores oscilan entre 0,1 y 0,2 mm con lo que solo en casos de medidas límites podrían crear alguna duda (27,28).
Valores de referencia
Los criterios para determinar el punto de corte a partir del cual considerar como positiva la TN han evolucionado desde su primera descripción. Al inicio se propuso valores absolutos, por lo general de 2,5 o 3 mm, con resultados globales para la detección de aneuploidías entre el 12 y 88%, pero demostraron una gran dispersión debido fundamentalmente a los diferentes criterios diagnósticos utilizados (29).
Posteriormente, se demostró que la TN aumenta con la edad gestacional. Pajkrt et al (30), en 771 fetos euploides hallaron valores promedios de 0,7 mm correspondientes a la semana 10 de gestación y de 1,5 en la semana 13, por lo tanto el grado de riesgo variaría en función de dicho incremento.
A partir de entonces se confeccionaron curvas de normalidad para cada población, elaboradas por semana de gestación, expresando los rangos normales como derivados de la media de las mediciones efectuadas, escogiendo como punto de corte el 95 percentil.
En tal sentido, Pandya et al (31) reportaron rangos de media de 1,3 mm cuando la LCC era de 38 mm y de 1,9 mm cuando la misma correspondía a 84 mm. El percentil 95 en este estudio, se ubicó en el punto de corte de 2,2 mm para la primera edad gestacional y de 2,8 mm para la segunda.
Comas et al (32), en la semana 11 informó valores de 1,52 mm de media y el 95 percentil en 2,82 mm, en tanto que en la semana 14 de 2,04 mm y 3,10 mm respectivamente.
Estas diferencias en los hallazgos condujeron mas adelante a considerar otras alternativas en la cuantificación de los valores de normalidad. Algunos autores adoptaron valores relativos de acuerdo a la edad gestacional o la LCC como valor delta o múltiplos de la mediana (MoM), utilizado actualmente por la mayoría de los autores. Su uso puede estimar el riesgo específico para cada paciente y permite integrar el riesgo basado en la TN con datos bioquímicos.
Resultados del cribado
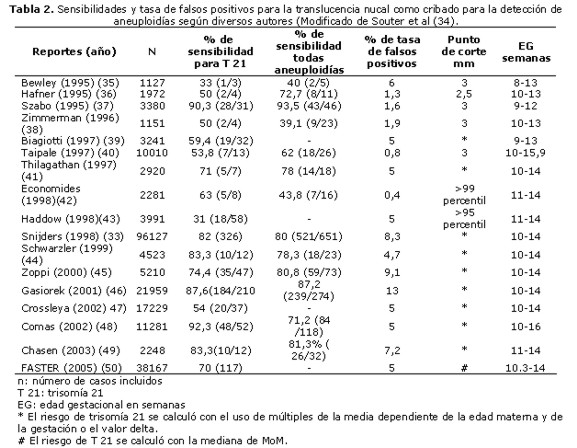
Numerosos estudios han evaluado la medición de la TN en la detección precoz de cromosomopatías (tabla Nº 2), especialmente la trisomía 21.
La referencia más importante por el número de casos incluídos, la homogeneidad en la medición y por los resultados obtenidos, es el estudio multicéntrico dirigido por Nicolaides KH (33).
Analizando 96127 fetos en 30 centros del Reino Unido, incluidas 326 trisomías 21 y otras 325 aneuploidías, informaron una tasa de detección del 77% (72-82% IC 95%) para una tasa de falsos positivos del 5%, cuando la TN se encontraba por encima del 95 percentil.
Además manifestaron una tasa de detección del 79% de trisomía 18, 72% de trisomía 13, y 66,7% de triploidía, pero debemos puntualizar que en estos resultados el higroma quístico y la hidropesía no fueron diferenciaron del aumento de la TN.
Si bien no todos los estudios analizados reportan éstas altas tasas de detección, de igual manera se puede considerar que la TN aislada constituye el marcador ecográfico mas precoz, sensible y específico para la detección de anomalías cromosómicas.
En el estudio FASTER (50)(First- and Second-Trimester Evaluation of Risk) apoyado por los National Institutes of Health y el National Institute of Child Health and Human Development se siguieron 38.167 embarazos y la tasa de detección fue del 70% utilizando la TN solamente. Ellos pudieron medirla correctamente en alrededor del 93%, el resto fue subóptima o no se pudo realizar. En este estudio el higroma quístico se diferenció de la TN. Si bien no todos los estudios analizados reportan estas altas tasas de detección, de igual manera se puede considerar que la TN aislada constituye el marcador ecográfico más precoz, sensible y específico para la detección de anomalías cromosómicas.
Criticas a la TN
La utilización de este marcador ha generado diversas críticas basados fundamentalmente en dos aspectos. El primero de ellos se refiere a su medición precoz que, aún con las ventajas ya mencionadas de la precocidad del diagnóstico, puede detectar gestaciones destinadas a su interrupción espontánea dada la considerable letalidad de las cromosomopatías (51).
El segundo aspecto se refiere a la subjetividad en la medición ya que el equipo utilizado, la sistemática empleada y la experiencia del operador, son importantes al evaluar su efectividad.
En un trabajo prospectivo que incluyó a 200 gestantes en que la TN fue medida entre dos a cuatro exploradores para estudiar la variación intraobservador e interobservador (52), comprobaron que en el 95% de las diferencias eran inferiores a 0,5 mm y que se debían más al lugar en el que se colocaban los calipers que a la obtención del corte adecuado.
Otros autores han confirmado posteriormente estos mismos resultados (53,54), por lo que concluimos que su reproducibilidad es alta y destacamos la importancia del aprendizaje y seguimiento de los criterios metodológicos que hemos descrito.
TN aumentado y cariotipo normal
Numerosos estudios en los inicios de la década de los 90, informaron de una alta asociación entre la TN aumentada y cardiopatías fetales, sin embargo éstos por el pequeño tamaño de la muestra no permitían llegar a conclusiones definitivas (55-57).
Souka et al (58), en un seguimiento a 4116 fetos con cariotipo normal y TN superior al 95 percentil, informaron que la tasa de supervivencia y de recién nacidos normales disminuye a medida que aumenta el valor de la TN, con elevada tasa de abortos y mortalidad perinatal ocasionado por un aumento significativo del número de síndromes genéticos poco frecuentes y de anomalías estructurales, especialmente cardiopatías.
Por otro lado, Hyett et al (59) analizaron retrospectivamente 29153 gestaciones únicas, incluidas 50 malformaciones cardiacas mayores y de grandes vasos, reportando una prevalencia de estos defectos de 0,8 por 1000 nacidos vivos (NV) cuando la TN era inferior al 95 percentil (< 2,7 mm), de 5,3 por 1000 NV con valores iguales o superiores al 95 percentil (2,8 a 5,4 mm) y de 63,5 por 1000 NV con TN por encima del 99 percentil (> 5,5 mm). Las sensibilidades, especificidades, valores predictivos positivos y negativos, varían de acuerdo al punto de corte en el percentil 95 o 99 como se demuestra en la tabla Nº 3.
Aunque no se conoce realmente qué cardiopatías se correlacionan con una TN aumentada, en este estudio, las que aparecieron fueron la tetralogía de Fallot, hipoplasia de cavidades izquierdas, transposición de grandes vasos, coartación aortica, estenosis o atresia aortica y defectos septales y atrioventriculares, entre las principales.
Recientemente, Galindo et al (60) corroboran estos estudios previos reportando una prevalencia de 9,1% de cromosomopatías en 352 fetos euploides con TN aumentada. Sin embargo, variaba entre de 5,3% cuando la TN era igual o superior al percentil 95 (< 3,9 mm) a 24% cuando se encontraba por encima del 99 percentil (< 6 mm).
En un metaanálisis realizado sobre TN y cardiopatías con 8 estudios en 58.492 mujeres embarazadas se observó que para una TN por encima del p99 la sensibilidad es del 31% y 98,7% de especificidad (61).
La aplicación práctica de estas observaciones establece la recomendación de instaurar el seguimiento de estos fetos y sienta una nueva indicación de ecocardiografía fetal.
Otras anomalías pueden presentarse en fetos euploides con TN aumentada como la hernia diafragmática, onfaloceles, defectos del tubo neural entre otros, así como displasias esqueléticas, atrofias músculo-espinales o raros síndromes genéticos como el Smith-Lemli-Opitz, de Noonan, de Pena-Shokeir, de Jarcho-Levin, artrogriposis, displasias tanatofóricas o talasemias, por citar algunas(16,62).
TN y gestaciones múltiples
Sin lugar a dudas, las gestaciones múltiples se comportan como una situación particular en el cribado de cromosomopatías. Una de las limitaciones que plantea, es la interpretación de los valores de los marcadores séricos, determinando que el cribado bioquímico pueda ser menos preciso que en gestaciones únicas.
En las gestaciones dicorionicas, la sensibilidad y la tasa de falsos positivos para la trisomía 21 son similares a las reportadas en las gestaciones únicas (7). En estos casos la TN tiene los mismos valores de referencia, por lo que la aplicación de programas de cribado basado en la medición de la TN representa el mejor recurso disponible para seleccionar fetos con mayor riesgo de aneuploidías en este tipo de gestaciones.
En relación a las gestaciones monocoriales, por el bajo número de casos examinados a la fecha no es posible afirmar similares conclusiones, debiéndose considerar en el cálculo de riesgo de la trisomía 21 el promedio de ambas medidas (7).
No obstante, resulta de interés en la predicción del síndrome de transfusión feto-fetal (TTTS). Sebire NJ et al (63), en 132 gestaciones monocoriales, incluidas 16 TTTS graves entre las 15 y 22 semanas, el incremento de la TN por encima del 95 percentil fue asociado con aumento de 4 veces mas de probabilidad de desarrollar TTTS graves.
Estos autores consideran que el posible aumento de la TN en el feto receptor se debe a una manifestación de fallo cardiaco por congestión hipervolémica; posteriormente al avanzar la gestación y con la consecuente diuresis, favorecería tanto la corrección de la hipervolemia como la reducción de la presión cardíaca con la consecuente mejoría del fallo cardíaco y desaparición de la TN.
CONCLUSION
El rastreo ecográfico en las semanas 11 a 14 en busca de aneuploidías fetales ha experimentado avances importantes, especialmente desde que la ecografía ha sido reconocida como una técnica inocua capaz de identificar a un subgrupo de gestantes y considerarlas de riesgo.
Dada la tendencia generalizada a adelantar el momento en la gestación en que se apliquen los programas de diagnóstico prenatal por las ventajas que ello implica, éste sería el período óptimo para intentar su aplicación clínica.
La translucencia nucal se comporta como el marcador primario por excelencia en este periodo de tiempo, no solo para discriminar las cromosomopatías, sino también por su importante asociación en fetos euploides con mayor probabilidad de padecer malformaciones severas, sobre todo cardíacas. Sin embargo, la valoración óptima del riesgo incluye la consideración de otros factores, entre ellos la edad materna, antecedentes familiares y marcadores bioquímicos.
Los datos obtenidos en la exploración ecográfica de la semana 11-14, especialmente referido a los marcadores ecográficos de cromosomopatías son útiles para incorporar nuevas pacientes a las que ofrecer técnicas invasivas. En las que ya existe indicación por otros motivos, la presencia de marcadores incrementa su riesgo, mientras que su ausencia probablemente lo disminuye. Esta información debe trasmitirse a la pareja para que tome la decisión personal de someterse o no a una técnica invasiva, pero debemos tener presente que hasta que existan publicaciones suficientemente contrastadas, aunque los marcadores no estén presentes, desde el punto de vista médico y sobre todo legal, no podemos dejar de seguir indicando la técnica invasiva en este grupo de gestantes.
BIBLIOGRAFIA
1. Díaz Recaséns J, Plaza Arranz J, Fernández Moya JM. Malformaciones congénitas: clasificación y formas comunes. En: Cabero Roura L. Tratado de Ginecología, Obstetricia y Medicina de la Reproducción. Madrid: Editorial Médica Panamericana; 2003.p. 977-94. [ Links ]
2. Carreras Moratonas E, Higueras Sanz T. Marcadores ecográficos de cromosomopatías En: Cabero Roura L. Tratado de Ginecología, Obstetricia y Medicina de la Reproducción. Madrid: Editorial Médica Panamericana; 2003.p. 1016-23. [ Links ]
3. Szabo J, Gellen J. Nuchal fluid accumulation in trisomy-21 detected by vaginosonography in first trimester. Lancet 1990; 336:1133. [ Links ]
4. Bilardo CM, Müller MA, Pajkrt E. Outcome of fetuses with increased nuchal translucency. Curr Opin Obstet Gynecol 2001; 13:169-74. [ Links ]
5. Nicolaides KH, Azar G, Byrne D, Mansur C, Marks K. Fetal nuchal translucency: ultrasound screening for chromosomal defects in first trimester of pregnancy. BMJ 1992; 304:867-9. [ Links ]
6. Nicolaides KH, Heath V, Cirero S. Increased fetal nuchal translucency at 11-14 weeks. Prenat Diagn 2002; 22:308-15. [ Links ]
7. Sebire NJ, Snijders JM, Hughes K, Sepulveda W, Nicolaides KH. Screening for trisomy 21 in twin pregnancies by maternal age and fetal nuchal translucency thickness at 10-14 weeks of gestation. Br J Obstet Gynecol 1996; 103:999-1003. [ Links ]
8. Salomon LJ, Bernard JP, Taupin P, Benard C, Ville Y. Relationship between nuchal translucency at 11-14 weeks and nuchal fold at 20-24 weeks of gestation. Ultrasound Obstet Gynecol. 2001; 18:636-7. [ Links ]
9. Zoppi MA, Ibba RM, Floris M, Manca F, Axiana C, Monni G. Changes in nuchal translucency thickness in normal and abnormal karyotype fetuse. BJOG 2003; 110:584-8. [ Links ]
10. Wilson RD, Venir N, Farquharson DF. Fetal nuchal fluid - physiological or pathological? - in pregnancies less than 17 menstrual weeks. Prenat Diagn 1992; 12:755-63. [ Links ]
11. von Kaisenberg CS, Nicolaides KH, Brand-Saberi B. Lymphatic vessel hypoplasia in fetus with Turner syndrome. Hum Reprod 1999; 14:823-6. [ Links ]
12. Hyett JA, Noble PL, Sebire NJ, Snijers RJ, Nicolaides KH. Lethal congenital artrogryposis presents with increased nuchal translucency at 10 - 14 weeks of gestation. Ultrasound Obstet Gynecol 1997; 9:310-3. [ Links ]
13. Mol BWJ. Down´s syndrome, cardiac anomalies and nuchal translucency. Fetal heart failure might link nuchal translucency and Down`s syndrome. BMJ 1999; 318:70-1 [ Links ]
14. Daskalakis G, Sebire NJ, Jurkovic D, Snijders RJ, Nicolaides KH. Body stalk anomaly at 10-14 weeks of gestation. Ultrasound Obstet Gynecol 1997; 10:416-8. [ Links ]
15. Sebire NJ, Snijders RJ, Davenport M, Greenough A, Nicolaides KH. Fetal nuchal translucency thickness at 10-14 week´s gestation and congenital diaphragmatic hernia. Obstet Gynecol 1997; 90: 943-6. [ Links ]
16. Lam YH, Tang MH, Lee CP, Tse HY. Nuchal translucency in fetuses affected by homozygous alpha-thalassemia - 1 at 12 - 13 weeks of gestation. Ultrasound Obstet Gynecol 1999; 13:238-40. [ Links ] 17. Von Kaisenberg CS, Brand-Saberi B, Christ B, Vallian S, Farzaneh F, Nicolaides KH. Collagen type VI gene expression in the skin of trisomy 21 fetuses. Obstet Gynecol 1998; 91:319-23. [ Links ] 18. Bohlandt S, von Kaisenberg CS, Wewetzer K, Christ B, Nicolaides KH, Brand-Saberi B. Hyaluronan in the nuchal skin of chromosomally abnormal fetuses. Hum Reprod 2000; 15:1155-8. [ Links ] 19. Sebire NJ, Bianco D, Snijders RJ, Zuckerman M, Nicolaides KH. Increased fetal nuchal translucency thickness at 10 - 14 weeks: is screening for maternal - fetal infection necessary?. Br J Obstet Gynecol 1997; 104:212-5. [ Links ] 20. Pandya P: Nuchal translucency thickness En: Nicolaides KH, Sebire NJ, Snijders RJ editors. The 11 - 14 week scan. The diagnosis of fetal abnormalities. Carnforth, England, Parthenon Publishing Group, 1999.p. 15. (Diploma in fetal medicine series). [ Links ] 21. Braithwaite JM, Morris RW, Economides DL. Nuchal translucency measurements: frequency distribution and changes with gestation in a general population. Br J Obstet Gynaecol 1996; 103:1201-4. [ Links ] 22. Whitlow BJ, Chatzipapas IK, Economides DL. The effect of fetal neck position on nuchal translucency measurement. Br J Obstet Gyencol 1998;105(8):872-6. [ Links ] 23. Schaefer M, Laurichesse-Delmas H, Ville Y. The effect of nuchal coord on nuchal translucnecy measurement at 10-14 weeks. Ultrasound Obstet Gynecol 1998; 11:271-3. [ Links ] 24. Kurjak A, Kupesic S, Ivancic-Kosuta MJ. Three-dimensional transvaginal ultrasound improves measurement of nuchal translucency. J Perinat Med 1999; 27:97-102. [ Links ] 25. Hull AD, James G, Salerno CC, Nelson T, Pretorius DH. Three-dimensional ultrasonography and assessment of the first-trimester fetus. J Ultrasound Med 2001; 20:287-93. [ Links ] 26. Clementschitsch G, Hasenöhrl G, Schaffer H, Steiner H. Comparison between two- and three-dimensional ultrasound measurements of nuchal translucency. Ultrasound Obstet Gynecol 2001; 18:475-80. [ Links ] 27. Eppel W, Worda C, Frigo P, Lee A. Three-versus two-dimensional ultrasound for nuchal translucency thickness measurements: Comparison of feasibility and levels of agreement. Prenat Diagn 2001;21:596-601. [ Links ] 28. Worda C, Radner, Lee A, Eppel W. Three-dimensional ultrasound for nuchal translucency thickness measurements: Comparison of transabdominal and transvaginal ultrasound. J Soc Gynecol Investig 2003;10:361-5. [ Links ] 29. Chitty LS, Pandya PP. Ultrasound screening for fetal abnormalities in the first trimester. Prenatal Diag 1997; 17:1269-81. [ Links ] 30. Pajkrt E, Bilardo CM, Van Lith JM, Mol BW, Bleker OP. Nuchal translucency measurement in normal fetuses. Obstet Gynecol 1995; 86:994-7. [ Links ] 31. Pandya PP, Snijders RJ, Johsohn SP, Brizot de Lourdes M, Nicolaides KH. Screening for fetal trisomies by maternal age and fetal nuchal translucency thickness at 10 - 14 weeks of gestation. Br J Obstet Gynecol 1995; 102:957-62. [ Links ] 32. Comas C, Muñoz A, Torrents M, Antolín E, Palacio M, Devesa R, et al. Screening precoz de cromosomopatías mediante ecografía y Doppler. Prog Diagn Prenat 1998; 10:450-63. [ Links ] 33. Snijders RJ, Noble P, Sebire N, Souka A, Nicolaides KH. UK multicentre project on assessment of risk of trisomy 21 by maternal age and fetal nuchal translucency thickness at 10-14 weeks of gestation. Lancet 1998; 351:343-6. [ Links ] 34. Souter V, Nyberg D. Sonographic screening for fetal aneuploidy: first trimester. J Ultrasound Med 2001, 20:775-90. [ Links ] 35. Bewley S, Roberts LJ, MacKinson AM, Rodeck CH. First trimester fetal nuchal translucency: problems with screening the general population. Br J Obstet Gynaecol 1995; 102:386-8. [ Links ] 36. Hafner E, Schuchter K, Philipp K. Screening for chromosomal abnormalities in an unselected population by nuchal translucency. Ultrasound Obstet Gynecol 1995; 6:330-3. [ Links ] 37. Szabo J, Gellen J, Szemere G. First-trimester ultrasound screening for fetal aneuploidies in women over 35 and under 35 years of age. Ultrasound Obstet Gynecol 1995; 5:161-3. [ Links ] 38. Zimmermann R, Hucha A, Savoldelli G, Binkert F, Achermann J, Grudzinskas JG. Serum parameters and nuchal translucency in first trimester screening for fetal chromosomal abnormalities. Br J Obstet Gynaecol 1996; 103:1009-14. [ Links ] 39. Biagiotti R, Periti E, Brizzi L, Vanzi E, Cariati E. Comparison between two methods of standardization for gestational age differences in fetal nuchal translucency measurement in first trimester screening for trisomy 21. Ultrasound Obstet Gynecol 1997; 9:248-52. [ Links ] 40. Taipale P, Hiilesmaa V, Salonen R, Ylostalo P. Increased nuchal translucency as a marker for fetal chromosomal defects. N Eng J Med 1997; 337:1654-8. [ Links ] 41. Thilaganathan B, Slack A, Wathen NC. Effect of firsttrimester nuchal translucency on second-trimester maternal serum biochemical screening for Down´s syndrome. Ultrasound Obstet Gynecol 1997; 10:26-4. [ Links ] 42. Economides DL, Whitlow BJ, Kadir R, et al. First trimester sonographic detection of chromosomal abnormalities in an unselected population. Br J Obstet Gynaecol 1998; 105:58-62. [ Links ] 43. Haddow JE, Palomaki GE, Knight GJ, Williams J, Miller WA, Johnson A. Screening of maternal serum for fetal Down´s syndrome in the first trimester. N Engl J Med 1998; 338:955-61. [ Links ] 44. Schwarzler P, Carvalho JS, Senat MV, Masroor T, Campbell S, Ville Y. Screening for fetal aneuploidy and fetal cardiac abnormalities by nuchal translucency thickness measurement at 10-14 weeks gestation as part of routine antenatal care in an unselected population. Br J Obstet Gynaecol 1999; 106:1029-34. [ Links ] 45. Zoppi MA, Ibba RM, Putzolu M, Floris M, Monni G. Assessment of risk for chromosomal abnormalities at 10-14 weeks of gestation by nuchal translucency and maternal age in 5,210 fetuses at a single centre. Fetal Diagn Ther 2000; 15:170-3. [ Links ] 46. Gasiorek-Wiens A, Tercanli S, Kozlowski P, Kossakiewicz A, Minderer S, Meyberg H, et al. Screening for trisomy 21 by fetal nuchal translucency and maternal age: multicenter project in Germany, Austria and Switzerland. Ultrasound Obstet Gynecol 2001; 18:645-8. [ Links ] 47. Crossleya JA, Aitkena DA, Cameronb AD, McBridea E, Connora JM. Combined ultrasound and biochemical screening for Down´s Syndrome in the first trimester: a Scottish multicentre study. BJOG 2002; 109:667-76. [ Links ] 48. Comas C, Torrents M, Muñoz A, Antolín E, Figueras F, Echevarrúa M. Measurement of nuchal translucency as a single strategy in trisomy 21 screening: should we use any other marker?. Obstet Gynecol 2002;100:648-54. [ Links ] 49.Chasen ST, Sharma G, Kalish B, Chervenak FA. First trimester screening for aneuploidy with fetal nuchal translucency in a United States population. Ultrasound Obstet Gynecol 2003; 22:149-51. [ Links ] 50. Malone FD, Canick JA, Ball RH, Nyberg DA, Comstock CH, Bukowski R, et al, for the First- and Second-Trimester Evaluation of Risk (FASTER) Research Consortium*. First-trimester or second-trimester screening, or both, for Down's syndrome. N Engl J Med 2005;353(19):2001-11. [ Links ] 51. Hyett JA, Sebire NJ, Snijders RJ, Nicolaides KH. Intrauterine lethality of trisomy 21 fetuses with increased nuchal thickness. Ultrasound Obstet Gynecol 1996; 7:101-3. [ Links ] 52. Pandya PP, Altman DG, Brizot ML, Pettersen H, Nicolaides KH. Repeatability of measurement of fetal nuchal translucency tickness. Ultrasound Obstet Gynecol 1995; 5:334-7. [ Links ] 53. Thilaganathan B, Sairam S, Michailidis G, Wathen NC. First trimester nuchal translucency: effective routine screening for Down's syndrome. Br J Radiol 1999;72:946-8. [ Links ] 54. Jackson M, Rose NC. Diagnosis and management of fetal nuchal translucency. Semin Roentgenol 1998;33: 333-8. [ Links ] 55. Bronshtein M, Siegler E, Yoffe N, Zimmer EZ. Prenatal diagnosis of ventricular septal defect and overriding aorta at 14 weeks´ gestation, using transvaginal sonography. Prenatal Diagn 1990; 10:697-702. [ Links ] 56. Gembruch U, Knopfle G, Chatterjee M, Bald R, Hasmann M. First trimester diagnosis of fetal congenital heart disease by transvaginal two-dimensional and Doppler echocardiography. Obstet Gynecol 1990; 75: 496-8. [ Links ] 57. Achiron R, Rotstein Z, Lipitz S, Mashiach S, Hegesh J. First trimester diagnosis of fetal congenital Herat disease by transvaginal ultrasonography. Obstet Gynecol 1994; 84:69-72. [ Links ] 58. Souka AP, Snijders RJ, Novakov A, Soares W, Nicolaides KH. Defects and syndromes in chromosomally normal fetuses with increased nuchal translucency thickness at 10 - 14 weeks of gestation. Ultrasound Obstet Gynecol 1998; 11:391-400. [ Links ] 59. Hyett JA, Perdu M, Shaland GK, Snijders RJ, Nicolaides KH. Using fetal nuchal translucency to screen for major congenital cardiac defects at 10 - 14 weeks of gestation: population based cohort study. BMJ 1999; 318:81-5. [ Links ] 60. Galindo A, Comas C, Martínez JM, Gutiérrez-Larraya F, Carrera JM, Puerto B, et al. Cardiac defects in chromosomally normal fetuses with increased nuchal translucency at 10-14 weeks of gestation. J Matern Fetal Neonatal Med 2003; 13:163-70. [ Links ] 61. Makrydimas G, Sotiriadis A, Ioannidis JP. Screening performance of first-trimester nuchal translucency for major cardiac defects: a meta-analysis. Am J Obstet Gynecol 2003; 189:1330-5. [ Links ] 62. Snijders R, Smith E. The role of fetal nuchal translucency in prenatal screening. Curr Opin Obstet Gynecol 2002; 14:577-85. [ Links ] 63. Sebire NJ, D`Ercole C, Hughes K, Carvalho M, Nicolaides KH. Increased fetal nuchal translucency thickness at 10-14 weeks of gestation as a predictor of severe twin-to-twin transfusion syndrome. Ultrasound Obstet Gynecol 1997; 10:86-9. [ Links ] *Autor Correspondiente:Dr. Miguel Ruoti Cosp
Teléfono: 595(21)214191
Email: mruoticosp@hotmail.com