Serviços Personalizados
Journal
Artigo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares em
SciELO
Similares em
SciELO
Compartilhar
Memorias del Instituto de Investigaciones en Ciencias de la Salud
versão On-line ISSN 1812-9528
Mem. Inst. Investig. Cienc. Salud v.5 n.1 Asunción jun. 2007
ARTICULO ORIGINAL
Seguimiento clínico y serológico de pacientes tratados de leishmaniosis cutánea
Clinical and serological follow-up of patients treated from cutaneous leishmaniosis
Oddone RI*, Maciel JDII, Canese AIII, Velázquez, GRI, Meza TI, Morán MIII
IInstituto de Investigaciones en Ciencias de la Salud, Universidad Nacional de Asunción. Asunción-Paraguay
IIInstituto de Medicina Tropical, Ministerio de Salud Pública y Bienestar Social. Asunción-Paraguay
IIILaboratorio Central de Salud Pública, Ministerio de Salud Pública y Bienestar Social. Asunción-Paraguay
RESUMEN
La inmunofluorescencia indirecta con antígeno crudo de Leishmania constituye una técnica serológica convencional que para el diagnóstico de leishmaniosis presenta una sensibilidad moderada, entre el 70 y el 80%. Son muy raros los trabajos que en la literatura reportan su uso para el seguimiento serológico post-tratamiento de los pacientes, aunque la experiencia que en general se tiene en áreas endémicas consiste en que la mayoría de los casos clínicamente curados presentan una disminución importante de los títulos serológicos con el avance del tiempo. Este trabajo tiene por objetivo describir el cuadro clínico y los valores de la reacción serológica en pacientes con leishmaniosis cutánea antes y después de su tratamiento. Para este trabajo ha sido estudiado el comportamiento clínico y serológico de un grupo de 32 pacientes con leishmaniosis cutánea, en un brote de la enfermedad producido en 1998 en el distrito de Capiibary, Departamento de San Pedro. De los pacientes evaluados hasta 18 o 24 meses post-tratamiento todos excepto uno manifestaron curación de sus lesiones. La gran mayoría de los sujetos han mostrado disminución de los títulos serológicos, hasta la negativización. Se concluye que el seguimiento serológico arroja valores que coinciden con la clínica de los pacientes, por lo tanto amerita que sea llevado a cabo complementariamente con la inspección clínica. Al no contar en este estudio con casos de reactivación cutánea o mucosa, no se puede concluir acerca del valor predictivo de la serología para estos casos.
Palabras claves: Leishmaniosis cutánea, seguimiento, serología, inmunofluorescencia indirecta, curación.
ABSTRACT
The indirect immunofluorescent assay with crude Leishmania antigen constitutes a conventional serologic technique for the diagnosis of leishmaniosis. It has a moderate sensitivity, between 70 and 80%. It is very rare to find in the literature studies reporting its use for the post-treatment serological follow-up of patients. However, the general experience having in endemic areas consists of an important decrease in the serological titers though the time in most of clinically healed cases. The objective of this study is to describe both the clinical profile and the serological reaction of patients with cutaneous leishmaniosis before and after treatment. For this purpose, it has been studied the clinical and serological behaviour of 32 patients with cutaneous leishmaniosis from an outbreak of the disease occurred in 1998 in the Capiibary district, Department of San Pedro. All the patients evaluated up to 18 or 24 months after treatment, except one, showed cure from their lesions. Most of the individuals presented decrease of their serological titers up to becoming them negative. It is concluded that the serological follow-up shows results coincident with the clinical manifestation of patients. Therefore, the serological follow-up merits to be performed complementary to the clinical inspection. Not having in this study case of either cutaneous or mucosal reactivation, we can not conclude regarding the predictive value of the serology in these cases.
Keywords: Cutaneous leishmaniosis, follow-up, serology, immunofluorescent assay, cure.
INTRODUCCIÓN
La leishmaniosis tegumentaria constituye una zoonosis endémica de las regiones tropicales y subtropicales del mundo. Es causada por protozoarios del género Leishmania y trasmitida en las Américas por insectos del género Lutzomyia. En los hombres ocasiona lesiones en piel con metástasis en mucosas de las vías aéreas superiores, que se manifiestan de diversas maneras. En Paraguay, la casi totalidad de los casos en que se ha logrado la identificación de los parásitos corresponde a Leishmania (V.)braziliensis1, siendo notificados cada año entre 500 y 1000 casos2.
La forma cutánea de la enfermedad, denominada leishmaniosis cutánea (LC), se caracteriza por la aparición, en el sitio de picadura del insecto vector, de lesiones nodulares, ulcerosas o úlcero-costrosas, típicamente redondeadas y con bordes sobreelevados. Sin embargo, el diagnóstico no es fácil y requiere a veces la combinación de diversos métodos.
La inmunofluorescencia indirecta (IFI) con antígeno crudo de Leishmania ha sido uno de los métodos serológicos utilizado con mayor frecuencia en el pasado, aunque los títulos de anticuerpos no han sido elevados3. Los estudios de sensibilidad de esta técnica revelan resultados variables, que van desde el 60%3 hasta el 79,6 y el 82%4,5, siendo reportadas en los estudios realizados en Paraguay sensibilidades entre el 60 % 6 y 72,5%7. La reacción no es específica para los anticuerpos anti-Leishmania, pues da reacción cruzada con sueros de pacientes con enfermedad de Chagas, lupus eritematoso, malaria, toxoplasmosis, amebiasis y paracoccidiomicosis4.
Existen en la literatura escasos estudios de seguimiento post-tratamiento a mediano y largo plazo en pacientes con LC, y entre ellos ninguno reporta algún seguimiento serológico para la forma cutánea de leishmaniosis.
Este trabajo tiene por objetivo describir el cuadro clínico y los valores de los títulos de la reacción serológica observados en pacientes con leishmaniosis cutánea antes y después de su tratamiento.
MATERIALES Y MÉTODOS
Área geográfica:
Para este trabajo se estudió el comportamiento clínico y serológico de pacientes con LC, residentes en los asentamientos rurales de Arapyajhu y 3 de Noviembre, distrito de Capiibary, Departamento de San Pedro. Dichos asentamientos fueron afectados de un brote importante de LC entre los años 1997 y 1998, con alrededor de 120 casos registrados.
Pacientes, procedimientos diagnósticos, tratamiento y seguimiento:
Todos los pacientes con lesiones cutáneas que consultaron en los puestos de salud de ambos asentamientos fueron considerados como candidatos. Los criterios de reclutamiento fueron: Tener hasta 6 lesiones cutáneas sospechosas de LC, de 2 a 20 semanas de evolución, sin tratamiento específico previo. Fueron excluídos pacientes con episodios anteriores de LC o con compromiso mucoso, mujeres embarazadas, sujetos que no aceptaron los procedimientos diagnósticos y sujetos que concurrieron a menos de dos convocatorias de seguimiento post-tratamiento.
Los pacientes, previo consentimiento escrito, fueron sometidos a pruebas diagnósticas inmunológicas (Intradermorreacción de Montenegro e IFI) y parasitológicas (análisis histopatológico, cultivo en medio NNN –Novy, Nicolle y Mc Neal-) previamente a su tratamiento. Todos los pacientes con diagnóstico positivo fueron tratados con estibogluconato de sodio (Pentostam®, The Wellcome Foundation Ltd, Middlesex, UK), con 20 mg de antimonio pentavalente/ Kg/ día, intramuscular o intravenoso, durante 20 días.
Los casos de LC se definieron utilizando criterios clínicos de úlceras sospechosas, una respuesta positiva a la prueba cutánea de la leishmanina y por observación del agente causante en análisis histopatológico o por aislamiento del parásito en cultivo. De los 67 pacientes que concurrieron a los puestos de salud, 32 fueron seleccionados para este estudio al cumplir con los requisitos descriptos. Las tomas de muestras de sangre para IFI fueron siempre una basal (antes del tratamiento) y otras dos o tres posteriores al tratamiento, con espacios de al menos 6 meses entre una toma de muestra y otra, abarcando así un seguimiento que duró, según los casos, hasta 18 o 24 meses a partir de la fecha de tratamiento.
Todas las muestras de suero de pacientes fueron además tituladas contra antígeno crudo de T. cruzi (Chagas ELISA kit, IICS-UNA, Paraguay) para descartar posibles reacciones cruzadas con enfermedad de Chagas. Las muestras que resultaron positivas por el test de ELISA para Chagas fueron a su vez confirmadas o descartadas por la prueba de inhibición de la transialidasa, considerada específica para enfermedad de Chagas8.
Criterios de curación:
Los pacientes fueron considerados curados cuando se observaron durante los tres primeros meses después del tratamiento desaparición de las lesiones, caracterizadas por epitelización completa, ausencia de signos inflamatorios, no evidencia de nuevas lesiones y regresión completa de ganglios satélites o de la linfangitis.
Criterios de falla terapéutica:
Fue considerado el caso como falla terapéutica cuando se observó alguna de las siguientes situaciones a los tres meses del final del tratamiento: curación incompleta caracterizada por epitelización parcial, persistencia de signos inflamatorios, ausencia de mejoría, nuevas lesiones ulceradas, o empeoramiento del proceso inflamatorio después de un período de mejoría durante dicho lapso de tres meses.
Criterios de recidiva:
Se consideró como recidiva la aparición de signos inflamatorios, con o sin ulceración, en una lesión previamente curada.
Serología:
Para la IFI, se utilizó la técnica de Camargo9 con antígeno crudo de Leishmania (V.) braziliensis (preparado en el Laboratorio Central de Salud Pública, MSP y BS) y conjugado de antigammaglobulina IgG humana, proveniente de conejo, marcada con fluoresceína (Biomerieux, Francia). Los sueros fueron diluidos con tampón fosfato salino, realizando diluciones seriadas (1:10, 1:20, 1:40, 1:80, etc). Microscopio utilizado: Nikon modelo 1985 de epiiluminación, con lámpara UV HBO50. Todas las muestras fueron procesadas en el Laboratorio Central de Salud Pública (MSP y BS).
Aspectos Éticos:
Este estudio fue realizado teniendo en cuenta los estándares del Consejo de Organizaciones Internacionales de las Ciencias Médicas y de la declaración de Helsinki de 1975, revisada en el 2000. Todos los pacientes firmaron el consentimiento informado para realizar los procedimientos diagnósticos y de seguimiento, y fueron tratados de acuerdo a las normativas de la OMS para el tratamiento de leishmaniosis.
RESULTADOS
De los 32 casos seleccionados para este estudio, 31 manifestaron completa curación de sus lesiones. Sólo en un caso (L53) la lesión cutánea persistió a través del tiempo. Ningún caso manifestó, durante los 24 meses de estudio, alguna reactivación de las lesiones o aparición de úlceras en las mucosas. Sin embargo, un paciente (caso L112-55), residente permanente de dicha zona, presentó una nueva lesión en otro sitio del cuerpo después de 3 meses de finalizado su tratamiento.
Durante el período de seguimiento de los pacientes no se manifestaron nuevos brotes de enfermedad en la zona, aunque sí la aparición esporádica de casos.
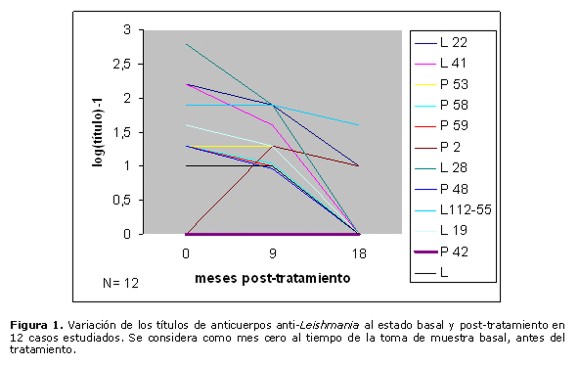
En la Figura 1 se expone gráficamente el comportamiento de los títulos de anticuerpos anti-Leishmania a través del tiempo en 12 pacientes, en quienes se realizó los controles de seguimiento a los 9 y 18 meses post-tratamiento. De estos 12 casos, 9 presentaron disminución notable de sus títulos con respecto al estado basal, es decir antes del tratamiento, llegando 8 de ellos a negativizar a los 18 meses. En el caso L112-55, la disminución de los valores fue apenas ligera. Un caso (P42) no evidenció presencia de anticuerpos en todo el estudio, y el caso P2, negativo al estado basal, sufrió un aumento del nivel de anticuerpos en el estudio practicado a los 9 meses post-tratamiento, para luego disminuir ligeramente a los 18 meses.
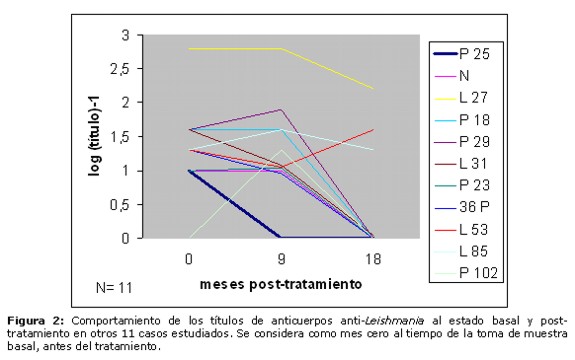
En la Figura 2 se observa la variación de los títulos de anticuerpos en otros 11 pacientes controlados a los 9 y a los 18 meses post-tratamiento. Uno de ellos llegó a negativizar en el control practicado a los 9 meses, y 7 negativizaron en el control realizado a los 18 meses de terminado el tratamiento, aunque uno de ellos (P102), no presentaba nivel detectable de anticuerpos al estado basal pero aumentó sus valores a los 9 meses. Los restantes 3 casos (L27, L53 y L85) mostraron un comportamiento irregular en sus niveles de anticuerpos anti-Leishmania.
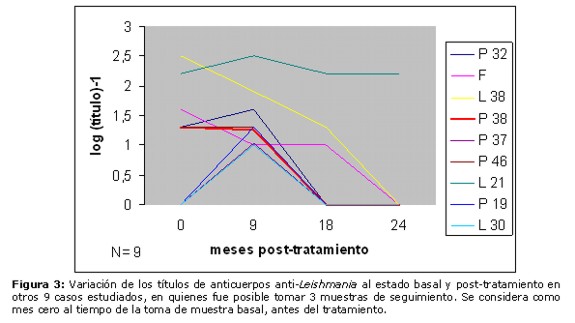
En la Figura 3 se observa el comportamiento de los títulos de anticuerpos en otros 9 casos, en quienes se realizó 3 tomas de muestras: a los 9, a los 18 y a los 24 meses post-tratamiento. Seis de estos casos negativizaron sus valores a los 18 meses (los casos L30, P19 y P37 habían sido negativos al estado basal). Otros 2 casos (L38 y F) fueron disminuyendo sus títulos hasta negativizar a los 24 meses post-tratamiento. El caso L21, sin embargo, permaneció con títulos relativamente elevados durante todo el estudio.
CONCLUSION
La experiencia que en general se tiene con el seguimiento de pacientes en áreas endémicas consiste en que la mayoría de los casos clínicamente curados presentan una disminución importante de los títulos con el avance del tiempo. Sin embargo, algunos investigadores del Brasil creen que este fenómeno no es uniforme y que pacientes con títulos persistentemente altos podrían tener alto riesgo de recidivas, aunque esta creencia no tiene ningún soporte científico10.
La escasa literatura existente referente a casos de seguimiento de pacientes con leishmaniosis se complica debido a que no existe una estandarización de los antígenos para serología, por lo tanto los resultados no siempre son reproducibles de un laboratorio a otro (observación personal del autor). Existe sólo una referencia basada en casos clínicos de leishmaniosis mucosa, donde se demuestra que la disminución de los títulos se asocia al aclaramiento o desaparición de antígenos en las lesiones11.
En el presente estudio, observamos que la gran mayoría de los sujetos (26 casos, correspondientes al 81% del total) han mostrado disminución de los títulos serológicos, llegando hasta la negativización 25 casos (78%). Por impedimentos logísticos, no se pudo continuar con este seguimiento por mayor tiempo. Tres casos que han permanecido con títulos altos al cabo de 18 o 24 meses (L21, L27 y L85, Figs. 3, 2 y 2, respectivamente) se deben a que son además individuos chagásicos, en que sus títulos prevalecen debido al fenómeno de la reacción cruzada Chagas-Leishmaniosis, que se explica por la conocida similitud entre los antígenos de Trypanosoma cruzi y Leishmania. En otros dos casos han prevalecido los títulos estables o con disminución ligera a través del tiempo: el paciente que presentó una nueva lesión después de 3 meses de finalizado su tratamiento (L112-55 de la Figura 1), que se atribuye asociado a una nueva picadura del vector por presentarse en zona distante del cuerpo, y el paciente que no curó de su lesión (L 53, Figura 2), posiblemente debido a la refractariedad al tratamiento. Cuatro individuos negativos al estado basal (P102 de la Figura 2 y P19, P37 y L30 de la Figura 3) han mostrado aumento de sus títulos serológicos, lo cual se explica que por la acción leishmanicida del medicamento se liberan grandes cantidades de antígenos, presentando luego negativización de sus valores. El caso P2, cuya variación de títulos se muestra en la Figura 1 (aumento seguido de ligera disminución), permanece inconcluyente. Se requeriría mayor tiempo de seguimiento para corroborar la tendencia de su nivel de anticuerpos, aunque el aumento inicial de los títulos se explicaría también por la liberación de antígenos debido al tratamiento.
Debido a la falta de literatura que muestre estudios similares, no podemos comparar estos resultados con otros. Sin embargo, podemos afirmar que el seguimiento serológico muestra valores que coinciden con la clínica de los pacientes, por lo tanto amerita que la serología sea llevada a cabo complementariamente al seguimiento clínico de los pacientes. Al no contar en este estudio con casos de reactivación cutánea o mucosa, no se puede concluir acerca del valor predictivo de la serología para estos casos.
AGRADECIMIENTOS
Expresamos nuestro agradecimiento a los funcionarios de puestos de salud de Capiibary y voluntarios que han colaborado en la convocatoria de los pacientes para su seguimiento. A la Dra. María Susana Leguizamón, del Departamento de Microbiología de la Universidad de Buenos Aires, quien gentilmente realizó los ensayos de inhibición de la transialidasa. Este trabajo ha sido posible con la financiación de UNDP/World Bank/WHO/TDR (Project ID 950889).
BIBLIOGRAFIA
1. Oddone R, Canese A, Jamjoon M, Nolder N, Miles MA, Noyes H. Genetic diversity among Paraguayan isolates of Leishmania braziliensis. Trans. R. Soc. Trop. Med. 2002; 96 (4): 364. [ Links ]
2. Servicio Nacional de Erradicación de Enfermedades Vectoriales (SENEPA, Ministerio de Salud Pública y Bienestar Social, Paraguay). Departamento de Estadística. Datos suministrados en el año 2006. [ Links ]
3.Behforouz N, Rezai HR, Gettner S. Application of immunofluorescence to detection of antibody in Leishmania infections. Ann Trop Med Parasitol 1976 Sep; 70 (3): 293-301. [ Links ]
4. Pappas MG, McGreevy PB, Hajkowski R, Hendricks LD, Oster CN, Hockmeyer WT. Evaluation of promastigote and amastigote antigens in the indirect fluorescent antibody test for American cutaneous leishmaniosis. Am J Trop Med Hyg 1983 Nov; 32 (6): 1260-7. [ Links ]
5. Romero GA, de la Gloria Orge Orge M, de Farias Guerra MV, Paes MG, de Oliveira Macedo V, de Carvalho EM.. Antibody response in patients with cutaneous leishmaniasis infected by Leishmania (Viannia) braziliensis or Leishmania (Viannia) guyanensis in Brazil. Acta Trop 2005 Jan; 93(1): 49-56. [ Links ]
6. Morán M, Kasamatsu E, Vera M, Maciel JD. Comportamiento sérico de anticuerpos IgG anti-Leishmania braziliensis de pacientes con leishmaniosis cutánea en Paraguay, pre y post tratamiento. Ann Rep IICS 1995: 59-71. [ Links ]
7. Oddone R, Canese A, Maciel JD, Velázquez GR, Meza T, Mendoza de Sánchez MG. Leishmaniasis tegumentaria: Sensibilidad de la inmunofluorescencia indirecta en pacientes con diagnóstico serológico. Mem Inst.Invest.Cienc.Salud 2005; 1 (1): 15-8. [ Links ]
8.Buchovsky AS, Campetella O, Russomando G, Franco L, Oddone R, Candia N, et al. Trans-sialidase inhibition assay, a highly sensitive and specific diagnostic test for Chagas' disease. Clin. and Diagn. Lab. Immunol. 2001 Jan; 8 (1), 187-9. [ Links ]
9. Camargo ME, Rebonato C. Cross reactivity in fluorescence tests for Trypanosoma and Leishmania antibodies. A simple inhibition procedure to ensure specific results. Am. J. Trop. Med. Hyg. 1969 Jul; 18 (4): 500-5. [ Links ]
10. Romero, GS. Universidad Federal de brasilia, Brasil. Comunicación personal del autor. Jul 2005. [ Links ]
11. Amato VS, Duarte MI, Nicodemo AC, de Carvalho LV, Pagliari C, da Matta VL et al. An evaluation of clinical, serologic, anatomopathologic and immunohistochemical findings for fifteen patients with mucosal leishmaniosis before and after treatment. Rev Inst Med Trop S Paulo 1998 Jan-Feb; 40(1): 23-30. [ Links ]
*Autor Correspondiente: Dr. Rolando Oddone
Instituto de Investigaciones en Ciencias de la Salud (IICS/UNA)
Teléfono:(595) 21 422069. Fax:(595) 21 480185
Email: roloddone@yahoo.com