Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Memorias del Instituto de Investigaciones en Ciencias de la Salud
versión On-line ISSN 1812-9528
Mem. Inst. Investig. Cienc. Salud v.4 n.1 Asunción jun. 2006
ARTICULO ORIGINAL
Evolución serológica y parasitológica post–tratamiento de pacientes con enfermedad de Chagas crónica reciente
Serologic and parasitologic evolution post–treatment of patients with recent chronic Chagas disease
*Vera de Bilbao NI, Elías EII, Martínez JIII, Carpinelli de Tomassone MIV, Torres SI, Sosa LV, Díaz VV
IInstituto de Investigaciones en Ciencias de la Salud, UNA Dpto.de Medicina Tropical
IIInstituto de Investigaciones en Ciencias de la Salud, UNA Dpto. de Inmunología Celular
IIIInstituto de Investigaciones en Ciencias de la Salud, UNA Dpto. de Medicina en Imágenes
IVInstituto de Investigaciones en Ciencias de la Salud, UNA Dpto.de Inmunología Humoral
VInstituto de Investigaciones en Ciencias de la Salud, UNA Dpto. de Análisis Clínicos
RESUMEN
Un estudio de prevalencia para anticuerpos anti–T.cruzi realizado por el Instituto de Investigaciones en Ciencias de la Salud en el año 1994 en 953 niños en edad escolar de zonas marginales de Asunción, dio resultados positivos en el 1,4% de los mismos por ELISA (Fracción IgG), y confirmados por una segunda prueba de ELISA (fracción IgG) e IFI (fracciones IgG e IgM).El estudio incluía como beneficio para los niños seropositivos el tratamiento, con el consentimiento escrito de sus padres y/o encargados. Cinco de éstos niños lo recibieron y se inició con benznidazol a una dosis de 5–7 mg/kg/día durante 60 días. Los resultados parasitológicos fueron negativos tanto en el estudio basal como en el post–tratamiento. Se realizó control serológico y parasitológico a los 6, 12, 18 y 24 meses post–tratamiento. Luego de 10 años post–tratamiento, el control serológico para Chagas de uno de los niños tratados registró resultados negativos por IFI (fracciones IgG e IgM) y ELISA (fracción IgG) y un segundo paciente, presentó una disminución de hasta tres títulos con respecto al valor basal. En otros dos niños, un caso presentó seroconversión negativa por IFI y el otro un descenso de hasta cuatro títulos con respecto al valor basal luego de 1 año post–tratamiento. A los 5 años post–tratamiento, una quinta paciente presentó un descenso de cinco títulos por ELISA y cuatro títulos por IFI. La disminución notable del título de anticuerpos en tres casos y dos seroconversiones negativas en otros, y las evaluaciones clínicas, en el pre y post–tratamiento; sin alteraciones, aportan datos favorables al tratamiento en pacientes con Enfermedad de Chagas Crónica Reciente.
Palabras claves: Trypanosoma cruzi, benznidazol, enfermedad de Chagas, tratamiento fase crónica reciente.
ABSTRACT
A seroprevalence study of Trypanosoma cruzi performed by the Instituto de Investigaciones en Ciencias de la Salud in 1994 in 953 children of surrounding areas of Asuncion showed 1.4% prevalence by ELISA (IgG fraction). The positive results were confirmed by another ELISA (IgG fraction) and IIF (IgG/IgM fractions). The study included as benefit the free treatment of the seropositive children previous written consent of their parents. Five of the children received treatment with benznidazole at 5–7mg/kg/day during 60 days under medical supervision with hematological, chemical and cardiological evaluations. Parasitological results were negative in the basal study and after treatment. Side effects were not observed during treatment. Serological and parasitological controls were made at 6, 12, 18 and 24 months post–treatment. After 10 years post–treatment, one of the treated children was negative by IIF (IgG and IgM fractions) and ELISA (IgG fraction). Another patient in the same post–treatment period presented a decrease of three titres. A third child presented negative seroconversion by IIF and another had a decrease of four titres after one year post–treatment. After five years of treatment, a fifth patient showed a decrease of five titres by ELISA and four titres by IIF. The remarkable decrease of the antibody titres in three cases and two cases of seroconversion together with the pre and post–treatment clinical evaluations without alterations are strong evidence in favor of the treatment of patients with recent chronic Chagas disease.
Keywords: Trypanosoma cruzi, Benznidazole, Chagas disease, treatment, recent chronic phase.
INTRODUCCIÓN
La enfermedad de Chagas constituye uno de los principales problemas de salud pública en las Américas y es causada por el parásito Trypanosoma cruzi a través del vector Triatoma infestans, en Paraguay.
En varios países, la experiencia de los investigadores ha demostrado que los niños tratados antes de los 12 años responden con una disminución de títulos que se observa mucho más rápidamente que en los adultos. Esto podría estar asociado, a una infección de pocos años de evolución y por ello se le ha asignado el nombre de "fase crónica reciente". La OMS y la OPS desean divulgar los nuevos conocimientos sobre el tratamiento y recomiendan su aplicación en países donde la enfermedad de Chagas ya se encuentra bajo control1.
El estudio de prevalencia para anticuerpos anti–T. cruzi realizado en 1994 en 953 niños en edad escolar de zonas marginales de Asunción, dio resultados positivos para la fracción IgG en el 1,4% de los mismos. Se consideró que estos niños se encontraban en la etapa crónica reciente de la enfermedad pues fueron sometidos a inspección clínica, electrocardiograma, ecocardiograma, radiografía de tórax y parasitemia directa sin hallazgos significativos compatibles con la enfermedad. Además de esto, el 90% de las madres de estos niños resultaron también positivas para la infección, el 61,5% de ellos no había vivido fuera de la periferia de Asunción y los que sí habían vivido o visitado áreas rurales endémicas no referían contacto con vinchucas. Ninguno había recibido transfusión de sangre, ni se habían encontrado triatominos o rastros de los mismos en sus viviendas. Probablemente la transmisión congénita fue la vía de infección para estos niños nacidos en Asunción2.
Este trabajo incluía, como beneficio y en sus consideraciones éticas, ofrecer a los niños seropositivos, tratamiento gratuito bajo consentimiento escrito de sus padres y/o encargados. Los padres de cinco niños aceptaron que sus hijos recibieran tratamiento. Como en nuestro país no se refieren datos sobre resultados de seroconversión negativa en el tratamiento de la Enfermedad de Chagas crónica en niños, consideramos oportuno dar a conocer nuestra experiencia en éste aspecto. Exponemos el caso, relevante por cierto, ya que uno de los mayores tropiezos en la evaluación del tratamiento de Chagas crónico en niños, es la falta de persistencia en los controles indicados a través de los años.
Se ha presentado la oportunidad de realizar la evaluación post–tratamiento después de varios años de seguimiento, pudiendo constatarse la seroconversión negativa en dos casos; y la reducción significativa del título de anticuerpos anti–T. cruzi en otros.
MATERIALES Y METODOS
Luego de la encuesta serológica realizada en las diversas escuelas de las zonas marginales de Asunción, se confirmaron los resultados positivos por la prueba de ELISA (IgG)3 e IFI (IgG e IgM)4, los niños positivos para anticuerpos anti–T. cruzi, fueron sometidos a inspección clínica, electrocardiograma, ecocardiograma y radiografía de tórax, como así también de estudios parasitológicos correspondientes.
En cuanto a las consideraciones éticas, fueron informados de sus resultados en forma confidencial y con el consentimiento por escrito de los padres, luego de la información sobre el tratamiento, se dio inicio al mismo; con benznidazol en una dosis de 5–7mg/kg/día por 60 días, bajo estricto control médico.
El diseño experimental, de series temporales, incluía la evaluación basal, el tratamiento y la evaluación post–tratamiento en niños con serología positiva para anticuerpos anti–T.cruzi que resultaron del estudio de prevalencia en zonas marginales de Asunción. Se siguió el esquema de referencia, implementado en el departamento de nuestra Institución para el tratamiento en niños hasta 12 años5, con evaluaciones hematológicas y químicas, un control hematológico a los 10 días de iniciado el tratamiento para el control de glóbulos blancos y plaquetas.
Para la evaluación hematológica se realizó hemograma y para la evaluación química, se incluyeron las enzimas alanino amino transferasa (ALT), aspartato amino transferasa (AST), bilirrubina total, directa e indirecta, así como también la urea y creatinina. Estos estudios se realizaban en la etapa basal y a los 20 días post–tratamiento, a fin de evidenciar efectos secundarios con el tratamiento.
Se realizó un seguimiento serológico y parasitológico, a los 6,12, 18 y 24 meses post–tratamiento o al menos una vez al año luego de finalizado el tratamiento. Así como controles clínicos, cardiológicos y radiografía de tórax. El control parasitológico se realizó a través de la parasitemia directa, con el método descrito por Freilij et al (1983) y modificado por Arias y Ferro (1988) a fin de detectar los parásitos en sangre6,7.
Para la determinación del ELISA para Chagas, se utilizó un kit desarrollado y producido en el Instituto de Investigaciones en Ciencias de la Salud (IICS), teniendo en cuenta las recomendaciones de la Pan American Health Organization (PAHO) y de la Organización Mundial de la Salud (OMS)3.
La Inmunoflorescencia Indirecta se realizó con epimastigotes enteros de la cepa Y como lo describió previamente Camargo4.
RESULTADOS
Nos referiremos en primer lugar al caso de seroconversión negativa que corresponde a un niño que inició el tratamiento con benznidazol a los nueve años, proveniente de un barrio periférico de Asunción y nacido en esta ciudad.
El paciente mantuvo un nivel de anticuerpos relativamente invariable (1/80 a 1/160), por ELISA e IFI (IgG) y no se registraron variaciones significativas en el título de los mismos hasta 2 años post–tratamiento. En cuanto a la fracción IgM por IFI dio resultado negativo en todas las evaluaciones. La medicación no presentó reacciones secundarias de consideración, en la primera semana, el niño manifestó cefalea y nauseas que disminuyeron en el transcurso del tratamiento.
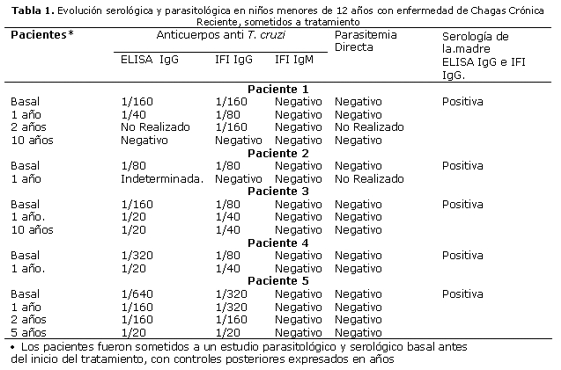
A los 10 años post–tratamiento del control serológico, se registraron resultados negativos por IFI en las fracciones IgG e IgM, como así también por el método de ELISA en la fracción IgG. El control parasitológico, realizado a través de parasitemia directa, fue negativo en todas las etapas (tabla 1, paciente 1). Cabe destacar que fue posible realizar serología para Chagas a la madre y a la abuela del caso referido, resultando ambas con serología positiva para la enfermedad.
Otro caso de seroconversión negativa, es el de una paciente de sexo femenino, nacida en Asunción, de madre seropositiva para la enfermedad de Chagas, la cual presentó, más rápidamente que el caso anterior, la mencionada seroconversión. Inició el tratamiento a los 11 años de edad, presentando resultados positivos para los dos estudios serológicos realizados: ELISA e IFI con la fracción IgM negativa y parasitemia directa negativa (tabla 1, paciente 2). Al cabo de un año en el control post–tratamiento, resultó negativa la IFI en sus dos fracciones IgG e IgM y el ELISA con resultado indeterminado, o sea con un valor cercano al punto de corte establecido en el procedimiento de este kit3.
Las evaluaciones cardiológicas, hematológicas, químicas y clínicas no presentaron alteraciones.
Con respecto a la disminución significativa de los títulos de anticuerpos mencionada en otros niños de este grupo de tratados que se encontraban en la fase crónica reciente y siguieron su control posterior, podemos mencionar los siguientes casos: Dos hermanos, de 9 y 11 años de edad, de sexo masculino, nacidos en Asunción, y residentes en ésta ciudad presentaron resultados positivos basales con títulos elevados de anticuerpos anti–T. Cruzi. En el control post–tratamiento luego de 10 años, uno de ellos registró una variación en el título de 1/160 en el basal a 1/20 en el post tratamiento. En el otro hermano se detectaron niveles bastante disminuidos de 1/320 en el basal a 1/20 en un año post–tratamiento (tabla 1, pacientes 3 y 4). La madre de estos niños también resultó serológicamente positiva para T. cruzi.
Finalmente, una paciente, de sexo femenino, nacida en Ybycuí, Departamento de Paraguari; zona endémica de nuestro país (a pesar de no provenir de Asunción fue incluida en el grupo, pues presentó también una notoria disminución de anticuerpos) y con nueve años de edad al inicio del tratamiento; después de cinco años de control post–tratamiento pudo constatar una disminució en el título de anticuerpos de 1/640 en el basal a 1/20 en el post tratamiento (tabla 1, paciente 5). La madre de esta niña también presentó serología positiva para T. cruzi.
A los pacientes 3, 4 y 5 también se les realizó la prueba de parasitemia directa, resultando negativa en todas las etapas de sus controles correspondientes, como así también la fracción IgM por IFI resultó negativa en todas las etapas de control. Estos pacientes, no recibieron transfusión sanguínea y no se registró presencia de vinchucas en su vivienda.
En cuanto a las evaluaciones electrocardiográficas y ecocardiográficas de estos pacientes, no presentaron anomalías compatibles con la enfermedad de Chagas. Uno de los pacientes de 9 años de edad presentó morfología de bloqueo de rama derecha en el electrocardiograma, pero en la ecocardiografía Doppler no se evidenciaron alteraciones.
DISCUSIÓN
Algunos estudios de investigación han mostrado que, cuando el seguimiento a pacientes tratados en la fase crónica de la enfermedad de Chagas se hace por un tiempo suficientemente largo, no se observa conversión negativa de la serología en los primeros años pero si en periodos mucho más largos de 10 a 20 años8,9.
La variabilidad en los hallazgos depende del tiempo de seguimiento, tiempo que se mide en meses cuando el tratamiento se hizo en la fase aguda, en años cuando se hizo en la fase crónica temprana y en décadas en aquellos tratados durante la fase crónica tardía.
Los niños tratados de este estudio se encontraban en la fase crónica reciente pues la parasitemia directa se encontraba negativa en el estudio basal y en todas las etapas del seguimiento, lo mismo que la fracción IgM de la Inmunofluorescencia Indirecta. Tampoco presentaron alteraciones en las evaluaciones cardiológicas tanto en el electrocardiograma como en la ecocardiografía Doppler.
Todos estos niños tienen en común la serología positiva de las madres, por lo que se puede considerar como principal vía de transmisión la congénita, pues los niños no habían recibido transfusión sanguínea y no se registró presencia de vinchucas en sus viviendas. Solo la paciente 5 nació en zona endémica.
En el paciente 1, se pudo realizar serología a la madre y la abuela del mismo, resultando ambas positivas para la Enfermedad de Chagas, abriendo así, la posibilidad de una transmisión congénita de tercera generación.
En dos pacientes, se pudieron realizar las evaluaciones serológicas y parasitológicas luego de 10 años post–tratamiento, lo cual es poco frecuente, pues los pacientes no tienen persistencia en los controles indicados, cuando el tiempo requerido es prolongado. En uno de ellos se observó seroconversión negativa y en otro, una disminución notoria en el título de anticuerpos al año del tratamiento; mientras que en la paciente 5 se observó la misma disminución, pero luego de 5 años de control. El paciente 4 solo acudió hasta un año luego del tratamiento, no pudiendo constatarse una posible seroconversión.
El objetivo del control seriado sobre la concentración de anticuerpos en pacientes tratados durante la fase crónica, es buscar una tendencia a la negativización de los títulos de anticuerpos. Para evaluar esa tendencia, se necesita hacer seguimiento a estos pacientes durante varios años. Si se parte de la premisa de que el nivel de anticuerpos es constante, su disminución sostenida indicaría que alguna causa externa ha influido, por ejemplo, el medicamento. Para poder hablar de disminución de títulos, en general se exige que haya habido una disminución de por lo menos tres títulos en relación al título inicial10.
La persistencia de valores de anticuerpos, si ya el parásito no está presente, podría deberse a la presencia de anticuerpos especie específicos y a la posibilidad de incorporación de fragmentos del parásito al ADN de los tejidos del huésped o a la reacción autoinmune a tejidos del huésped con secuencias reconocidas por los anticuerpos11,12.
En general, los niños tratados en nuestro estudio no presentaron efectos adversos a la medicación y presentaron buena tolerancia.
Estos resultados son prometedores con respecto a la disminución notable de los títulos de anticuerpos en unos y la seroconversión negativa en otros; como así también se constató en el trabajo realizado en dos comunidades de Paraguarí de nuestro país en donde se obtuvieron disminuciones significativas en las densidades ópticas en el test de ELISA para anticuerpos anti– T. cruzi de los niños en etapa crónica, tratados con benznidazol, después de 2 años de seguimiento13.
Uno de los objetivos principales en la implementación del tratamiento para Chagas es impedir la aparición de lesiones en los órganos o el agravamiento de los ya presentes, como así también eliminar al parásito. Varios investigadores demostraron un mayor potencial en la evolución de la cardiopatía (ECG) en los grupos control o que recibieron placebo con respecto a los grupos que recibieron benznidazol en el tratamiento de la fase crónica de la enfermedad de Chagas14,15,16.
Según recomendaciones de la OPS y OMS, cada país debe formular un plan nacional de tratamiento para la enfermedad de Chagas y como requisito fundamental dicho plan se debe enmarcar en un programa nacional de control de la Enfermedad de Chagas, que garantice la implementación de medidas para la interrupción de la transmisión vectorial y transfusional del T. cruzi. Por lo tanto, sin la existencia de tales medidas es difícil justificar el tratamiento de personas infectadas con T. cruzi, salvo caso de Chagas agudo o transmisión congénita17.
La disponibilidad de medicamentos difiere de país a país, el sector salud necesita crear mayores vínculos con las compañías farmacéuticas y demostrar el mercado potencial que se presenta ante las nuevas recomendaciones de tratamiento1. Considerando el bajo poder adquisitivo de la mayoría de los infectados, se deben estimular mecanismos de distribución de medicamentos en forma oportuna y a bajo costo para que los infectados los puedan comprar. En caso contrario, los fármacos deberán ser provistos por el Estado. Los análisis de costo–beneficio en diferentes países demuestran que por cada dólar invertido en prevención, se ahorran entre 11 y 17 dólares en el manejo y tratamiento de los pacientes en la fase crónica de la enfermedad de Chagas18,19.
AGRADECIMIENTO
A la Dra. Marisel Maldonado, por la revisión del trabajo; al Sr. Elvio Benítez y a la Sra. Benjamina Rivarola por su colaboración en el desarrollo del trabajo.
BIBLIOGRAFIA
1. OPS–OMS. Tratamiento Etiológico de la Enfermedad de Chagas: conclusiones de una Consulta Técnica. Río de Janeiro: La Organización, Fundación Oswaldo Cruz; 1998. [ Links ]
2. Vera N, Maldonado M, Yaluff G, Simancas L, Rojas de Arias A. Seroprevalence and Socio–Cultural Conditionants of Chagas disease in school aged children of marginal zones of Asunción. Revista da Sociedade Brasileira de Medicina Tropical 1998; 31:347–53. [ Links ]
3. Kaspar P, Velázquez G, Monzón M, Meza T, Vera M, Pozzoli L, et al. Evaluation on a new anti–T.cruzi antibody ELISA kit. Mem Inst Oswaldo Cruz 1988; 83:125. [ Links ]
4. Camargo M. Fluorescent antibody test for the serodiagnosis of American Trypanosomiasis. Technical modification employing preserved cultured forms of T.cruzi in a slide test. Rev Inst Med Trop Sao Paulo 1966 (8):227–69. [ Links ]
5. Rassi A, Luquetti AO. Therapy of chagas disease. En: Wendel S, Brener Z, Camargo ME, Rassi A. Chagas disease (American Trypanosomiasis): Its impact on transfusion and clinical medicine. Sao Paulo: International Society of Blood Transfusion; 1992. p. 237–47. [ Links ]
6. Freilij H, Muller L, González Cappa AS. Direct diagnostic micromethod for acute and congenital Chagas disease. J Clin Microbiol 1983; 18:277–90. [ Links ]
7. Arias A, Ferro E. Quantification of parasitemia by direct micromethod in T.cruzi infection. Trans Royal Soc Trop Med Hyg 1988; 82: 248. [ Links ]
8. Ferreira HO. Tratamento da forma indeterminada da doenca de Chagas con nifurtimox e benznidazol. Rev Soc Bras Med Trop 1990; 23: 209–11. [ Links ]
9.Galvao, LMC, Nunes RMB, Cancado JR, Brener Z, Krettli AU. Lytic Antibody Titre as a means of assesing cure after treatment of Chagas Disease: a 10 years follow–up study. Trans Roy Soc Trop Med Hyg 1993; 87:220–3. [ Links ]
10. Luquetti AO, Rassi A. Tratamiento específico de la Enfermedad de Chagas en la fase crónica: criterios de cura convencionales: xenodiagnóstico, hemocultivo, serología. Rev Patol Reg 1998; 27(Supl):37–50. [ Links ]
11. Fernandes LC, Bastos IM, Lauria–Pires L, Rosa AC, Teixeira AR, Grellier P, et al. Specific human antibodies do not inhibit Trypanosoma cruzi Oligopeptidase B and Cathepsin B, and immunoglobulin G enhances the activity of Trypomastigote secreted Oligopeptidase B. Microbes Infect 2005 Mar;7(3):375–84. [ Links ]
12. Gazzinelli RT, Galvao LM, Krautz G, Lima PC, Cancado JR, Scharfstein J, et al. Use of Trypanosoma cruzi purified glycoprotein (GP57/51) or trypomastigote–shed antigens to asses cure for human Chagas´disease. Am J Trop Med Hyg 1993; 49:625–35. [ Links ]
13. Vera de Bilbao N, Samudio M, Schinini A, Acosta N, López E, González N, et al. Evaluación a 24 meses post–tratamiento con benznidazol en niños de 6 a 12 años infectados con Trypanosoma cruzi. Revista de Patología Tropical 2004; 33(3):301–12. [ Links ]
14. Viotti R, Vigliano C, Armenti H, Segura E. Treatment of chronic Chagas disease with benznidazol: clinical and serologic evolution of patients with long–term follow–up. Am Heart J 1994; 127:151–62. [ Links ]
15. Fragata Filho A, Boianain E, Silva MAD, Correia EB, Borges Filho R, Martins C, et al. Validade do tratamento etiológico da fase crónica da Doenca de Chagas com benznidazol. Arq Bras Cardiol. 1995; 65(supl I):71. [ Links ]
16. Andrade ALSS, Zicker F, Oliveira RM, Silva SA, Luquetti AO, Travassos LR, et al. Randomized trial of efficacy of beznidazol in treatment of early Trypanosoma cruzi infection. Lancet 1996; 348: 1407–13. [ Links ]
17. Moncayo A. Progress towards the elimination of transmission of Chagas disease in Latin America. World Health Stat Q.1997; 50 (3–4):195–8. [ Links ]
18. OPS–OMS. Recomendaciones En: Tratamiento Etiológico de la Enfermedad de Chagas: conclusiones de una Consulta Técnica. Río de Janeiro: La Organización, Fundación Oswaldo Cruz; 1998.p. 21–3. [ Links ]
19. Akhavan D. Análise de custo–efectividade do programa de controle da doenca de Chagas no Brasil: Resumo executivo. 1996. [ Links ]
*Autor Correspondiente: Dra. Ninfa Vera de Bilbao
Dpto. de Medicina Tropical, Inst. Inves. Ciencias de la Salud
Rio de la Plata y Lagerenza. CC: 2511. Asunción-Paraguay
E-mail: nverabilbao@hotmail.com