Serviços Personalizados
Journal
Artigo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares em
SciELO
Similares em
SciELO
Compartilhar
Memorias del Instituto de Investigaciones en Ciencias de la Salud
versão On-line ISSN 1812-9528
Mem. Inst. Investig. Cienc. Salud v.3 n.1 Asunción dez. 2005
ARTICULO ORIGINAL
Leishmaniasis tegumentaria: sensibilidad de la inmunofluorescencia indirecta en pacientes con diagnóstico parasitológico
Tegumentary leishmaniasis: sensitivity of the indirect immunofluorescent assay in patients with parasitological diagnosis
Oddone RI; Canese AII; Maciel JDIII; Velázquez GRI; Meza TI; Mendoza de Sánchez MGIV
IInstituto de Investigaciones en Ciencias de la Salud, Asunción, Paraguay
IILaboratorio Central de Salud Pública (MSP y BS), Asunción, Paraguay
IIIInstituto de Medicina Tropical (MSP y BS), Asunción, Paraguay
IVAnátomo–patóloga de piel y boca, Asunción, Paraguay
RESUMEN
La leishmaniasis tegumentaria es una zoonosis endémica de zonas tropicales y subtropicales del mundo, de difícil diagnóstico laboratorial. En áreas endémicas se realiza el diagnóstico de presunción basado en la presentación clínica y la reactividad a la prueba cutánea de la leishmanina. Sin embargo, un diagnóstico definitivo de la enfermedad requiere la combinación de diferentes métodos, entre los cuales la inmunofluorescencia indirecta (IFI) es uno de los más utilizados. Para determinar la sensibilidad de la IFI, se sometió un total de 95 pacientes con lesiones comprobadas de leishmaniasis a las pruebas de leishmanina, biopsia histopatológica, cultivo e IFI. En 80 pacientes se logró el diagnóstico parasitológico a través de la histopatología y/o el cultivo. De ellos, 58 muestras (72,5%) dieron reacción positiva en la IFI para Leishmania, aunque 12 de ellas (21%) también mostraron serología positiva para enfermedad de Chagas. La sensibilidad de la IFI para los casos de leishmaniasis mucosa solamente fue 81,3% (n=16). Se concluye que la IFI es un método de moderada sensibilidad para el diagnóstico de leishmaniasis tegumentaria.
Palabras claves: Leishmaniasis tegumentaria, Inmunofluorescencia, Diagnóstico, Sensibilidad.
ABSTRACT
Tegumentary leishmaniasis is an endemic zoonosis of tropical and subtropical areas of the world. Diagnosis of this illness is difficult even using laboratorial methods. In endemics areas a presumptive diagnosis is carried out based on the clinical presentation and reactivity to the skin test. However, a definitive diagnosis of the illness requires the combination of different methods, such as the indirect immunofluorescence assay (IIF), one of the most used methods. In order to determine the sensitivity of the IIF, a total of 95 patients with proven lesions of leishmaniasis were subjected to skin test, histopathology, culture and IIF. Parasitological diagnosis was achieved in 80 patients through histopathology and/or culture. Fifty–eight samples of them (72.5%) gave positive reaction by the IIF although 12 of them (21%) also showed positive serology for Chagas disease. The sensitivity of the IIF for mucosal leishmaniasis only was 81.3% (n=16). We concluded that IIF has moderate sensitivity for the diagnosis of tegumentary leishmaniasis.
Keywords: Tegumentary leishmaniasis, Indirect immunofluorescent assay, Diagnosis, Sensitivity.
INTRODUCCION
La leishmaniasis tegumentaria (LT) constituye una zoonosis endémica de las regiones tropicales y subtropicales del mundo. Es causada por protozoarios del género Leishmania y trasmitida en las Américas por insectos del género Lutzomyia. En los hombres ocasiona lesiones en piel con metástasis en mucosas de las vías aéreas superiores, que se manifiestan de diversas maneras. En áreas endémicas se realiza el diagnóstico de presunción en base a la presentación clínica y la reactividad a la prueba cutánea de la leishmanina1. Sin embargo, el diagnóstico no es fácil y requiere la combinación de diversos métodos, que muchas veces no están al alcance de los recursos económicos de los pacientes.
La inmunofluorescencia indirecta con antígeno crudo de Leishmania (IFIL) es uno de los métodos serológicos más utilizados, cuya cuantificación se correlaciona bien con el grado de extensión de la infección, aunque los títulos de anticuerpos no suelen ser altos2. No existe hasta el momento un consenso sobre la utilidad de este método como diagnóstico de la LT. Los estudios de sensibilidad de esta técnica en otros países revelan resultados que van desde el 66,6%3 hasta el 82%4, pasando por el 77,2%5, y por el 79,6%6 y una sensibilidad del 60% en un estudio publicado anteriormente en Paraguay7. Recientemente se ha publicado la primera comparación sistemática de la respuesta de anticuerpos en pacientes infectados con L. (V.) braziliensis con pacientes infectados con L. (V.) guyanensis en Brasil6.
La reacción no es específica para los anticuerpos anti–Leishmania, pues da reacción cruzada con sueros de pacientes con Enfermedad de Chagas, lupus eritematoso, malaria, toxoplasmosis, amebiasis, paracoccidiomicosis4,5, e inclusive con tuberculosis pulmonar3. Se han diseñado otros sistemas de IFIL con antígenos purificados8, pero en desmedro de la sensibilidad de la prueba.
MATERIALES Y METODOS
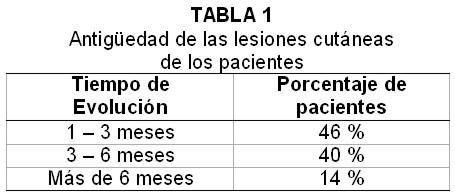
Se seleccionaron los sueros de 80 pacientes en los que se logró el diagnóstico parasitológico a través de la biopsia histopatológica y/o el cultivo en medio Novy, McNeal & Nicolle, más 15 sueros de otros pacientes en los que se demostró, a través de la biopsia histopatológica, una histología compatible con LT, totalizando así 95 sujetos con LT comprobada. De ellos, 79 (83%) eran pacientes con lesiones cutáneas y los 16 restantes (17%) con lesiones mucosas. La antigüedad de las lesiones cutáneas al tiempo de la toma de muestra de sangre se muestra en la Tabla 1. El suero de todos los pacientes se mantuvo congelado a–20°C hasta un máximo de 2 meses para su análisis.
Prueba de IFIL: Para la preparación del antígeno, se utilizaron promastigotes de Leishmania braziliensis cultivados en medio RPMI 1640 suplementado con suero fetal bovino al 20% y antibióticos. Los parásitos fueron colectados por centrifugación de los cultivos y fijados enteros en portaobjetos con círculos de 0,5 cm apropiados para la reacción (técnica de Camargo9).
Conjugado:Antigammaglobulina IgG humana, proveniente de conejo, marcada con fluoresceína (Biomerieux, Francia).
Los sueros fueron diluidos con PBS pH 7,2, realizando diluciones seriadas al doble (1:10, 1:20, 1:40, 1:80, etc.). Las muestras fueron corridas con un control positivo de paciente con diagnóstico parasitológico, y un control negativo. Para este estudio se tuvieron en cuenta aquellas muestras positivas a partir de títulos 1:20.
Microscopio: Nikon modelo 1985 de epiiluminación, con lámpara UV HBO50.
Criterio de lectura: Positivo cuando al menos el 50% de los parásitos presentan fluorescencia verde brillante, y negativo cuando el parásito muestra coloración roja solamente. Todas las muestras para IFIL se procesaron en el Laboratorio Central de Salud Pública (MSP y BS, Asunción).
Serología para Chagas: Se realizó en todas las muestras por dos métodos: inmunofluorescencia indirecta con antígeno crudo de T. Cruzi, y ELISA con el Chagas–ELISA kit del IICS (Paraguay).
Biopsia histopatológica: Las muestras fueron tomadas de las lesiones activas con sacabocados de 4 mm de diámetro (lesiones cutáneas) o con pinza otorrinolaringológica para biopsia (lesiones mucosas) y fijadas en formol al 10%. Las muestras fueron procesadas y visualizadas en el laboratorio de la Dra. Gloria Mendoza de Sánchez.
Cultivo para Leishmania:Muestras de biopsia tomadas de igual manera como indicadas más arriba fueron sembradas asépticamente en tubos de cultivo con medio N,N,N y visualizadas en microscopio invertido semanalmente hasta las 4 semanas de inoculación.
RESULTADOS
Considerando estrictamente los 80 pacientes con diagnóstico parasitológico de LT, 58 muestras (72,5%) dieron reacción positiva en la IFI para Leishmania, a partir de diluciones 1:20, aunque 12 de ellas (21%) mostraron resultados positivos para enfermedad de Chagas.
Veinte sueros dieron serología positiva para Chagas por ELISA o por IFI. Descartando estos casos y considerando los 75 restantes con LT libres de posibilidad de Chagas, hemos encontrado que 53 (70,7%) dieron reacción positiva en la IFIL.
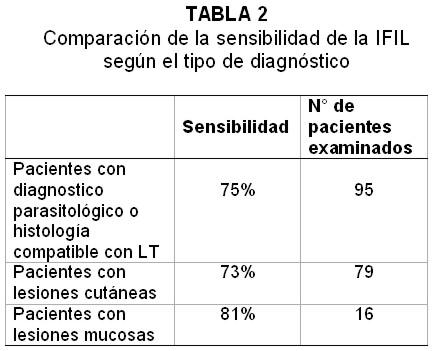
De los 95 pacientes con LT (diagnóstico parasitológico o histología compatible), 71(74,7%) dieron positivo en la IFIL. Tomando en cuenta solamente los 79 pacientes con lesiones cutáneas, 58 de ellos (73,4%) dieron reacción positiva. Considerando solamente los 16 casos con lesiones mucosas, 13 de ellos (81,3%) fueron positivos (Tabla 2).
DISCUSION
La sensibilidad de la IFIL en este estudio sobre casos paraguayos, aunque moderadamente buena, no difiere de los realizados en otros países. Los resultados se basan en la determinación de anticuerpos del tipo IgG, puesto que en los casos en que se ha determinado anticuerpos del tipo IgM (resultados no mostrados), los valores fueron casi siempre negativos, aún para lesiones recientes. Como se esperaría de un cuadro más avanzado, se observa que la sensibilidad de la IFIL en LT con lesiones mucosas es mayor que en lesiones cutáneas, aunque no más del 10%. Este resultado coincide con los de otros trabajos publicados en Brasil10,11. En caso de la enfermedad cutánea, no existe aumento significativo de la sensibilidad con relación al tiempo de evolución de las lesiones. Además, ante la posibilidad de que la presencia de eventuales casos de doble infección Chagas–leishmaniasis pudiera provocar un falso aumento de la sensibilidad de la IFIL, se han considerado en este estudio 75 muestras con serología negativa para chagas, encontrándose en este caso una sensibilidad del 70,7%, que no tiene una diferencia significativa con el 74,7% de sensibilidad encontrada en el grupo mayor. Se concluye que la IFIL es un método de moderada sensibilidad para el diagnóstico de leishmaniasis tegumentaria, tanto en su forma cutánea como en la mucosa.
Agradecimientos: Este trabajo ha sido posible con la financiación de UNDP/World Bank/WHO/TDR (Project ID 950889).
REFERENCIAS
1.Grimaldi, G Jr and Tesh, RB. Leishmaniasis of the New World: Current concepts and implications for future research. Clin Microbiol Rev 1993; 6 (3): 230–50. [ Links ]
2.Behforouz N, Rezai HR, Gettner S. Appliction of immunofluorescence to detection of antibody in Leishmania infections. Ann Trop Med Parasitol 1976; 70 (3): 293–301. [ Links ]
3.Mantossian RM. Circulating antibodies in cutaneous leishmaniasis: their detection by immunofluorescence. Trans R Soc Trop Med Hyg 1975; 69 (5–6): 450–2. [ Links ]
4.Pappas MG, McGreevy PB, Hajkowski R, Hendricks LD, Oster CN, Hockmeyer WT. Evaluation of promastigote and amastigote antigens in the indirect fluorescent antibody test for American cutaneous leishmaniasis. Am J Trop Med Hyg 1983; 32 (6): 1260–7. [ Links ]
5.Guimaraes MC, Celeste BJ, Corrales EM, Antunes CM. 1991. Comparision on the performance of Leishmania major–like and leishmania braziliensis braziliensisas antigen for New World leishmaniasis IgG–immunofluorescence test. Rev Inst Med Trop Sao Paulo 1991; 33 (6): 503–8. [ Links ]
6.Sierra Romero GA, Orge MG, de Farias MV, Paes MG, de Oliveira V, de Carvalho, EM. 2005. Antibody response in patients with cutaneous leishmaniasis infected by Leishmania (V.) braziliensis or Leishmania (V.) guyanensis in Brazil. Acta Trop 2005; 93:49–56. [ Links ]
7.Morán M, Kasamatsu E, Vera M, Maciel JD. 1996. Comportamiento sérico de anticuerpos IgG anti–Leishmania braziliensis de pacientes con leishmaniasis cutánea en Paraguay, pre y post tratamiento. Ann Rep IICS 1995:59–71. [ Links ]
8.Silveira TG, Kemmelmeier C. Leishmania braziliensis: isolation of carbohydrate–containing antigen and possibility of its use in the immunodiagnosis of American cutaneous leishmaniasis. Rev Inst Med Trop Sao Paulo 1995;37(3):245–52. [ Links ]
9.Camargo ME, Rebonato C. Cross reactivity in fluorescence test fot Trypanosoma and Leishmania antibodies. Am. J. Trop. Med. Hyg. 1972;18(4). [ Links ]
10.Cuba CA, Marsden PD, Barreto AC, Roitman I, Vexenat A, de Lima LM, et al. Human mucocutaneous leishmaniasis in Três Braços, Bahia–Brazil. An area of Leishmania braziliensis transmission. I. Laboratory diagnosis. Rev Soc Bras Med Trop 1984;17:161–167. [ Links ]
11.Valli LC, Passos VM, Dietze R, Callahan HL, Berman JD, Grogl M. Humoral immune responses among mucosal and cutaneous leishmaniasis patients caused by L. braziliensis. J. Parasitol. 1996;85:1076–1083. [ Links ]