Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Memorias del Instituto de Investigaciones en Ciencias de la Salud
versión On-line ISSN 1812-9528
Mem. Inst. Investig. Cienc. Salud v.2 n.1 Asunción 2003
ARTICULO ORIGINAL
Respuesta inmune a una vacuna oral (CVD 103 HGR-BERNA -SUIZA) contra el cólera en voluntarios paraguayos
Immune response to an oral vaccine (CVD 103 HGR - BERNA -SWITZERLAND) against cholerain paraguayan volunteers
*Leguizamón MAI Cabello MAI, Carpinelli MMI, Cabral MBI, Elías EI, Laspina FI, Ruiz AI, Pérez Quiñoy JLII, Pino YII
IInstituto de Investigaciones en Ciencias de la Salud, (IICS), Asunción, Paraguay IIInstituto Finlay, La Habana, Cuba
RESUMEN
El cólera continúa siendo un importante problema de salud pública en países en vías de desarrollo. En 1.998, más de 1.000.000 de casos fueron notificados en América Latina. Paraguay ha reportado cuatro casos hasta ahora. La epidemia ha enfocado la atención al desarrollo de una vacuna segura, efectiva y de larga duración. Una vacuna oral viva atenuada, la CVD 103 HgR (serotipo Inaba, biotipo Clásico, Berna-Suiza) ha sido licenciada en varios países, incluido el Paraguay. Este estudio fue desarrollado para evaluar la seguridad e inmunogenicidad de la vacuna CVD 103-HgR en voluntarios paraguayos. Cuarenta voluntarios adultos, sanos, fueron reclutados en Asunción-Paraguay para recibir una dosis oral (2-6 x 10cfu) de la vacuna CVD 103-HgR. Las muestras de sueros fueron obtenidas antes de la vacunación, a los 15 y a los 30 días después de la misma. Se midieron los niveles de inmunoglobulinas IgG, IgA e IgM de los voluntarios, los anticuerpos vibriocidas y los anticuerpos anti-LPS. La vacuna fue bien tolerada y so se observó enfermedad diarreica en el estudio. Veintisiete (67.5%) de los 40 voluntarios desarrollaron anticuerpos vibriocidas. Ninguno tuvo títulos iniciales, 8 (20%) tuvieron títulos recíprocos de 320 y sólo 5 (12.5%) alcanzaron títulos iguales o mayores que 5.120. En la medición de los anticuerpos anti-LPS no hubo respuesta significativa. Este es el primer estudio sobre evaluación de una vacuna oral contra el cólera. Estos resultados muestran que los voluntarios paraguayos desarrollan respuesta de anticuerpos vibriocidas. Esta vacuna podría ser efectiva contra el cólera en nuestro país.
Palabras claves: Vibrio cholerae, vacuna oral, anticuerpos vibriocidas, voluntarios paraguayos.
ABSTRACT
Cholera remains as an important public health problem in underdeveloped countries. In 1998, more than 1,000,000 cases were notified in Latin America. Paraguay has reported four cases until now. The epidemic has focused the attention to the development of a safe, effective and long lasting cholera vaccine. A live oral attenuated CVD 103-HgR (Inaba serotype, Classical biotype) has been licensed in several countries, including Paraguay. To evaluate the safety and immunogenicity of CVD 103-HgR in Paraguayan volunteers, an study was performed. Forty healthy adults, were recruited in Asuncion, Paraguay to receive a single oral dose (2-6 x 109 cfu) of CVD103-HgR). Serum samples were obtained before, 15 and 30 days alter vaccination. The level of IgG, IgA and IgM antibodies was measured in serum of the volunteers as well as the level of vibriocidal and anti-LPS antibodie. The vaccine was well tolerated and no diarrhea illness was observed in the study. Twenty seven (67.5%) of the 40 volunteers developed serum vibriocidal antibodies. None had vibriocidal titers at baseline, eight (20%) had a reciprocal titer of 320 and only five (12.5%) reached titers equal or higher than 5,120. In the measurement of anti-LPS antibodies, there were not significative results. This is the first study of evaluation of an oral vaccine against cholerae. These results show that the Paraguayan volunteers developed a vibriocidal antibody response. This vaccine could be effective against cholera in our country.
Keywords:Vibrio cholerae, oral vaccine, vibriocidal antibodies, Paraguayan volunteers.
INTRODUCCION
El cólera es una de las infecciones entéricas que ha incidido más drásticamente en la salud de la población mundial y que continúa azotando a muchos países, en especial a los del mundo en desarrollo (1). El principal agente causal es el Vibrio cholerae O1 que posee dos biotipos, Clásico y El Tor y dos principales serotipos: Inaba y Ogawa (2).
La enfermedad es causada fundamentalmente por la acción de la toxina de cólera, que provoca a través de un complejo mecanismo bioquímico, un aumento de la secreción de electrolitos y pérdida de fluido en el intestino delgado a través de la acción de la adenil-ciclasa (3). En su forma más severa, desencadena una diarrea con apariencia de agua de arroz, pero además, se pueden presentar otros síntomas tales como: cefalea, dolores abdominales, meteorismo, vómitos, fiebre y deshidratación, que puede conducir al colapso circulatorio en los enfermos extremadamente graves (4).
La pandemia actual se caracteriza por el aislamiento predominante de cepas del biotipo El Tor. Gran número de antígenos están involucrados en la patogenia de esta enfermedad. Dentro de los más estudiados se encuentran: la toxina colérica (TC), principal responsable de los síntomas que se reportan, el lipopolisacárido (LPS), que constituye la barrera protectora fundamental del vibrio y el TCP (Toxin Corregulated Pili), que se plantea como el principal factor de colonización junto a la MSHA (Mannose Sensitive Hemaglutinin Associated). Existen otros antígenos, que pueden ser los responsables de la reactogenicidad residual que se ha observado en cepas mutadas que carecen del gen que codifica para la TC, ellos son: la toxina ACE (Accessory Choleric Enterotoxin), que induce canales de iones,la toxina ZOT (Zonula Occludens Toxin) que aumenta la permeabilidad de la mucosa intestinal por afectación de las uniones estrechas entre las células epiteliales y otras como CEP (Core Encoded Pili), la HA (Hemaglutinina Soluble) y las hemolisinas (5,6,7). La colonización intestinal en humanos por cepas de V. cholerae, constituye el evento primario y más importante para el desarrollo de la patogenia y de una respuesta inmune efectiva. Ha sido diagnosticada por la detección de vibrios en las heces, lo cual refleja su multiplicación en el intestino delgado y su posterior excreción (8).
Diferentes estudios han demostrado que los mecanismos protectores contra el cólera están dirigidos contra la bacteria y contra la toxina (9).
Se ha planteado que la inducción de una respuesta protectora contra la infección por V. cholerae es altamente dependiente de una correcta estimulación del sistema inmune de la mucosa (10). Por esta razón, en la actualidad se trabaja intensamente para obtener una vacuna eficaz contra esta enfermedad, que sea administrada por vía oral (11,12,13). Los candidatos a vacuna más prometedores contra el cólera en la actualidad, son los basados en cepas vivas atenuadas que se han construido por la eliminación de los genes que codifican para los principales factores de virulencia, como es el caso de la TC (14). La experiencia ilustra que las vacunas orales dan una protección relativamente larga. La vacuna CVD 103 HgR, de una cepa atenuada del V. cholerae derivada de la cepa tipo salvaje Clásica Inaba 569B, mediante la eliminación del gen quecodifica la subunidad A de la toxina colérica y al que se le insertó un gen resistente al Hg+2 dentro del locus hlyA del cromosoma, se ha licenciado en varios países, incluyendo Paraguay (15).
Esta vacuna se ha administrado a niños y adultos en fase I y II en estudios clínicos en países industrializados y menos industrializados (16,17,18,19). En un estudio realizado en voluntarios norteamericanos una dosis de la vacuna CVD 103-HgR produjo una eficacia protectora elevada para cepas homólogas desde el día 8° de la administración, persistiendo por 6meses (70-90%). En estos estudios se examinó la protección contra todos los biotipos y serotipos respectivamente (Inaba Clásico, Ogawa Clásico, El Tor Inaba, El Tor Ogawa). La protecciónde la vacuna contra el biotipo y serotipo homólogo Inaba fue del 97% y después de la provocación con el serotipo heterólogo Ogawa se registró una protección del 82%. La provocación con los biotipos heterólogos aportó una protección algo inferior, 65% contra el serotipo homólogo El Tor Inabay 64% contra el serotipo heterólogo El Tor Ogawa (20,21,22).
En el Paraguay, si bien el número de casos notificados hasta la fecha es escaso, la aparición de nuevos casos en zonas limítrofes y la presencia de zonas inundadas hace que sea importante contar con una medida eficaz de prevención, como podría ser la vacuna oral contra el cólera. Este estudio tuvo por objetivo la evaluación de la efectividad e inmunogenicidad de la CVD 103 HgR en 40 voluntarios paraguayos. Los objetivos específicos fueron la determinación del título de anticuerpos vibriocidas Inaba (serotipo homólogo) y los anticuerpos anti-LPS en las muestras, además de indagar sobre las características clínicas y demográficas de los voluntarios.
MATERIALES Y METODOS
Diseño del estudio: es un estudio experimental, realizado en 40 adultos, sanos, de 18 a 40 años de edad, que accedieron a participar voluntariamente al estudio luego que se les haya informado adecuadamente sobre los riesgos y beneficios de su participación. Todos completaron un cuestionario sobre datos clínicos y demográficos. Ninguno de ellos había recibido previamente la vacuna total ni en forma oral, ni en forma parenteral contra el cólera, ni habían presentado síntomas de cólera ni viajado a zonas endémicas para esta enfermedad.
Tamaño de la muestra: para la variable dicotómica y el cálculo del tamaño de la muestra se utilizó la tabla para el cálculo del tamaño de muestra de estudios descriptivos con variables continuas (Hulley y Cummings, 1993).
Para un nivel de confianza del 95%, una amplitud de 0.25 y una proporción esperada de seroconversión de 0.70, el tamaño de muestra fue de 37 individuos como mínimo.
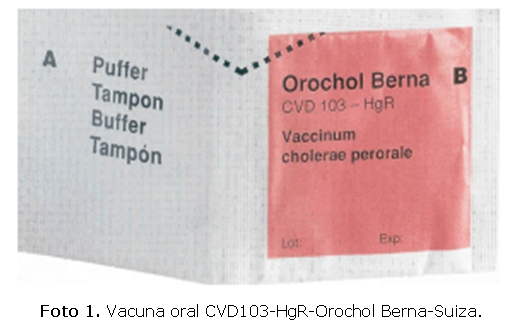
Vacuna Oral: La vacuna CVD 103 HgR fue desarrollada por la Swiss Serum Vaccine Institute-Orochol-Berna. La fórmula consiste en dos paquetes: uno que contiene la vacuna liofilizada (2-6 x 10 CFU del CVD 103 HgR) mientras que el otro sobre contiene tampón (2.5 g de NaHCO3 y 1.65 g de ácido ascórbico)(ver foto 1).
El paquete de vacuna se mezcló en un vaso que contenía 100 ml de agua y la suspensión se administró en forma oral a los sujetos.
Los voluntarios fueron controlados clínicamente por 7 días. Las muestras de sangre se recolectaron en el día 0, antes de la aplicación de la vacuna, a los 15 y 30 días después de la toma de la vacuna oral y los sueros conservados a 20°C hasta el procesamiento de los mismos.
Para la determinación de las inmunoglobulinas IgG, IgA e IgM totales en suero se utilizó el método turbidimétrico (Biocientífica-Argentina). Se basa en la medición de la turbidez producida en una solución por la formación de inmunocomplejos cuando en el seno de la misma se enfrentan anticuerpos anti-IgG/IgA/IgM humanas y los anticuerpos IgG/IgA/IgM provenientes de la muestra que se desea dosar. Para lograr que este aumento de turbidez sea máximo la solución mencionada contiene además Polietilenglicol (PEG) al 4% en un tampón Tris (pH 7.4). La turbidez producida se mide en un espectrofotómetro a 340 nm. La absorbancia medida es directamente proporcional a la concentración de la inmunoglobulina en un amplio rango de concentraciones.
ENSAYO VIBRIOCIDA
a) Cepas bacterianas y condiciones de cultivo.
Los anticuerpos vibriocidas se midieron por microensayo con modificaciones de B. Cedré (La Habana-Cuba-comunicación personal).
La cepa utilizada fue de V.cholerae O1, Clásico Inaba (V13), proporcionada por el Instituto Finlay (La Habana,Cuba) aislada de una epidemia, conservada en caldo tripticasa de soya adicionado de glicerol al 15% y para su utilización cultivada en un medio compuesto por peptona de carne (MERCK) 3 g/L, triptona (MERCK) 17 g/L, K HPO (MERCK) 2.5 g/L y NaCl (MERCK) 2 4 5 g/L, pH 7.2.
b) Ensayo
El ensayo consistió en adicionar al medio de cultivo glucosa y púrpura de bromocresol, como indicador de pH (ambos al 2% en solución), con el objeto de detectar el crecimiento de bacterias sobrevivientes a la acción de los anticuerpos provenientes del suero de los vacunados y mediados por la adición de complemento humano (actividad vibriocida) (23).
Se realizaron diluciones seriadas del suero en placas estériles de 96 pocillos y se adicionó una suspensión de 25 l de la cepa VC13 (clásico Inaba-cepa homóloga a la vacuna) y complemento diluido en 1:5. Después de 1 hora de incubación a 37°C se agregó 150 l de infusión cerebro-corazón (BHI) a cada pocillo. Las placas se incubaron 3 horas a 37°C y entonces se evaluó la actividad vibriocida. Los resultados se expresaron como la media geométrica de los títulos (GTM) y la elevación de los títulos cuatro veces o más del basal se consideró seroconversión. El título se definió como la dilución más alta del suero que produjo una inhibición total del crecimiento bacteriano, dado por la invariabilidad del color del medio (ver foto 2).
ENSAYO DE ELISA
Los anticuerpos anti-LPS Inaba se midieron utilizando el método inmuno- enzimático.
Antígeno
Se empleó como antígeno al lipopolisacárido (LPS), purificado en el laboratorio del Instituto Finlay, La Habana, Cuba, aisladas de epidemias del serotipo Inaba, debido a que el LPS es el principal antígeno del V. cholerae y la respuesta inmunológica obtenida en respuesta a él es la más importante.
Sensibilización y ensayo
Se depositó en cada pocillo de una placa de 96 hoyos, 100 ul de suspensión antígeno LPS disuelto en tampón a una concentración de 25 ug/ml, en cámara húmeda a 4ºC toda la noche. El antígeno no fijado se eliminó mediante 3 lavados con una solución de PBS 0.01M-Tween 20 al 0.05%. La posible fijación de anticuerpos inespecíficos se evitó bloqueando con leche descremada al 1% (150 ul/pocillo) y 1 hora de incubación a 37ºC. Luego se efectuaron 3 lavados.
Los sueros de los voluntarios se diluyeron en PBS y se agregaron a las placas diluciones seriadas de 1:100 en duplicado p/cada muestra de los distintos tiempos e incubados a 1 hora a 37 ºC. Como conjugado se empleó anti-IgG humana (SIGMA) marcado con peroxidasa a una dilución de 1:1500, 100 ul/ pocillo. Como sustrato se utilizó OPD (ortofenilediamina), agua oxigenada, 100 ul/pocillo por 30 minutos. La reacción se detuvo con ácido sulfúrico 1 N. La lectura se efectuó en un lector de ELISA a 492 nm.
Gestión y análisis de datos
Se utilizaron pruebas de estadísticas descriptivas para variables continuas como media, desvío estándar, distribución de frecuencia y porcentaje como primera fase del análisis y la prueba T para muestras pareadas para comparar los niveles de anticuerpos, ANOVA y Kruskall-Wallis para variables parámetricas y no paramétricas, respectivamente.
RESULTADOS
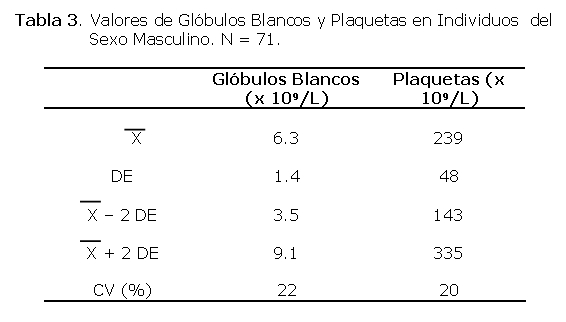
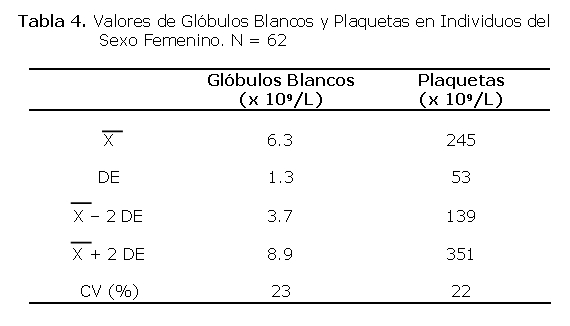
Un total de 40 personas participaron en el estudio, todas del sexo masculino. El rango de las edades fue de 18 a 45 años siendo la media de 27±9 años. El 60% era menor de 30 años (Tabla 1).
La vacuna oral CVD 103-HgR fue bien tolerada por los voluntarios paraguayos. Ninguno presentó diarrea ni otras reacciones adversas atribuibles a la vacuna, durante los 7 días de observación. Respecto a los efectos colaterales, ninguno desarrolló diarrea, vómitos ni dolor de cabeza.
En lo que respecta a la procedencia, el 75% provenía de Asunción y del Gran Asunción (Tabla 2).
Respecto a la frecuencia de viajes al exterior de los 40 voluntarios, 11 (27.5%) informaron que sí había viajado al exterior, de los cuales el 73% a la Argentina, el 18% al Brasil y un 9% a Bolivia.
Los niveles de IgG, IgM e IgA totales se midieron sólo en 31 voluntarios debido a falta de reactivos. El rango de los valores normales de la IgG es de 200 a 3000 m/dl .La media de IgG hallada en los voluntarios fue de 1374±430, el valor mínimo fue de 97 mg/dL y el máximo fue 2000 mg/dL, de los cuales sólo uno (3.2%) de ellos estaba por debajo de lo normal.
El rango de los valores normales de la IgM es de 35 a 260 mg/dl. La media de IgM hallada en los voluntarios fue de 46 ± 17, el valor mínimo fue de 12 mg/dL y el máximo fue 90 mg/dl, de los cuales 3 (9.6%) se hallaban por debajo del valor normal. El rango de los valores normales de la IgA es de 30 a 500 mg/dl La media de IgA hallada en los voluntarios fue de 141± 71, el valor mínimo fue de 10 mg/dL y el máximo de 270 mg/dL de los cuales 4 (12.4%) se hallaban por debajo del valor normal (ver Tabla 3).
El 65% de los voluntarios desarrolló anticuerpos a los 15 días después de la vacunación, siendo 1/320 el título de mayor porcentaje (20%) a los 30 días, el 60% aún mantuvo los niveles siendo 1/160 el título más frecuente (17.5%), sólo uno desarrolló anticuerpos recién a los 30 días.
Los niveles de anticuerpos tuvieron un aumento significativo (p=0,004) a los 15 días post-vacunación y una disminución significativa a los 30 días (p =0.008) (Tabla 4).
En el día 15 post-administración de la vacuna oral no hubo diferencia significativa en los niveles de anticuerpos entre los diferentes grupos etáreos (Tabla 5).
El 40% (16/40) de la población estudiada ya no presentó anticuerpos a los 30 días de ser inoculados con la vacuna oral.
El 30% (12/40) de los que desarrollaron anticuerpos vibriocidas aún presentaban respuesta a los 30 días y éstos eran los de edad comprendida entre 18-25 años, pero mostrando una disminución significativa p= 0.018 en el nivel de anticuerpos en el grupo de 26-35 años (Tabla 6).
RESPUESTA DE ANTICUERPOS ANTI-LPS
La respuesta a los anticuerpos anti-LPS se midió utilizando el ensayo de ELISA.
Se consideró una seroconversión un aumento superior a 0.15 de la OD de las muestras a los 15 y 30 días respecto al basal. No se halló diferencia significativa en la respuesta inmunológica anti-LPS a los 15 y 30 días de la toma de la vacuna.
DISCUSION
Este es el primer trabajo realizado en Paraguay para medir respuesta a una vacuna oral contra el cólera. En el mismo se observó buena tolerancia de los voluntarios a la vacuna.
Los niveles de IgG, IgA e IgM dosados se realizaron antes de la toma de la vacuna a fin de evaluar los valores en los voluntarios y saber si se hallaban dentro de los rangos normales.
El mayor porcentaje de los voluntarios vacunados con edades comprendidas entre 18 y 40 años era procedentes de Asunción y el Gran Asunción (75%).
Si bien el 27.5% de los inoculados había viajado al exterior, ninguno de ellos fue a países endémicos para el cólera.
La vacuna oral CVD 103-HgR indujo un 65% de respuesta de anticuerpos vibriocidas Inaba (serotipo homólogo) a niveles similares reportados en poblaciones de otros países. Así, en Suiza(16), los voluntarios mostraron una seroconversión del 72% de anticuerpos vibriocidas Inaba. En Indonesia (18), la seroconversión alcanzó 75 a 81%. En Perú se pudo examinar la influencia de los estados socioeconómicos y de las condiciones higiénicas malas y buenas sobre la respuesta inmunológica a la vacunación, la población de bajo nivel económico alcanzó una seroconversión de 72%, mientras que la de alto nivel presentó un 78% (19).
Un elevado porcentaje mantuvo un buen nivel los títulos vibriocidas luego de 30 días (60%). Los voluntarios con edades comprendidas entre 18 y 25 años fueron los que presentaron mejor respuesta y los que mantuvieron un nivel elevado de anticuerpos vibriocidas luego de 30 días de inoculación. Es importante considerar que la vacuna logró buenos títulos vibriocidas cuya respuesta es de tipo IgM, que pudieron suprimir la multiplicación de los gérmenes y se puede asumir una protección vacunal elevada y de acción rápida contra una infección con vibriones del cólera. Respecto a la respuesta inmunológica anti-LPS entre los voluntarios, la baja respuesta podría ser atribuida a que la misma es de tipo IgG, que generalmente recién se presenta a los 30 días de la inoculación. Sugerimos realizar una nueva prueba inmunoenzimática utilizando como conjugado anti-IgM humana. En el Paraguay, hasta la fecha, se han reportado solo cuatro casos de cólera pero es importante saber que esta vacuna podría ser eficaz en caso de instalarse la epidemia localmente pudiendo lograr un seroconversión del 60-65% en un período de 30 días.
Sería importante ampliar este estudio, incluyendo una población más representativa que incluya mujeres y niños de diferentes niveles socioeconómicos, a fin de obtener datos más amplios.
BIBLIOGRAFÍA
1. World Health Organization. Cholera in 1991. Weekly Epidemiol. Rec. 1992; 42: 89-91. [ Links ]
2. Sakazaki R, Bacteriology of Vibrio cholerae and related organisms. In: Barua D, Greenough WB III, editors. Cholerae. New York: Plenum Medical Books, Co; 1992. [ Links ]
3. Holmgren J. Actions of cholera toxin and the prevention and treatment of cholera. Nature London 1981; 292: 413-7. [ Links ]
4. Kaper JB, Morris Jr G, Levine MM. Cholera. Clinical Microbiol Rev 1995; 8:48-86. [ Links ]
5. Jonson G, Holmgren J. Svennerholm AM. Analysis of expression of toxin-corregulated pilus in Vibrio cholerae O1 in vitro and in vivo. Infect Immun 1992; 60: 4278-84. [ Links ]
6. Pierce NF, Cray Jr WC, Saci JH. Oral immunization of dogs with purified cholera toxin, crude cholera toxin, or B subunit: evidence for synesgistic protection by antitoxin and antibacterial mechanism. Infect Immun. 1982; 37: 687-94. [ Links ]
7. Sinha VB, Jacob A, Srivastava R, Kaper JB, Srisvastava BS. Identification of the flagelar antigens of Vibrio cholerae El Tor and its role in protection. Vaccine 1993; 11: 372-5. [ Links ]
8. Siebers A, Finlay BB. M cells and the pathogenesis of mucosal and systemic infection. Trends Microbiol 1996; 4:22-9. [ Links ]
9. Holmgren J, Svennerholm AM, Lonnroth I, Fall-Person M, Markman H, Lundbeck H. Development and improved cholera vaccine based on subunit toxoid. Nature ( London) 1977; 269: 602-4. [ Links ]
10. Tacket CO, Losonsky G, Nataro JP, Cryz SJ, Edelman R, Fosano A. Safety and immunogenicity of live oral cholera vaccine candidate CDV 110 , a ctxA, zot ace derivative of El Tor Ogawa Vibrio Cholerae J Infect Dis 1993; 168:1536-40. [ Links ]
11. Clemens JD, Van loon F, Sack D, Chakraborty Rao MR, Ahmed R, Harris J, et al. Field trial of oral cholera vaccine in Bangladesh: serum vibriocidal and antitoxic antibodies as markers of the risk of cholera. The Journal of Infectious Diseases 1991; 163: 1235-42. [ Links ]
12. Sanyal Sc, Mukherjee S. Live ral cholera vaccine: report of a trial on human volunteer subjects. Bull WHO 1969; 40:503-11. [ Links ]
13. Carol O, Losonsky G, Nataro J, Cryz S, Edelman R, Kaper J, et al. Onset and duration of protective immunity in challenged volunteers after vaccination with live oral cholera vacine CVD 103-HgR. The Journal of Infectious Diseases 1992; 166: 837-41. [ Links ]
14. Hase CC, Thai LS, Boesmam L, Finkelstein M, Mar VL, Burnette WN, et al. Construction and characterization of recombinant Vibrio cholerae strains producing inactive cholerae toxin analogs. Infect Immun 1994; 62:3051. [ Links ]
15. Levine MM, Kaper JB, Herrington D. Safety, immunogenicity and efficacy of recombinant live oral cholera vaccines, CVD 103 and CVD 103HgR. Lancet II 1988; 467-70. [ Links ]
16. Cryz SJ Jr, Levine MM, Kaper JB, Fürer E, Althaus B. Randomized double-blind placebo controlled trial to evaluate the safety and immunogenicity of the live oral cholera vaccine strain CVD 103- HgR in Swiss adults. Vaccine 1990; 8(6): 577–80. [ Links ]
17. Su-Archawaratana P, Singharaj P, Taylor D, Hoge C, Trofa A, Kuvanont K, et al. Safety and immunogenicity of different immunization regimes of CVD 103-HgR live oral cholera vaccine in soldiers and civilians in Thailand. J Infect Dis 1992;165:1042-8. [ Links ]
18. Suharyono C, Simanjuntak N, Witham N, Punjabi DG, Heppner G, Losonsky H, et al. Safety and immunogenicity of single-dose live oral cholera vaccine CDV 103-HgR in 5 to 9 year-old Indonesian children. Lancet 1992; 689-94. [ Links ]
19. Gotuzzo E, Butron B, Seas C, Penny M, Ruiz R, Losonsky G, et al. Safety, immunogenicity and excretion pattern of single-dose live oral cholera vaccine CDV 103HgR in Peruvians adults of high and low socioeconomic levels. Infect Immun 1993; 61: 3994-7. [ Links ]
20. Levine MM, Tacker CO. Recombinant live oral cholera vaccines. In: Wachsmuth KI, Blake PA, editors. Vibrio cholera and cholera. Washington DC: ASM Press; 1994. [ Links ]
21. Benenson AS, Mosley WH, Fahimuddin M, Oseasohn RO. Cholera vaccine field trials in East Pakistan, 2. Effectiveness in the field. Bull WHO 1968;38:359-372. [ Links ]
22. Ghosh A, Thungapathra, M, Ghosh RK. Strategies for production of a potential candidate vaccine for cholera. Indian J Med Res 1996;104;60-75. [ Links ]
23. Neoh S, Rowley D. The antigens of Vibrio cholerae involved in the vibriocidal action of antibody and complement. The Journal of Infectious Diseases 1970;121(5):505. [ Links ]
*Autor Correspondiente: Dra. M. Angelica Leguizamón, Departamento de Inmunología Celular, Instituto de Investigaciones en Ciencias de la Salud. Río de la Plata y Lagerenza. Asunción-Paraguay
Email: icelular@iics.una.py