INTRODUCCIÓN
La infección neonatal por herpes virus simplex de serotipo 1 o 2 (HVS 1-2) se asocia con alta morbimortalidad, aún con tratamiento antiviral apropiado1.
Este es un virus neurotrópico, por lo que puede ocasionar un daño importante en el sistema nervioso central (SNC)2.
El HVS 2, también conocido como herpes genital, es una enfermedad de trasmisión sexual muy común a nivel mundial. Aproximadamente 22% de las mujeres gestantes están infectadas por HVS, y, en la mayoría de los casos, esta situación les pasa inadvertidas a las mujeres y a los médicos3.
Este virus es trasmitido en forma vertical, de la madre al hijo, aún con bolsas integras. Hasta 90% de las recurrencias de herpes genital son asintomáticas y los virus son excretados en forma intermitente. Estos dos factores tornan difícil el diagnóstico de certeza en la mujer embarazada.
La prevalencia de la infección por HVS es frecuentemente subestimada en las gestantes; a esto hay que añadir la falta de tamizaje para herpes en esta población. Como consecuencia directa de estos hechos, la enfermedad del recién nacido puede presentarse con una frecuencia indeseada4.
En el recién nacido la infección puede tener tres formas de presentación: sistémica, muco-cutánea o encefálica.
La incidencia de la encefalitis herpética en neonatos es muy variable en las diferentes regiones del mundo, siendo de 1 a 6/100 000 en países del primer mundo. En Paraguay no existen datos acerca de la incidencia de esta patología neonatal.
A nivel mundial se estima que el 75% de los casos en recién nacidos son debidos al HVS-2, los restantes casos son producidos por HVS - 15.
Aún con el tratamiento adecuado, la mortalidad es del 20 al 30% y dos terceras partes de los supervivientes tendrán secuelas neurológicas de diferentes grados.
La confirmación de encefalitis herpética se establece por la detección de material genético del HVS por medio de la de Reacción en Cadena de Polimerasa (PCR) para el HVS, prueba que puede realizarse en muestras de vesículas cutáneas, sangre o líquido cefalorraquídeo (LCR). Esta prueba tiene alta sensibilidad y especificidad, siendo la posibilidad de falsos positivos extremadamente raros y se ha convertido en el estándar diagnóstico de oro, sobre todo en las muestras de LCR6,7.
El tratamiento de elección es el aciclovir. Introducido tempranamente en el curso de la enfermedad, puede incidir positivamente en la evolución. La persistencia de HVS con tratamiento adecuado debe hacer pensar en altas cargas virales o en la posibilidad de resistencia al aciclovir.
Objetivo:
Presentar un caso clínico neonatal con encefalitis herpética confirmada, con evolución tórpida y persistencia de PCR para HVS en LCR.
CASO CLÍNICO
Se presenta el caso clínico de un recién nacido, cuyo diagnóstico de encefalitis herpética se realizó a través de PCR en LCR. Para la PCR cualitativa en tiempo real, se utilizó el protocolo de Tenorio A., con modificaciones dirigidos contra un fragmento del ADN polimerasa, altamente conservado en los virus Herpes simple I y II, de 120 pares de bases.
La extracción del ADN se realizó con 200 ul del LCR, utilizando el kit comercial de Thermo Scientific®, siguiendo las instrucciones del fabricante.
Para la detección se utilizaron: 5 ul del ADN, una Master mix Sso Fast EvaGreen Supermix de Bio Rad ®, un protocolo de amplificación de 35 ciclos de 94°C por 5 min, 94°C por 15 seg, 49°C por 15 seg y un volumen de reacción 20 ul., en el equipo Rotor Gene®.
Los primers utilizados fueron sintetizados por Invitrogen®, el límite de detección fue de 5 copias/ml y controles positivos que fueron gentilmente proveídos por el Instituto, ANLIS: Carlos Malbran-Argentina. Los resultados se informaron como Detectables y No detectables, previo análisis de la curva de meelting8.
En la tabla 1 se presentan las características del recién nacido con diagnóstico de herpes neonatal y los antecedentes maternos.
Tabla 1 Características del recién nacido con encefalitis herpética.
| Caso | |
|---|---|
| Edad gestacional en semanas al momento del nacimiento | 38 |
| Apgar | 8/9 |
| Sexo | Femenino |
| Rotura de membranas | Intraparto |
| Síntomas | Fiebre, irritabilidad, vómitos y convulsiones |
| LCR | Leucocitosis, con monocitosis, proteinorraquia y lactato elevados ( de gran magnitud) |
| PCR en sangre | No se realizó |
| PCR en LCR | Positivo |
| Días de enfermedad antes del diagnóstico | 16 |
| Edad en días al momento de inicio de aciclovir | 18 |
| Lesión activa por herpes en la madre al momento del parto | No posee |
| IgM /IgG maternas | Se desconoce |
| IgM/IgG del Recién nacido | Positivo |
| TAC cerebral | Afectación localizada en zona temporal al inicio, con gran destrucción de masa encefálica en la evolución |
| Días de tratamiento con aciclovir | 45 |
| Uso de esteroides | Pulsos de metil prednisolona a los 30 días de inicio de aciclovir |
| Momento de inicio de foscarnet | 64 días de vida 45 días de aciclovir |
| Días de tratamiento con foscarnet | 14 |
| Día de esterilización de LCR | Al día seis de foscarnet |
| Efecto adverso al foscarnet | ninguno |
| Secuelas | Importantes Destrucción total de la masa encefálica Vivo al alta. Fallecido a los 9 meses |
| Estudio de inmunodeficiencia congénita | Se descartó inmunodeficiencia humoral, celular, de neutrófilos, NK y complemento |
En la Tabla 2 se puede observar las características citoquímicas de los LCR más significativos.
Tabla 2 Progresión de LCR durante el tratamiento.
| Progresión de valores del LCR | ||||
|---|---|---|---|---|
| Días de tratamiento | Inicio | Intermedio | Final | |
| GB Total ( × 106per mm3) | 12 | 105 | 153 | 46 |
| Neutrófilos (%) | 10 | 10 | 25 | 30 |
| Linfocitos (%) | 90 | 90 | 75 | 70 |
| Monocitos (%) | No se observa | |||
| GR mm3 | 100 | 5 000 | 2 650 | 100 |
| Proteína (mg por 100 ml) | 453 | 1 546 | 1 823 | 1786 |
| Glucosa (mg por 100 ml) | 59 | 6 | 3 | 15 |
| Lactato | 1 136 | 2 964 | 1 173 | 56 |
| PCR | Positivo | No detectable | ||
| Medicamento | Aciclovir | Foscarnet | ||
La afectación del SNC se evidenció por medio de tomografía axial computarizada (TAC) cerebral, pudiendo observarse una destrucción rápidamente progresiva, en el que la imagen inicial reveló una pequeña lesión en región temporal que evolucionó rápidamente a una destrucción masiva del cerebro (Figura 1)
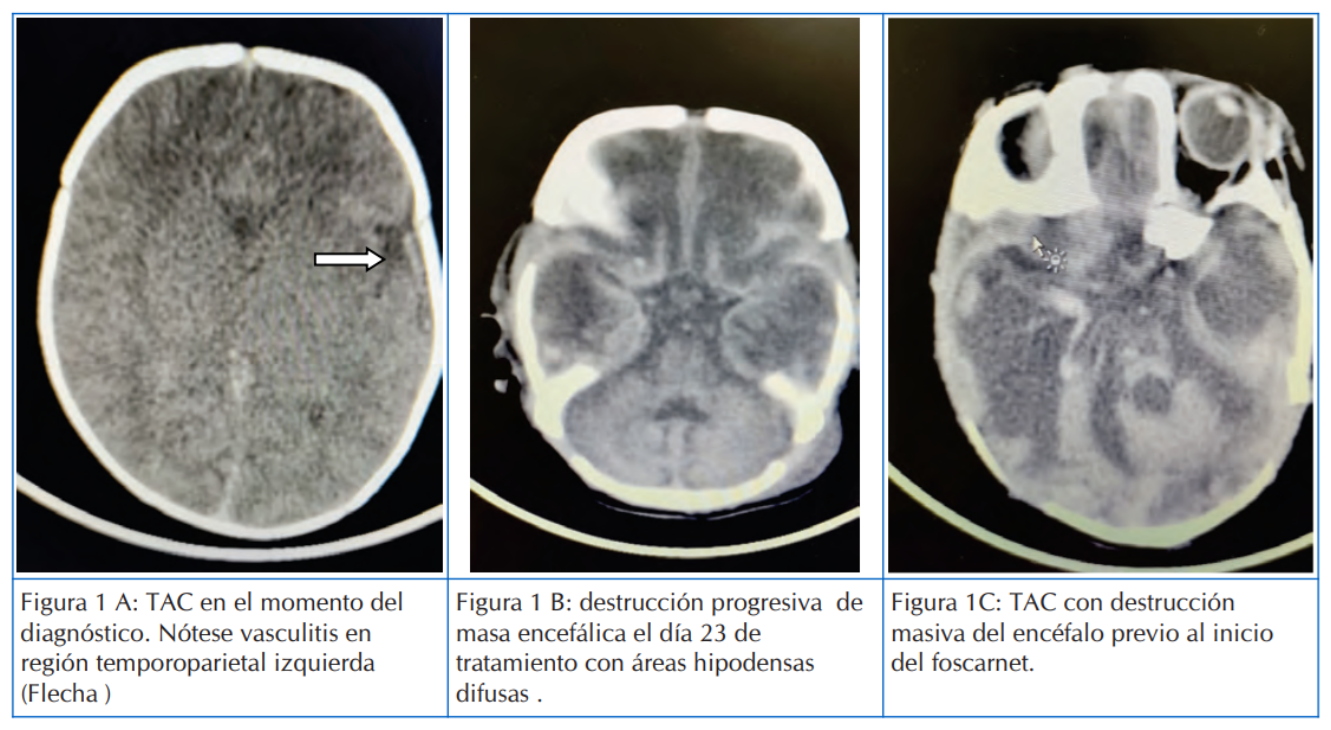
Figura 1 Tomografía Axial Computarizada de cerebro que del paciente del caso uno, que muestra la progresión de la destrucción encefálica.
Se realizó una pesquisa exhaustiva del posible motivo de persistencia del virus en el LCR. Esta incluyó la verificación de dosis de aciclovir, asegurar el uso del antiviral una sola vez por frasco y el envío de muestras de LCR a dos laboratorios de biología molecular con el fin de descartar contaminaciones. También se descartó inmunodeficiencia primaria y secundaria.
Desafortunadamente, en el Paraguay aún no se cuenta con laboratorios que puedan medir resistencia al aciclovir y, debido a las restricciones impuestas por la pandemia de SARS-COV2, las muestras no fueron referidas a laboratorios regionales, imposibilitando el estudio de la resistencia viral.
Si bien no fue posible confirmar la farmacorresistencia mediante métodos moleculares, ante la rápida progresión del cuadro y considerando la posibilidad de resistencia clínica al aciclovir, se inició foscarnet endovenoso a 40 mg/Kp/dosis cada ocho horas. La duración total de tratamiento fue de 14 días. El LCR fue negativo por PCR para HVS 1-2 al sexto día de tratamiento (antes de la dosis número 16 del tratamiento con foscarnet)
El paciente no presentó efectos adversos al fármaco.
Fue dada de alta con profilaxis oral con aciclovir por 6 meses, con graves secuelas neurológicas. Un mes luego de suspender la profilaxis, presentó recaída de su patología, con detección de HVS por PCR en LCR. Falleció luego de 3 días de estancia en Unidad de Cuidados Intensivos.
DISCUSIÓN
La infección por herpes virus 1-2 en el recién nacido es una enfermedad de trasmisión vertical, de madre a hijo que ocurre en el útero, durante el parto o en el periparto. La posibilidad de infección varía dependiendo de si la madre tiene infección aguda, recurrente o persistente.
La infección herpética en la gestante no siempre es aparente, esto dificulta el diagnóstico, y consecuentemente, impide tomar medidas tendientes a prevenir la infección en el recién nacido.
La posibilidad de trasmisión es mayor cuando la gestante cursa con su primera infección herpética9. La excreción de VHS-2 puede ser intermitente, incluso en ausencia de lesiones, por lo que muchas veces se produce transmisión en infecciones subclínicas10.
Es importante establecer el estatus materno de infección por HVS 1-2, ya que la enfermedad en el neonato puede prevenirse y así, reducir el daño potencial en el recién nacido, el cual puede ser grave e incluso mortal1.
En el caso que se presenta en este reporte, la madre no refirió síntomas de herpes genital, ni se reportaron lesiones sospechosas durante el parto, por lo que probablemente los virus fueron trasmitidos por lesiones inaparentes.
Es fundamental contar con los antecedentes clínicos y laboratoriales de la madre, debido a que el riesgo de infección del recién nacido varía según el estatus serológico materno: es de 60%-80% en el caso de primoinfección, 25% en primer episodio de infección no primaria y 2%-3% en reactivación11.
En el caso aquí presentado, no se hizo pruebas serológicas a la madre durante el embarazo, lo cual probablemente retrasó el diagnóstico en forma importante e incidió negativamente en la evolución del paciente al impedir que el neonato fuera evaluado en forma temprana a fin de descartar o confirmar la presencia de la infección.
Entre los factores de riesgo para que el RN padezca la enfermedad, se citan: la presencia de infección primaria en la madre durante la gestación, nacimiento por vía vaginal, rotura prolongada de membranas, uso de electrodos fetales y herpes genital por HVS-12.
Ninguno de estos factores estuvo presente en nuestro paciente.
La enfermedad en el neonato puede deberse a HVS 1, pero más frecuentemente se debe a HVS-212. Esta identificación específica no pudo hacerse en la cepa del RN, al no contar en el país con esa tecnología.
El diagnóstico del RN se realiza por PCR en sangre, en lesiones cutáneas y en LCR. Es imprescindible realizar PCR en LCR, independientemente de los resultados de las muestras tomadas en sangre, piel y/o mucosas13.
El uso de la PCR es útil, no sólo como diagnóstico, sino también como base para decidir la duración del tratamiento. Los intervalos de tiempo para repetir la punción lumbar no están normatizados, pero algunos autores mencionan que el LCR debe negativizarse luego del día 7 a 10 del inicio del aciclovir.
En el caso presentado en este reporte la PCR en LCR siguió positiva por tiempo prolongado, a pesar de administrar la droga de elección en dosis, intervalos y vía adecuados14.
El efecto más dañino del HVS neonatal lo constituye la afectación cerebral. Existen tres áreas o patrones de afectación: el área fronto-temporal, corticoespinal y difusa. Es imprescindible estadificar el daño cerebral, desde el inicio del cuadro. Se considera que el mejor método diagnóstico es la RMN. Otros métodos de imagen son la TAC y ecografía transfontanelar. De ellos, ésta última es la menos sensible y específica para los daños iniciales13,15.
En el RN aquí presentado la TAC cerebral nos permitió observar datos progresivos de destrucción cerebral. Con respecto a la afectación cerebral, se pudo constatar una destrucción total de la masa encefálica como resultado final de la infección, ya que el tratamiento con foscarnet se administró tardíamente, por la falta de disponibilidad de este medicamento en el país (Figuras 1 y 2)
Con la introducción del aciclovir como fármaco de primera línea de tratamiento del herpes neonatal, la evolución de estos pacientes ha cambiado drásticamente, ya que en la era pre antiviral la mortalidad podía llegar a 85% en casos de enfermedad diseminada, y en casos de enfermedad del SNC la sobrevida al año era solo de 50%16.
Un indicador para sospechar la presencia de virus resistentes al fármaco de primera línea, es la persistencia de la PCR para HVS en LCR por tiempos prolongados.
En los casos en que se sospeche resistencia al aciclovir, la alternativa es el foscarnet, y como tercera elección puede citarse al cidofovir.
Si bien la resistencia al aciclovir ha sido ligada al uso prolongado de este antiviral como terapia supresiva en pacientes inmunocomprimidos y en algunos casos en pacientes inmunocompetentes, debe plantearse esta posibilidad en pacientes no respondedores al tratamiento de primera línea17-19.
A fin de determinar la efectividad de la terapia antiviral para eliminar el virus, algunos autores recomiendan el uso de la PCR cuantitativa en LCR20. En el paciente de este reporte no se pudo cuantificar la carga viral.
En un estudio comparativo entre el aciclovir y el penciclovir, se demostró que al día siete del tratamiento con cualquiera de las dos drogas la detección viral resultaba negativa en el 85 a 87% de los pacientes21. Otros autores mencionan que a la semana del inicio del aciclovir la PCR para HVS 1-2 en LCR debe desaparecer20.
La necesidad de eliminar el virus del SNC ha llevado a diversos autores a plantear las recomendaciones de realizar punciones lumbares repetidas a fin de asegurar que el LCR ya se encuentra libre del virus22.
La adherencia del equipo médico a la recomendación de la repetición de las punciones lumbares permitió constatar la persistencia de PCR para HVS en nuestro paciente. Se hace énfasis en que el resultado esperado, según la bibliografía estudiada, era la negativización del LCR a partir del día 10 de tratamiento con aciclovir, lo cual no ocurrió. Más aún, la PCR persistió positiva por mucho tiempo, tal como puede apreciarse en la tabla 1. Esto se mantuvo constante hasta la introducción del foscarnet.
La resistencia al aciclovir, debida a la mutación de timidina kinasa o del ADN polimerasa, es cercana al 5% y se presenta principalmente en pacientes inmunocomprometidos. En los pacientes que han sido sometidos a trasplante de médula ósea, la resistencia puede llegar a 30%23.
Otros autores también reportan la resistencia del virus al aciclovir con porcentajes que van de 30,7% hasta 45,5%, con perfil indeterminado de resistencia de hasta 23,8%, siendo las resistencias mayores en los HVS-2 (53,8%) en relación a los HVS-1 (34,9%). La mayoría de las resistencias se deben a mutaciones en el gen UL 2324.
Fica y colaboradores reportaron que el retraso en el tratamiento por más de tres días desde el inicio de los síntomas se asoció con muerte o alteraciones neurológicas importantes26.
Aunque discutido, en casos de encefalitis graves, rápidamente progresivas, evidenciada por deterioro clínico y radiológico a pesar de la terapia apropiada, pueden utilizarse cursos cortos de esteroides en altas dosis, a fin de disminuir la carga viral del LCR y lograr la mejoría clínica27
El paciente recibió metilprednisolona, en un intento de frenar la inflamación ocasionada por el virus, a pesar de lo cual el daño progresó.
La persistencia de HVS en LCR en los neonatos es un factor de riesgo para la aparición de secuelas neurológicas severas. Sin embargo, aún no puede dilucidarse si esta persistencia se debe a Resistencia o es solamente un reflejo de altas cargas virales28.
Otro factor que podría contribuir a la persistencia del virus es la capacidad disminuida del sistema inmunológico del recién nacido para responder en forma adecuada a los antígenos(28).
No se presentó efecto adverso al foscarnet.
CONCLUSIÓN
La persistencia de HVS en LCR a pesar de una terapia empírica inicial apropiada evidencia que debe realizarse seguimiento de persistencia de PCR en LCR a fin de plantear terapias de segunda línea para yugular la infección, tratando en lo posible de minimizar el daño encefálico en estos pacientes.
La resistencia del HVS 1-2 al aciclovir debe plantearse en los casos de PCR persistentemente positivo, aún en caso de no contar con las pruebas de resistencia viral, sobre todo en los países que no cuentan con la tecnología adecuada para realizarla.
Debe fortalecerse el sistema de vigilancia de resistencia viral, a fin de brindar el tratamiento más apropiado a los pacientes con este tipo de infecciones.















