INTRODUCCIÓN
El raquitismo carencial fue descrito por primera vez por el médico inglés Francis Glisson en 1.650, al describir la epidemia que azotó a Somerset y Dorset en Inglaterra1, aunque probablemente se conocía de tiempo atrás; en la revolución industrial por las condiciones aceleradas de urbanización, con una baja exposición de los niños a los rayos solares por la contaminación ambiental, pasó a ser una causa importante de morbilidad especialmente en el norte de Inglaterra y Escocia. A comienzos del siglo XX el raquitismo nutricional fue epidémico en los lactantes y niños pequeños en muchas áreas de Asia, América del Norte, norte de Europa, así también en algunos países de Latinoamérica, particularmente en Chile donde se han registrado en Santiago desde 1913 a 1929 5.5% casos de raquitismo sobre un total de 138.722 niños estudiados2 y aún hoy sigue siendo un problema de salud pública en muchas zonas del mundo3. Con el aislamiento de la vitamina D en la década de 1930 y el descubrimiento del rol de los rayos solares ultravioletas en la curación del raquitismo nutricional, métodos baratos y efectivos para la prevención y tratamiento del raquitismo nutricional se volvieron eficaces4, pero todavía a pesar de las mejoras en el cuidado de la salud de los niños, no se le puede considerar a la misma una enfermedad del pasado5.
Hasta hace poco tiempo era generalmente aceptado que el raquitismo nutricional era causado sólo por deficiencia de la vitamina D, mientras que una dieta pobre en calcio podría exacerbar la enfermedad. Sin embargo recientes estudios evidencian que el raquitismo nutricional es causado tanto por déficit de vitamina D, como también por un deficiente aporte de calcio en la dieta6,7; siendo esta última la principal causa de raquitismo en África8 y en Asia9, mientras el raquitismo por deficiencia de vitamina D, es la causa principal en América, Europa y parte del Medio Oriente. El raquitismo nutricional se relaciona con problemas multifactoriales a lo ancho del mundo10, que deben ser tenidos en cuenta mediante programas de vigilancia en la prevención en la etapa pre y post natal en especial en grupos de riesgo11.
Nuestro país se encuentra ubicado en la zona subtropical, donde los rayos solares tienen por su oblicuidad una longitud de onda entre 296-310 nm, la cual es adecuada para la síntesis de la pro-vitamina D en la piel y debido a que la mayoría de los niños se exponen en tiempo suficiente al sol, no se ha descrito hasta ahora ningún caso de raquitismo carencial, motivo por el cual se presenta el primer paciente detectado con dicha enfermedad y que puede servir como una alerta ante otros casos que podrían no ser diagnosticados en forma adecuada, con lo cual se retrasaría el tratamiento apropiado.
CASO CLÍNICO
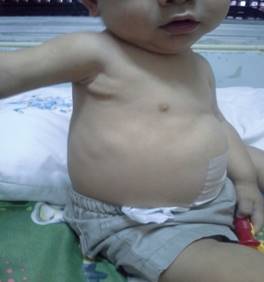
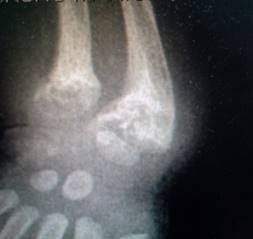
B. M. niño de 2 años 3 meses de edad, de sexo masculino, procedente de Ciudad del Este, con antecedente de hipoplasia renal izquierda, hidronefrosis del mismo lado, siendo monorreno, se internó por primera vez a los 3 meses de edad por enfermedad renal crónica, siendo sometido desde entonces a diálisis peritoneal ambulatoria hasta el momento actual, la cual era controlaba periódicamente en el servicio de nefrología del Hospital Central del IPS. Fue internado en el servicio de pediatría el día 9/11/16, ingresando con un peso de 7.890 gramos (debajo del P3), con talla de 74 cms. (debajo del P3) y una circunferencia cefálica de 51 cms (en el P50), debido a que presentó una obstrucción distal del catéter de la diálisis peritoneal; se le realizaron análisis que revelaron Hg: 9.9 grs%; G.R: 4.020.000/mm3, G.B: 6.430/mm3; N: 37%, L: 54%, M: 1%, E: 8%, Na: 141 mEq/l, Cl: 106 mEq/l, K: 3.86 mEq/l, urea: 120 mg/dl, creatinina: 2.7 mg/l, FA:1.003 mg/l, Ca:7.9 mg/dl, P: 6,1 mg/dl, la gasometría: pH:7.31, HCO3:19.6, EB:-5.7, orina con densidad 1010, pH: 7, leuc. 2-4/c; la proteinemia: 5.6 g/dl, albúmina: 3.6 g/dl, globulinas: 2 g/dl; presentando al examen físico signos clínicos compatibles con raquitismo: pulseras radiales (Figura 1) y tibiales, con rosario costal raquítico y el surco de Harrison (Figura 2), a nivel del cráneo presentaba frente olímpica estando la fontanela anterior cerrada, además evidenciaba hipotonía muscular generalizada, con retraso del desarrollo motor, ya que a pesar de su edad aún no se mantenía en pie ni siquiera con apoyo, teniendo en cambio buen desarrollo cognitivo. Ante esos hallazgos se realizaron estudios radiológicos que revelaron; en el puño ensanchamiento de la epífisis inferior del radio y del cúbito con la imagen en copa invertida, desflecamiento del borde de la epífisis, con descalcificación osteoporótica de los huesos que se revela por disminución de la densidad ósea (Figura 3), al igual que en la cabeza del húmero y a nivel de la articulación condro-costal. El análisis reveló: PTH (Parathormona): 2.809 ug/ml, la Fosfatasa alcalina 917 mg/dl y la dosificación de la vitamina D2 en sangre dio un valor de <20 nmol/l, con lo cual se hizo el diagnóstico de raquitismo carencial, indicándose 3.000 UI de calcitriol (1-25(OH)D2).
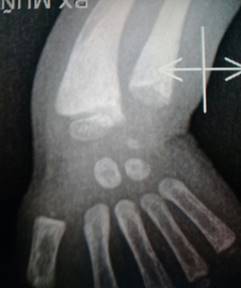
Fue dado de alta el 18/11/16 con indicación de seguir con calcitriol 3.000 UI/día, Carbonato de Calcio 500 mg/día, sulfato ferroso 3 mg/kg/día y todas las medida relacionadas con el tratamiento de su enfermedad renal crónica. En el control a los 4 meses una nueva RX de la región radio cubital reveló mejoría de dichas lesiones óseas del raquitismo, con recuperación de la calcificación (ver Figura 4), clínicamente manifestada por la desaparición de la pulsera radio-cubital (Figura 5). El análisis laboratorial reveló: Ca: 9.4 mg/dl, P: 7 mg/dl, PTH: 2.093 mg/dl, FA fosfatasa alcalina: 609 mg/dl, proteínemia: 6.9 g/dl, albúmina: 4.1 g/dl, globulinas: 2.8 g/dl; urea: 129 mg/dl, Cr: 3.5 mg/dl, orina con densidad 1.010, leuc. 2-/c, proteína +, con mejoría progresiva de la función motora, consiguiendo permanecer en pie con apoyo.
DISCUSIÓN
La vitamina D proviene de aceites de pescado, mariscos y de alimentos fortificados de la dieta y principalmente de su síntesis en la piel por la acción de los rayos solares, cuyos fotones UVB (Ultra Violeta B) penetran en la misma con una longitud de ondas entre 296-310 nm, a partir del cual se produce la conversión del 7-dihidrocolesterol en Previtamina D3, que se incorpora a los quilomicrones para ser absorbidos en el sistema linfático y desde ahí entra a la circulación ligándose a la DBP (Proteína ligadora de la vitamina D) que la transporta hasta el hígado, lugar en el cual la vitamina D se libera de la DBP y en el hepatocito experimenta hidroxilación en el C-25 por acción enzimática de la 25-hidroxilasa, transformándose en 25-hidroxivitamina D2 (25(OH)D) o vitamina D2 o calcidiol, forma en que se encuentra mayormente circulando en la sangre y cuya medición sirve para establecer el estado o el nivel de la vitamina D de una persona, debido a que su vida media en la circulación es de 2 semanas. La 25(OH)D al salir del hígado se liga de nuevo a la DBP y ese complejo al llegar a los riñones se une a la membrana plasmática de las células del túbulo renal; transportada dentro de la célula la 25(OH)D es liberada y a nivel mitocondrial por acción de la enzima 1α-hidroxilasa CYP27B1 produce hidroxilación del C-1, convirtiéndose en 1,25 hidroxivitamina D (1,25(OH)2D), vitamina D3 o calcitriol que es la forma biológicamente activa de la vitamina; a nivel renal una tercera enzima, la P450 citocromo mitocondrial-24 hidroxilasa cataliza la 24-hidroxilación de la 25(OH)D y de la 1,25(OH)D produciendo los metabolitos 24,25(OH)2D y 1,24,25(OH)3D respectivamente, con funciones desconocidas. El calcitriol tiene una acción de tipo hormonal y es responsable de mantener la homeostasis del Ca y del P; a nivel de las células del intestino delgado la 1,25(OH)2D se une a receptores específicos de membrana VDR, que pertenece a las súper-familias de receptores de hormonas nucleares que incluye las hormonas esteroideas, tiroideas y ácido retinoico, cuyo gen se encuentra en el cromosoma 12q14; el clivaje 1,25(OH)2D-VDR forma heterodímeros con los receptores del ácido 9-cis-retinoico (RXR), formando el complejo 1,25(OH)2D-VDR-RXR que aumenta la expresión del canal del calcio, permitiendo que mayor cantidad de Ca entre al enterocito, donde la proteína ligadora del calcio calbidin 9K dependiente de vitamina D (responsable del 80% del Ca absorbido), ayuda a su translocación a la circulación sanguínea donde circula el 45% como Ca++ (Ca iónico), el 40% ligado a la albúmina y el 15% como complejos de citrato, sulfato o fosfato de calcio; la 1,25(OH)2D promueve también la absorción de P en el intestino delgado y la reabsorción renal del mismo, 70-80% en el borde en cepillo del túbulo contorneado proximal, del 5-10% en el tubo contorneado distal y del 2-3% en el tubo colector por medio de los co-transportadores sodio-fosfato (NPi) de los cuales existen tres tipos, denominados tipo l, tipo ll y tipo lll, siendo el tipo l el responsable de la reabsorción del 70% del total del P, cuyo gen PHEX está ubicado en el cromosoma Xp22.1; cada ion P en unión con 3 iones Na son transportados al citoplasma de las células de la nefrona y de ésta el P sale por acción de la bomba Na+-K+-ATPasa que se encuentra en la parte basolateral de la célula tubular. La 1α-hidroxilasa renal es regulada por el Ca, el P, la PTH (hormona Paratiroidea) y el propio calcitriol; la 1,25(OH)2D ayuda a mantener la homeostasis del Ca actuando en el cartílago de crecimiento que contiene los receptores VDR en los osteoblastos, induciendo la expresión del activador del receptor de la proteína de membrana del ligando NF-kB (RANKL). El RANKL en la membrana plasmática del osteoblasto se une al RANK del preosteoclasto, induciendo a que el mismo madure a osteoclasto, el cual libera colágeno y ácido hidroclórico para disolver el hueso y liberar de sus depósitos Ca y P hacia la circulación. Siendo la principal función fisiológica de la Vitamina D3 la mantención de niveles del Ca y del P dentro del rango normal y a través del aumento de la concentración del Ca extracelular controla indirectamente la secreción de la PTH, tiene acción inhibitoria directa sobre su transcripción génica en las paratiroides, de tal modo que la reducción de la calcemia determina el aumento en la secreción de la PTH, que estimula la reabsorción tubular de Ca, promueve su movilización a partir del hueso y estimula la formación de 1,25(OH)2D. El calcitriol permite al Ca sostener sus múltiples funciones metabólicas, actuando en la transmisión neuromuscular, la mineralización del hueso y en el crecimiento12,13; en un reciente estudio longitudinal realizado en el este de Australia en individuos sanos de ambos sexos a los 6, 14, 17 y 20 años, para medir el contenido mineral del hueso (CMO) a esas edades y su relación con los niveles en el plasma de 25(HO)D, se encontró una significativa correlación más en los varones, entre los niveles en plasma de 25(OH)D y el CMO14, masa ósea que se forma en la niñez y en la adolescencia, que será fundamental para la masa ósea del adulto15, la cual tiene mucha importancia para la prevención de la osteoporosis en el futuro.
Los niveles de 1,25(OH)2D y de la DBP en el plasma durante el embarazo están el doble más elevados que el rango de referencia del adulto normal, mientras que sus niveles caen en pico luego del parto, análogamente a la ocurrencia de estos cambios bioquímicos en la madre, los niveles de DBP en el recién nacido caen posiblemente debido a la súbita desaparición del estímulo estrogénico y al mismo tiempo porque el abastecimiento mineral por vía transplacentaria se corta. Estos dos factores son probablemente responsables del estímulo de la síntesis de 1,25(OH)2D y/o de la inhibición de su degradación, resultando en un agudo incremento de 1,25(OH)2D. La concentración de la 25(OH)D y de la 1,25(OH)2D en la leche materna es muy baja, con una concentración media de 25 UI/L de 25(OH)D y a juzgar por los niveles en el plasma, la reserva de la vitamina D de muchos niños nacidos de madres con status normal de vitamina D, se agotan aproximadamente a las 8 semanas después del parto16, por otra parte se han descrito casos de raquitismo congénito debido a la deficiencia nutricional grave de vitamina D en la madre17,18.
La deficiencia de la vitamina D ha sido asociada con raquitismo en la infancia y con osteomalacia en la adultez19 y contribuye al riesgo de osteoporosis, la insuficiencia moderada de 25(OH)D antes del desarrollo de raquitismo puede asociarse con convulsión hipocalcémica, hipocrecimiento, letargo, irritabilidad e infecciones respiratorias, aparece principalmente durante la lactancia y la primera infancia por la combinación de una ingesta en que son pocas las fuentes naturales de vitamina D especialmente en los alimentados en forma exclusiva con leche materna los primeros meses de vida20, por la síntesis cutánea inadecuada que es menor en los niños con pigmentación cutánea oscura que requieren de más altos aportes de 25(OH)D21, por el uso de bloqueadores solares, así como durante el invierno por la mayor oblicuidad de los rayos solares, que cuanto más alejada del ecuador sea la latitud su incidencia será más oblicua y con ondas UVB por debajo de 296 nm, agravado por el hecho que las mismas no atraviesan el vidrio de las ventanas y por el uso de abrigos que cubren casi toda la piel como reveló el estudio en niños sanos entre 4 a 9 años en Ushuhaia (la ciudad más austral del mundo), donde la incidencia de Hipovitaminosis D en invierno fue más alta al ser comparada con niños de la ciudad de Buenos Aires o Tucumán22, hecho que motivó la profilaxis exógena con la ingesta sistemática de vitamina D23.
La deficiencia de Vitamina D ha sido investigada en diversos países y afectó al 23% de niños y adolescentes sobre un total de 123.989 estudiados en China24; en EEUU la deficiencia e insuficiencia de vitamina D afectó a 40 % de los 365 lactantes de 8 a 24 meses estudiados25; Salamoun en Líbano encontró una incidencia de 84% de déficit de 25(OH)D en niños escolares26, mientras en Islandia país frío, los niveles al año de edad y a los 6 años tenían valores normales y altos por el aporte sistemático de vitamina D27. El bajo aporte de calcio de la dieta, ha sido constatada en investigaciones realizadas en diferentes países, tanto en grupos de niños y adolescentes sanos estudiados en un alto porcentaje, ocurriendo en un momento crítico del desarrollo del esqueleto en que se forma la masa ósea12,26.
La deficiencia de vitamina D por <20ng/ml es común en niños con enfermedad renal crónica (ERC) independientemente de la causa en su estado final y fue mayor en los que tuvieron un baja concentración de albúmina (<3 g/dl)28; en un estudio longitudinal en 506 niños con ERC, se encontraron en el 28% niveles bajos de 25(OH)D de los pacientes con una relación significativa con mayor edad, piel oscura, aumento del índice de masa corporal, durante el invierno, menor oferta diaria de leche, no uso de suplementos con vitamina D y proteinuria29
El receptor VDR de la 25(OH)D se encuentra distribuido en numerosos tejidos y órganos, por lo cual cada vez hay más evidencia que la vitamina D tiene un amplio espectro de significativos efectos inmunomoduladores, tanto de la inmunidad innata como de la adquirida, de tal modo que la deficiencia de vitamina D se asocia no sólo con raquitismo, sino con diversas patologías como resistencia a la insulina, enfermedades autoinmunes, cardiovasculares, infecciones y de cánceres particularmente del seno, próstata y del colon30.
El raquitismo es una enfermedad ósea caracterizada por la disminución de la mineralización de la placa epifisaria (metáfisis) del cartílago de crecimiento, con acumulación del tejido osteoide no mineralizado. La formación y el crecimiento óseo dependen de la producción de la matriz ósea, compuesta principalmente por colágeno y su mineralización a través del depósito de cristales de hidroxiapatita, compuesta básicamente por calcio y fósforo. La falla del proceso de mineralización, acompañada de retardo del crecimiento, tiene como una de sus principales causas la inadecuada concentración extracelular de los iones Ca y P, la falta o el compromiso de la acción de los elementos responsables por su absorción, particularmente la vitamina D18, caracterizándose desde el punto de vista clínico por alteraciones óseas: frente olímpica, retardo del cierre de la fontanela anterior y tempranamente craneotabes, que consiste en disminución de la consistencia del cráneo en los huesos parieto-occipitales similar a pelota de ping pong; el ensanchamiento distal de la extremidad radio-cubital (pulsera radial), de la extremidad distal tibial (pulsera tibial) y de las articulaciones condro-costales que forman el rosario costal raquítico, reflejan el exceso de formación de tejido osteoide no calcificado; el surco de Harrison que es un línea visible entre el tórax y el abdomen formada por la musculatura del diafragma en su inserción en las costillas, reforzado por la distensión abdominal debida a la hipotonía muscular generalizada característica del raquitismo, que provoca retardo del desarrollo motor del niño sin afectar su desarrollo mental; piernas encorvadas (genu valgum o genu varum) más común cuando el niño comienza a pararse o caminar debido al reblandecimiento óseo, a veces en ausencia de otros hallazgos en los primeros dos años de edad31 o fracturas patológicas. Desde el punto de vista bioquímico la primera fase de la enfermedad se caracteriza por descenso de los niveles del calcio, elevación de la fosfatasa alcalina (FA), cifras normales de fósforo; en la segunda fase elevación de la hormona paratiroidea (PTH), que promueve la reabsorción del calcio del hueso con normalización de los niveles de mismo, descenso del fósforo, manteniéndose elevada la FA y en la tercera fase de agotamiento hay una nueva caída de los niveles del calcio y del fósforo, con niveles altos de FA y PTH. El raquitismo puede iniciarse o debutar con tetania o convulsiones por la hipocalcemia32,33, que en la serie de Ward de 104 casos fue del 19%24, diagnóstico que debe ser tenido en cuenta en las salas de urgencias pediátricas para un tratamiento adecuado.
El raquitismo se asoció también con una mayor tasa de infecciones de las vías respiratorias34,35, aunque en una investigación reciente realizada en Turquía, no se encontró ninguna correlación entre niveles insuficientes de vitamina D y las infecciones del tracto respiratorio inferior cuando fueron comparados con el grupo control, 25% versus 22%36. Una reciente revisión analizó el rol de la Vitamina D en varios mecanismos antiinflamatorios a nivel pulmonar, debido a la presencia de VDR en células del sistema inmune innato como las dendríticas, mononucleares, macrófagos y su contenido en sistemas enzimáticos responsables de la activación y degradación de la 1-25(OH)2D; la inducción en monocitos, en la piel y pulmón del péptido catelicidina con un rol central en la defensa contra infecciones bacterianas, regulando la menor expresión de citosinas y quimosinas pro inflamatorias; las células epiteliales respiratorias expresan la 1α-hidroxilasa que transforma la 25(OH)D en la activa 1-25(OH)2D. No se encontró en niños que la Vitamina D tenga ningún efecto en la aparición de las bronquiectasias de la fibrosis quística o de otra causa37.
El raquitismo carencial también puede ser causado por una dieta pobre en calcio o rica en fitatos que dificultan la absorción del mismo2,9.
El raquitismo puede ser causado por una variedad de causas, de donde surgen diferentes tipos.
Raquitismo Vitamina D-dependiente tipo l o por deficiencia de 1α-hidroxilasa Vitamina D: es secundario a mutaciones en el gen CYP27B1 del C12q14 que codifica la producción renal de 1-α-hidroxilasa38, se acompaña de niveles altos o normales de 25(OH)D y la ausencia de 1-25(OH)2D; responde al tratamiento con Calcitriol 39,40.
Raquitismo Vitamina D-dependiente tipo ll: es un raro desorden autosómico causado por mutaciones en el gen receptor de la vitamina D VDR, que se caracteriza por elevados niveles de 25(OH)D; a diferencia del anterior no responde al tratamiento con 1,25(OH)2D3.
Raquitismos vitamina D-resistentes o raquitismo hipofosfatémico familiar: son causados por mutaciones en el gen PHEX localizado en el cromosoma Xp22.1, que normalmente regula la absorción del fosfato en el túbulo renal proximal, al degradar el FGF-23 (Factor de Crecimiento Fibroblástico)41 producido por los osteocitos, que induce la pérdida renal de P por supresión de la expresión de los co-transportadores NPi tipos l y ll en la superficie apical del túbulo contorneado proximal, resultando en hiperfosfaturia con hipofosfatemia, que cursa con niveles normales de 1,25(OH)2D, existiendo la variante raquitismo hereditario hipofosfatémico con hipercalciuria que se acompaña de niveles elevados de 1,2(OH)2D. Son refractarios a la administración de vitamina D y el tratamiento se realiza con fosfatos42.
El raquitismo carencial también puede ser secundario a diversos síndromes que cursan con malabsorción intestinal como la fibrosis quística o la enfermedad celíaca, siendo a veces la forma de debut de ésta última antes de que presente síntomas gastrointestinales acompañantes y su mecanismo se debería a la pérdida de la arquitectura vellositaria del intestino que produce malabsorción del calcio y de la vitamina D, por la liberación de citosinas pro-inflamatorias, activando los osteoclastos que representa la principal acción local del mecanismo responsable del desarreglo óseo43.
El raquitismo carencial en los países desarrollados formaba parte del pasado, pero debido a la alta inmigración en Europa hoy se presenta como una enfermedad re-emergente44,45; en Canadá especialmente en las regiones de latitud mayor de 75º46; en Japón por la costumbre de las madres de evitar en sus hijos la exposición a la luz solar la incidencia ha aumentado a una tasa de 12.3/100.00047; en Estados Unidos fueron publicados 166 casos de 1986 a 2003, de los cuales 96% fueron alimentados con alimentación materna exclusiva, siendo el 83% de los niños afectados afroamericanos48, en Alaska fue mayor en nativos con una tasa de 4.2/100.00049, en Australia de 398 niños estudiados el 98% fueron de origen africano con una incidencia de 4.9/100.000/año50; en Qatar el 23.9% de los niños estudiados fueron afectados independientemente de su posición económica, donde la causa principal fueron falta de exposición solar y la lactancia materna exclusiva 51. El raquitismo carencial afecta a niños a diferentes edades con una incidencia mayor entre los 2 a 3 años9,28,29,30,32.
Los hallazgos clínicos presentados por nuestro paciente eran propios del raquitismo, así como también los signos radiológicos encontrados en el mismo y como estaba sometido a diálisis peritoneal, posiblemente no fue expuesto a la luz solar en forma apropiada y suficiente, así como tampoco había recibido dosis adecuada de vitamina D3 por vía oral. El nivel de 25(OH)D <20 nmol/ml constatado en la sangre certifica la deficiencia de vitamina D3; aunque también en los pacientes con enfermedad renal crónica se encuentran cifras bajas pero no con esos niveles tan reducidos y suele asociarse con hipoalbuminemia por debajo de 3 g/dl y proteinuria, lo que no tenía nuestro paciente, porque el nivel de su albúmina sanguínea siempre estuvo en el rango de la normalidad. La respuesta favorable a la administración de 3.000 UI de calcitriol, con mejoría de los signos clínicos y radiológicos observados en el control posterior, hacen al diagnóstico de raquitismo carencial o por deficiencia de vitamina D3, ya que si hubiera sido raquitismo dependiente de la vitamina D tipo l o del tipo ll, los niveles de la 25(OH)D2 serían normales o altos respectivamente.
La recomendación de administrar Vitamina D a los lactantes alimentados en forma exclusiva con lactancia materna, se debe realizar tempranamente a fin de prevenir el raquitismo52; la administración de vitamina D a la madre lactante de una dosis única de 150.000 UI o 5.000 UI diarias por 28 días, permitió mantener niveles adecuados de vitamina D en la leche materna, así como en el suero del lactante53.
El Consenso Global de Recomendaciones para la Prevención y Tratamiento del Raquitismo Nutricional, constituido por 33 expertos en representación de 11 organizaciones científicas internacionales de Europa, América latina, Estados Unidos, África y Asia, en estudios basados en la evidencia clasifican el estatus de vitamina D, según los valores en la sangre de la 25(OH) D: suficiente >50 nmol/l, insuficiente entre 30-50 nmol/l y deficiente <30 nmol/l; el aporte necesario de calcio en la dieta para prevenir el raquitismo: en lactantes de 0-6 meses es de 200 mg/día, de 6-12 meses es de 260 m/día, para mayores de un año >500 mg/día, insuficiente de 300-500 mg/día y deficiente <300 mg/día; recomiendan 400 UI/día vitamina D para prevenir el raquitismo de los 0-12 meses independientemente del tipo de alimentación y en mayores de 12 meses y en adultos >600 UI/día. Para tratamiento del raquitismo recomiendan 2.000 UI de vitamina D por un mínimo de 3 meses que debe ser realizado por vía oral preferentemente a la vía i/m y un aporte de calcio de 500 mg/día54; en la primera semana de tratamiento hay un aumento del recambio óseo y la fosfatasa alcalina es el más seguro marcador para el seguimiento y la monitorización de los pacientes, que otros componentes como la osteocalcina, PICP y NTX55.