INTRODUCCIÓN
El cáncer colorrectal (CCR) es una patología rara en la infancia, y se caracteriza por datos histológicos diferentes y más agresivos comparados con los de los adultos 1,2.
Algunos síndromes familiares favorecen el desarrollo o tienen un riesgo aumentado de desarrollar CCR como la poliposis adenomatosa familiar y los cánceres colorrectales hereditarios no polipósicos3. Sin embargo, algunas asociaciones están poco descritas como asociados con una neurofibromatosis tipo 14,5.
El CCR es una neoplasia frecuente en adultos, siendo el tercer cáncer más frecuente tras el de pulmón y el de mama. Sin embargo, es muy raro en niños1,2. Su incidencia no es conocida por la escasez de los estudios epidemiológicos6. Algunos autores la estiman en 1-2 casos por millón2. Pawel et al7, publicaron al menos 6 series y cada una estaba compuesta por más de 10 pacientes. La serie con mayor número de pacientes con tumores del colon y recto encontrada es la de Yang y cols, con 270 casos (8. En su mayoría, los casos pediátricos son esporádicos1. Presentamos el caso de un niño de 8 años con CCR metastático de alto grado.
CASO CLÍNICO
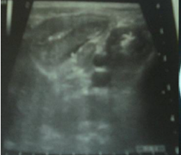
Paciente masculino de 8 años de edad, primer hijo de una pareja no consanguínea, nacido de un embarazo normal, a término y procedente del sur de Argelia. Un tío materno falleció por un CCR. Durante los últimos 6 meses presentó diarrea crónica muco-sanguinolenta, rectorragia y pérdida de peso. Previo a su admisión, presentó un cuadro de invaginación colo-cólica (Figura 1) que se resolvió espontáneamente.
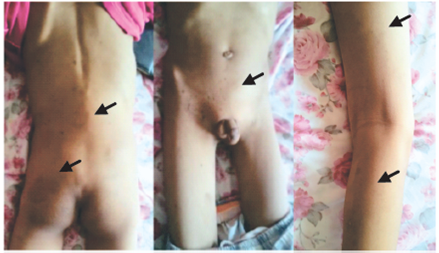
Al examen físico: peso <2 desviaciones estándares, manchas café con leche (MCCL) de tamaño y forma variables difundidas en la parte baja del abdomen y los miembros inferiores (Figura 2), sospechando una neurofibromatosi tipo 1 (NF1).
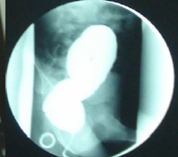
La opacificación cólica con bario reveló una falta de progresión a nivel sigmoideo (Figura 3).
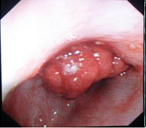
La colonoscopia evidenció una masa polipoide obstructiva, pediculada y ulcerada de 4 cm de longitud (Figura 4).
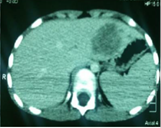
Se practicó una citopunción cuyo estudio histológico concluyó en una displasia de alto grado. La fibroscopia digestiva alta fue normal. La Tomografía axial computarizada (TAC) toraco-abdominal reveló una metástasis hepática del segmento III de 47x41x40 cm (Figura 5), así como una centellografia ósea normal. Se realizó una colectomía total con anastomosis íleo-rectal, seguida unas semanas después de una lobectomía hepática.
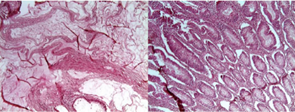
El informe anatomo-patológico de la pieza cólica reveló 23 pólipos, 112 ganglios reaccionales e histológicamente un tumor túbulo-velloso con 30% de componente mucinoso (Figura 6).
El paciente fue clasificado como Duckes D, T1N1Nx y evolucionó favorablemente en su postoperatorio. Recibió 6 ciclos de quimioterapia (oxaliplatina, 5 fluorouracilo y leucovorina), bien tolerada, pero con problemas de retención.
Ante la NF1, se practicaron un examen oftalmológico y una TAC cerebral y no revelaron anomalías. Además, la exploración endoscópica digestiva de toda la familia fue normal.
DISCUSIÓN
El cáncer colorrectal (CCR) es la segunda neoplasia sólida digestiva en niños, tras los cánceres primarios del hígado y representa 1% de los cánceres pediátricos 9. Se describió en todas las franjas etarias infantiles incluso en el recién nacido, pero los de la segunda década de edad parecen los más afectados. Entre los 0-9 años, su frecuencia es 0.4-0.9% y el sexo-ratio es 2.2:19,10,11.
En los adultos, se considera que el consumo excesivo de carne roja y las dietas pobres en fibras y pescado aumentan el riesgo del CCR. En la infancia, se trata de factores genéticos. Se estima que entre 10 y 30% de los casos pediátricos tienen un componente hereditario 7,12. Existen varios síndromes que aumentan el riesgo de desarrollar un CCR como la poliposis adenomatosa familiar, síndrome de Peutz-Jehgers, síndrome de Gardner y Bloom, síndrome de Turcot. Sin embargo, el cáncer colorrectal hereditario no polipósico o síndrome de Lynch es el más comúnmente relacionado con el CCR pediátrico. Es responsable del 2-7% de todos los cánceres cólicos3, con un patrón de herencia autosómico dominante con alta penetrancia (60-80%) y relacionado con mutaciones genéticas de los genes MLH1 MSH2, MSH6 y HPMS26,13.
Por otro lado, Greenstein et al. encontraron que el 10% de los pacientes con colitis inflamatoria desarrollan un CCR, con un riesgo multiplicado por 20, coincidente con otros trabajos14,15.
Existe un riesgo mayor de desarrollar un tumor maligno en los pacientes con NF1, comparados con la población en general. Se trata más de gliomas y leucemia mieloide, mientras que la asociación de NF1 con los tumores digestivos es rara16. Así, los tumores abdominales encontrados en este contexto están clasificados en 5 categorías (tumores neurogénicos, neuroendócrinos, no neurogénicos mesénquimales gastrointestinales, embrionarios, y adenocarcinomas (rectocólicos. pancreáticos, biliares) 16,17. En nuestro paciente, las rectorragias obligaron a consultas adicionales y el examen clínico permitió poner en evidencia las MCCL, cuya asociación con un CCR es muy poco descrita.
La sintomatología clínica del CCR es inespecífica. Puede revelarse con rectorragia, sangrado oculto, dolores abdominales, pérdida inexplicada o sin razón aparente de peso, estreñimiento. A veces, como en nuestra presentación, se manifiesta con oclusión o invaginación intestinal. Algunas series indican que 50-60% de los casos pediátricos se presentan con obstrucción luminal versus 18% en adultos18. La ubicación del tumor puede influir en los síntomas, por ejemplo, la localización sigmoideo-rectal podría ser asociada con cambios del calibre de las heces.
La piedra angular para el diagnóstico es la colonoscopía, que precisa el aspecto endoscópico, la localización y permite tomar biopsias. Se completa la exploración con exámenes radiológicos (abdomen sin preparación, ecografía abdominal, colon por enema, TAC, RMN) que son necesarios para clasificar y estadificar la enfermedad según la clasificación de referencia (de Duckes o TNM). Actualmente, la ecoendoscopia es la investigación de elección para estudiar la extensión del tumor rectal6. El tumor primario puede ubicarse a lo largo del colon y recto, parece más en el colon derecho, y en paralelo en el adulto, es sobretodo sigmoideo-rectal2,8.
El estudio histológico (fragmento/pieza obtenido/a vía citopunción, laparotomía o cirugía) nos informa del tipo celular, del grado de severidad y de la infiltración. Las características histológicas del CCR pediátrico son muy distintas a las del adulto. Así, predominan los subtipos mucinoso y/o a anillo de sello, caracterizados por ser poco diferenciados19 y se encuentran en el 75% de los casos7,19, mientras que en el adulto representan solo 1% de los CCR y son de mejor pronóstico1.
El pronóstico depende de numerosos factores. El intervalo de tiempo entre la aparición de los síntomas y el momento del diagnóstico, que oscila aproximadamente entre 3 y 21 meses y puede causar un retraso enorme en el diagnóstico9,12. Según los datos de la literatura, la supervivencia no sobrepasa los 5 años. La tasa de supervivencia varía entre 7-12% en los menores de 18 años1. Los tumores mucinosos o a anillo de sello son agresivos y rápidamente infiltrantes, engendrando precozmente metástasis linfáticas, peritoneales, vasculares y ovarias, así como también hepáticas, las cuales son de extremadamente mal pronóstico1,5,16. En nuestra presentación, se hizo el diagnóstico tras 6 meses de evolución, en un estadio avanzado con metástasis hepática.
El tratamiento se basa en la extirpación del tumor primitivo con una cirugía carcinológica radical, pero la dificultad reside en el manejo de las localizaciones segundarias. La resección completa es más fácil en adultos. No hay protocolo bien definido destinado a los niños6. La quimioterapia FOLFOX (oxaliplatina, 5 fluorouracilo y leucovorina) es la más utilizada20. Algunos asocian radioterapia notablemente en los tumores rectales, para otros autores su uso es controvertido21.
Consideramos de suma importancia la realización de estudios auxiliares de diagnósticos adecuados (imágenes y biopsia si fueran necesarios), en presencia de obstrucciones y sangrado intestinal, a fin de descartar aquellos casos de naturaleza maligna, para así llegar al diagnóstico temprano y al tratamiento oportuno.