Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO
Related links
-
 Similars in
SciELO
Similars in
SciELO
Share
Pediatría (Asunción)
On-line version ISSN 1683-9803
Pediatr. (Asunción) vol.43 no.1 Asunción Apr. 2016
https://doi.org/10.18004/ped.2016.abril.18-26
ARTÍCULO ORIGINAL
Factores de riesgo asociados a la sobrevida en niños y adolescentes con leucemia linfoblástica aguda
Risk Factors associated to survival in children and adolescent with Acute Lymphoblastic Leukemia
Angélica Jiménez de Samudio(1), Margarita Samudio(2), Miguela A. Caniza(3)
1 Departamento de Hematooncología Pediátrica. Facultad de Ciencias Médicas. Universidad Nacional de Asunción. San Lorenzo, Paraguay.
2 Instituto de Investigaciones en Ciencias de la Salud. Universidad Nacional de Asunción. San Lorenzo, Paraguay.
3 Department of Infectious Diseases, Department of Global Pediatric Medicine and the International Outreach Program, St. Jude Children’s Research Hospital, Memphis TN, EE. UU.
Correspondencia: Dra. Angélica Jiménez de Samudio. E-mail: angelicasamudio07@gmail.com
Recibido: 17/09/2015; Aceptado: 28/01/2016.
Los autores declaran que no existen conflictos de interés en el presente estudio.
RESUMEN
Introducción: La leucemia linfoblástica aguda (LLA) es la forma más frecuente de cáncer en niños menores de 18 años. Hasta hace unos años, en los países en desarrollo, la sobrevida global y la sobrevida libre de eventos en la Leucemia Linfoblástica Aguda infantil no superaba el 50%. Existe escasa información publicada de factores de riesgo de mortalidad del paciente con LLA en el momento del diagnóstico en los países en desarrollo y ninguna información de Paraguay. Objetivos: Describir las características socio-demográficas, clínicas y laboratoriales e identificar los factores de riesgo de mortalidad de los pacientes con LLA internados en el Departamento de Hemato-oncología Pediátrica de la Facultad de Ciencias Médicas, Universidad Nacional de Asunción entre los años 2000 al 2012. Materiales y Métodos: Se realizó un estudio retrospectivo, descriptivo y, posteriormente, de casos y controles. Resultados: Fueron incluidos 472 pacientes con LLA menores de 18 años, edad media ± DE de 6,1 ± 4,3 años, sexo masculino (53%), la mayoría (84,3%) consultó por síndrome anémico. La mortalidad global fue de 41,7% (197/472) con una reducción significativa de 74% en el año 2000 a 14,9% en el año 2012. En el análisis multivariado los factores que se asociaron, en forma independiente, a la mortalidad fueron alto riesgo oncológico, desnutrición, padres sin escolaridad, recuento de leucocitos por encima de 50.000-mm3 y mala respuesta a la prednisona en el día 8 de inducción. La edad, el sexo y el ingreso financiero familiar no fueron asociados en forma significativa a la mortalidad. Conclusión: La mayoría de las características de los pacientes coinciden con las encontradas por otros autores. La mortalidad en este grupo de pacientes se ha reducido en forma significativa.
Palabras clave: Leucemia linfoblástica aguda, LLA, edad pediátrica, factores de riesgo, mortalidad, sobrevida.
ABSTRACT
Introduction: Acute lymphoblastic leukemia (ALL) is one of the most common oncological diseases in the pediatric age. Until recently, in developing countries, the average of overall survival and disease-free rates remained at about 50%. There is limited information in developing countries regarding the prognostic factors for mortality and no published information is available from Paraguay. Objective: The aim of the study was to describe the socio demographic, clinical and laboratory results and identify prognostic factors associated with mortality of LLA patients under 18, admitted in the Pediatric Hematology-Oncology Department, of the Faculty of Medical Sciences, National University of Asunción from 2000 to 2012. Materials and Methods: A retrospective, descriptive, and subsequently a case control study was carried out. Results: A total of 472 patients with a mean age ± SD of 6.1 ± 4.3 years (0-17 years) were included, male (53%), most of them (84.3%) consulted due to anemic syndrome. Overall mortality rate was 41.7% (197/472), with a highly significant reduction from 74% in 2000 to 14.9% in 2012. In multivariate analysis the factors independently associated with mortality were high oncologic risk, malnutrition, uneducated parents, leukocyte count above 50,000-mm3 and poor response to prednisone. The age, sex and household income were not associated significantly. Conclusions: Most of the patient characteristics were similar to those found by other authors. The mortality rate has been reduced significantly.
Keywords: Acute lymphoblastic leukemia (ALL), pediatric age, risk factors, mortality, survival rate.
INTRODUCCIÓN
Las Leucemias Linfoblásticas Agudas (LLA) constituyen el 75% de todos los casos de leucemias en niños, siendo el cáncer más frecuente en niños. Los datos obtenidos del Programa SEER del Instituto Nacional de Cancerología (Surveillance, Epidemiology, and Results) indican que entre los años de 1973-1991, la tasa ajustada para la edad aumentó de 2,7 a 3,3 casos por 100.000 niños entre las edades de 0 a 14 años (1). La LLA es diagnosticada en aproximadamente 2000 niños en los EEUU cada año, mientras que la Leucemia Mieloide Aguda en cerca de 500 niños y Leucemia Mieloide Crónica en menos de 100. La leucemia linfocítica crónica (LLC) la más frecuente en los adultos, ocurre muy poco en niños.
La incidencia de LLA es mayor en niños que en niñas y esta diferencia es mayor en la adolescencia, así como es particularmente evidente en los casos de Leucemias Linfoblásticas Agudas LLA T (2). Se presenta sobre todo entre los 2 a 5 años de edad, con pocos casos en menores de 1 año y adolescentes. La ocurrencia del pico a esta edad en varios países ha sido relacionada con la industrialización, sugiriendo el rol de los carcinógenos ambientales. En los Estados Unidos, los niños de raza negra no presentan el pico a esta edad y tienen una baja incidencia de LLA comparada con la raza blanca (3).
En un metaanálisis (4) se seleccionaron 29 publicaciones en las que se determinaron los factores de riesgo, al momento del diagnóstico, que se relacionan con una mejor sobrevida del paciente. Estos son la edad (de 1 a 9 años) (5), el sexo (femenino) y la no infiltración a sistema nervioso central. Los relacionados con las células leucémicas son el número de leucocitos (<50,000 células/μL) (6), el inmunofenotipo de células (tipo B), el índice de ADN (1.16–1.60) y la ausencia de traslocaciones t (9; 22), t (1; 19) y t (4; 11).
Además de la respuesta a la quimioterapia, se establece el riesgo de falla al tratamiento en cada paciente. A cada paciente se le asigna una categoría de riesgo, cuya nomenclatura tiene variaciones entre los distintos grupos internacionales que se dedican al estudio de esta neoplasia. El protocolo XV del St. Jude Children´s Research Hospital estratifica a los pacientes en cuatro grupos de riesgo: bajo, habitual o estándar, alto y muy alto (7). En nuestro país, dadas las limitantes para aplicar técnicas de inmunofenotipo y de biología molecular. Se estratifican a los pacientes en dos grupos de riesgo: bajo y alto.
Los signos y síntomas reportados en la literatura internacional incluyen fiebre (en 61% de los pacientes), hemorragias (en 48%), dolor óseo (en 23%), adenopatías (en 50%), esplenomegalia (en 63%) y hepatomegalia (en 68%) (8).
Con los protocolos actuales de tratamiento para niños con LLA, que incluyen terapias sistémicas y específicas del SNC (9), es posible obtener la remisión en más de 95% de los casos, y una supervivencia libre de recaída de 75 a 85% a cinco años del diagnóstico.
Existe escasa información de los países en desarrollo con respecto a los factores pronósticos de sobrevida y ninguna información publicada en Paraguay. El objetivo de este estudio es describir las características sociodemográficas, clínicas y laboratoriales e identificar los factores pronósticos asociados a la sobrevida de los pacientes menores de 18 años portadores de LLA internados entre los años 2000 al 2012 en el Departamento de Hemato-oncología Pediátrica de la Facultad de Ciencias Médicas de la Universidad Nacional de Asunción.
MATERIALES Y MÉTODOS
Contexto: Entre el año 2000 y el 2012, el Departamento de Hemato-oncología Pediátrica ha ido mejorando paulatinamente. Esta mejora culmina con un servicio de 20 cuartos con camas únicas, 4 cuartos de examinación, y laboratorios para estudios de rutina y especializados. Actualmente, el centro tiene 16 doctores, 62 enfermeras, 5 personal de laboratorio y 34 personal administrativo. El servicio ve un promedio de 100 nuevos pacientes al año, constituyendo las LLA el 40%.
Población: Fueron incluidos en el estudio los pacientes menores de 18 años de edad con diagnóstico nuevo de LLA confirmada por punción de medula ósea, que no hayan recibido tratamiento previo. Fueron excluidos los pacientes menores de 18 años de edad con diagnóstico de LLA que abandonaron su seguimiento en el Departamento de Hemato-Oncologia Pediátrica, o con historias clínicas incompletas.
Definiciones: Para la parte analítica del estudio los pacientes fueron clasificados en:
- Casos: niños y adolescentes menores de 18 años, portadores de LLA, internados entre los años 2000 y 2012 en el Departamento de Hemato-oncología Pediátrica de la Facultad de Ciencias Médicas, Universidad Nacional de Asunción, fallecidos a consecuencia de su patología de base.
- Controles: niños y adolescentes menores de 18 años, portadores de LLA, internados entre los años 2000 y 2012 en el Departamento de Hemato-oncología Pediátrica de la Facultad de Ciencias Médicas, Universidad Nacional de Asunción, que se mantuvieron vivos por al menos 12 meses de observación posteriores a su quimioterapia.
Diseño del estudio: Se realizó un estudio retrospectivo, descriptivo y, posteriormente, analítico de casos y controles de las historias clínicas de pacientes pediátricos con LLA.
Se recurrió a los archivos del Departamento de Hemato-oncología Pediátrica de la Facultad de Ciencias Médicas, Universidad Nacional de Asunción, con la autorización del Jefe del Departamento de Hemato-oncología Pediátrica, para la identificación de las historias clínicas de los pacientes con los criterios de selección. Las variables analizadas fueron las características demográficas: edad, sexo, raza, procedencia, distancia en horas de la casa al hospital, nivel educativo de los padres, salario mínimo de los padres. Síntomas: fiebre, trastornos hemorragíparos, pérdida de peso, astenia, anorexia, dolores óseos, cefalea, vómitos, tiempo de evolución de los síntomas. Signos físicos: Peso, talla, estado nutricional, palidez, hepatomegalia, esplenomegalia, adenomegalia, tumor mediastínico. Laboratoriales: hemoglobina, recuento de glóbulos blancos, recuento de plaquetas. Terapéuticas: respuesta al tratamiento de inducción día 8 con prednisona y día 33, óbito y tiempo trascurrido hasta el óbito, causa del óbito. No se analizaron estudios inmonofenotípicos, biología molecular y citogenética por carecer de los mismos.
Análisis estadístico: Los datos fueron ingresados en una hoja de cálculo de Micro soft Excel©.versión 8.0 y posteriormente analizados con el programa Epi Info 2000© (CDC, Atlanta) utilizando estadística descriptiva para resumir los datos en forma de proporciones y medidas de tendencia central según corresponda. Para el análisis bivariado de variables nominales se utilizó la prueba Chi2, y para comparar las medias de variables cuantitativas de distribución normal se utilizó la prueba t de student o de ANOVA según corresponda. Para comparar las medianas de las variables cuantitativas de distribución no paramétrica se utilizó la prueba de Mann Whitney o Kruskall Wallis según corresponda. Se consideró significativa un valor de p<0,05. Los resultados se presentan en tablas o gráficos. La fuerza de la asociación se expresó en forma de OR.
RESULTADOS
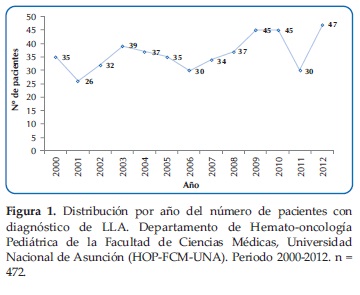
En el periodo del estudio, entre los años 2000 a 2012, fueron evaluados 472 pacientes con Leucemia Linfoblástica Aguda (LLA). El mayor número (n=47) se observó en el 2012 y el menor en el 2001 (n=26). La distribución por año se muestra en la Figura 1.
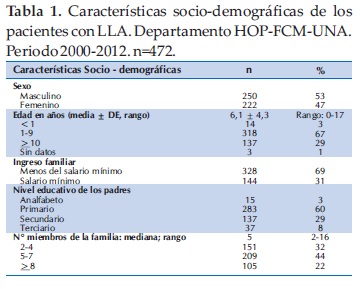
En cuanto a las características socio-demográficas, se observó un leve predominio del sexo masculino (53%). La edad media ± desvío estándar (DE) fue de 6,1 ± 4,3 años con un rango entre 0 a 17 años. El 67% (n=318) de los niños tenía edades entre 1 a 9 años. Con respecto al ingreso familiar, la mayor proporción de las familias no recibía salario mínimo (69%). El 60% (n=283) de los padres tenía nivel educativo primario. La mediana del número de miembros del hogar fue de cinco con un rango entre 2 y 16 miembros (Tabla 1).
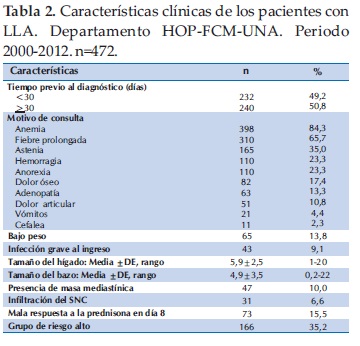
El tiempo trascurrido entre el inicio de los síntomas y el diagnóstico fue mayor de 30 días en el 50,8%. El 84,3% (n=398) de los pacientes consultó por síndrome anémico, el 65,7% por síndrome febril prolongado, el 23,3% por manifestaciones hemorrágicas, como petequias, equimosis, epistaxis y gingivorragia. El 13,6% de los pacientes tenía bajo peso, 9,1% tenía infección grave al ingreso. El tamaño promedio del hígado fue de 5,9±2,5 y del bazo 4,9±3,5. La infiltración al SNC estuvo presente en el 6,6% y en el 10% masa mediastínica, 3,4% presentaba tumor paratiroideo, el 35,2% fue clasificado de alto riesgo. El 15,5% tuvo una mala respuesta a la prednisolona (Tabla 2).
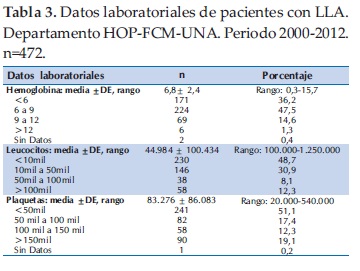
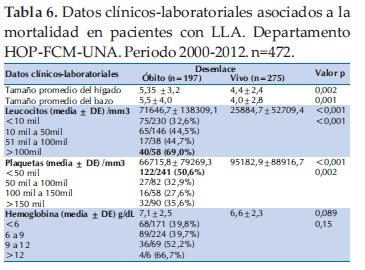
En relación a los datos laboratoriales, el valor promedio de la hemoglobina fue de 6,8±2,4, de los leucocitos 44.984 ± 100.434 y de las plaquetas 83.276 ± 86.083 (Tabla 3).
En la Figura 2, podemos observar la evolución de la remisión completa continua alcanzada, que muestra una mejoría significativa a lo largo de los 13 años, de 28,6% en el año 2000 a 85,1% en el 2012.
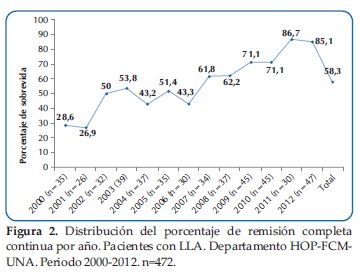
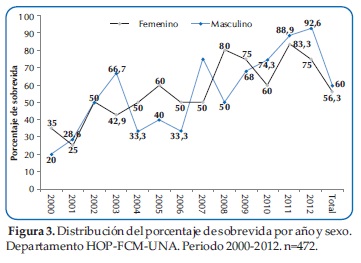
No se observó diferencia significativa en el porcentaje de sobrevida entre ambos sexos a lo largo de los 13 años (Figura 3).
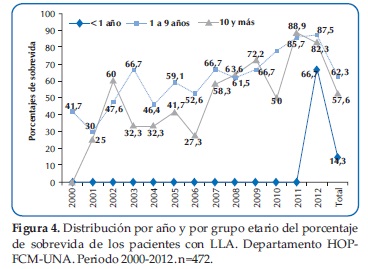
En general la sobrevida fue mayor en los pacientes entre 1 a 9 años. Hasta el año 2012 ningún paciente menor de un año de edad sobrevivió (Figura 4).
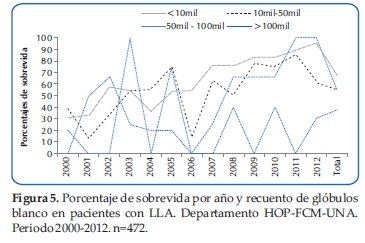
El porcentaje de sobrevida fue mayor en los pacientes con recuento leucocitario menores de 10.000 (Figura 5).
Las características socio-demográficas que se asociaron significativamente a la sobrevida fueron la edad entre 1 a 9 años (p=0,005) y el mejor nivel educativo de los padres (p=0,01). El sexo y el ingreso familiar no se relacionaron con la sobrevida (Tabla 4).
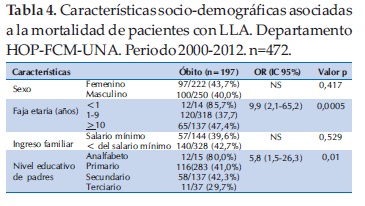
Entre las características clínicas asociadas a la mortalidad se observó que los pacientes con LLA que en el momento del diagnóstico presentaban manifestaciones hemorrágicas tuvieron una mortalidad de 58,2% en comparación con el 36,7% de los que no presentaban manifestaciones hemorrágicas. En forma similar, los pacientes con bajo peso al diagnóstico tuvieron una mortalidad significativamente mayor (p<0,001) que los eutróficos (63,1% en comparación a 38,3%). Otros factores asociados a la mortalidad fueron presencia de infección grave (62,8% vs 39,6%), clasificado con alto riesgo (57,5% vs 33,3%), presencia de masa mediastínica (59,6% vs 40,1%) y mala respuesta a la prednisona (65,8% vs 37,2%) (Tabla 5).
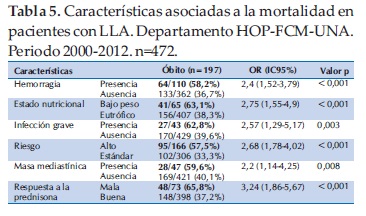
Los datos laboratoriales que se relacionaron con mejor sobrevida fueron recuento de leucocitos por debajo de 10 mil/mm3 y el recuento de plaquetas por encima de 100 mil/mm3. Con respecto al tamaño del hígado y del bazo, los que sobrevivieron tuvieron significativamente menor tamaño de ambos órganos que los que fallecieron (Tabla 6).
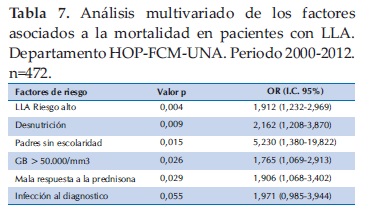
En el análisis multivariado los factores que se asociaron en forma independiente a la mortalidad fueron alto riesgo, desnutrición, padres sin escolaridad, recuento de leucocitos por encima de 50000/mm3 y mala respuesta a la prednisona. La edad, el sexo y el ingreso familiar no fueron asociados en forma significativa (Tabla 7).
DISCUSIÓN
Los resultados de 13 años de estudio de la leucemia linfoblastica aguda en el Departamento de Hemato-oncologia Pediátrica de la Universidad Nacional de Asunción nos permitió conocer la distribución de los casos por año, las características socio-demográficas, clínicas y laboratoriales de los pacientes e identificar los factores de riesgo de mortalidad. Si bien muchas de las características no difieren de las encontradas por otros autores, realizamos ciertas consideraciones teniendo en cuenta la situación social y económica de un país en desarrollo como el Paraguay.
La evaluación de las variables socio-demográficas de los pacientes con diagnóstico de LLA demostró que la edad media en este estudio fue de 6,1 ± 4,3 años con un rango entre 0 a 17 años, 29% de los pacientes se encontraban por encima de los 10 años de edad en el momento del diagnóstico. El motivo de consulta más frecuente en los pacientes con diagnóstico de LLA fue la anemia, seguido por fiebre prolongada, las manifestaciones hemorrágicas se reportaron en un 23,3% de los pacientes.
Con relación al sexo, se observó en este estudio un leve predominio del sexo masculino y no hubo diferencia significativa en la sobrevida entre ambos sexos a lo largo de los 13 años estudiados. La literatura ha demostrado que tanto la supervivencia global como la sobrevida libre de enfermedad se encuentran con tendencias al incremento en ambos sexos, aunque al parecer es mayor en el sexo femenino. Esta diferencia se debe al riesgo de infiltración testicular en varones que les confiere un peor pronóstico.
La mortalidad global fue de 41,7% (197/472) con una reducción altamente significativa de 74% en el año 2000 a 14,9% en el 2012. La mejora de la sobrevivencia coincide con la mejora de la capacidad del servicio de Hematología y Oncología Pediátrica durante el periodo de estudio (10).
Existe diferencia en la sobrevida alcanzada en pacientes pediátricos con LLA entre países industrializados y vías de desarrollo (11,12). La sobrevida reportada en los países en desarrollo es de alrededor del 40%, tasas aún más bajas, se reporta en países como Honduras, como de 29% (11-13). Dos décadas después, la supervivencia reportada por grupos multicéntricos de países desarrollados, como el Pediatric Oncology Group y el BFM (Berlin-Frankfurt-Münster) (14), entre otros, incrementó hasta alrededor de 80%. Esto se atribuyó al uso de esquemas más intensivos de quimioterapia, a la aparición de nuevos medicamentos y al mejor tratamiento de apoyo, como la prevención y tratamiento eficaz de las infecciones, así como el apoyo transfusional.
En nuestro estudio, la evaluación del estado nutricional demostró que 13,6% de los pacientes con el diagnóstico de LLA presentaron algún grado de desnutrición durante la evaluación inicial, siendo la mortalidad en este grupo del 63,1% en comparación al 38,3% de los eutróficos. En países como India, se reporta una alta frecuencia de efectos tóxicos de la quimioterapia, en cierta medida, asociada con la desnutrición, que también se ha identificado como factor pronóstico en México y otros países (15,16).
En nuestro estudio hemos encontrado que los pacientes de padres con baja educación han tenido un mayor riesgo de mortalidad. Este hallazgo ya ha sido reportado por otros estudios, así, en los Estados Unidos se han realizado análisis por etnias encontrándose que la tasa de supervivencia en pacientes hispanos tratados en ese país es inferior a la de los pacientes caucásicos. Existen reportes similares para la población afroamericana. Esto sugiere que los factores socioeconómicos pueden estar implicados, aunque también los factores genéticos deben de considerarse (17).
La estratificación de los pacientes en bajo o alto riesgo, inicialmente se hacía en base a la edad, sexo y contaje leucocitario. Posteriormente, la inmunohistoquímica, biología molecular y la citogenética marcó un gran avance para definir el pronóstico. De esta forma, la clasificación de los pacientes de acuerdo con sus características ha permitido brindar terapias dirigidas, acordes con el pronóstico de cada paciente, para mejorar su efectividad y disminuir la toxicidad (18).
En términos generales, estos criterios integran varios datos, tanto aspectos clínicos que presentan los pacientes al momento de la primera evaluación como características de las células leucémicas. En los primeros destaca la edad de presentación: los niños mayores de 10 años o menores de 1 año se clasifican como de alto riesgo. En nuestro estudio se demostró una sobrevida mayor en los pacientes menores de 10 años en concordancia con la literatura internacional que demuestran que los pacientes entre 1-9 años continúan con mejor pronóstico que los menores de un año y mayores de 10 años. Por otro lado, en los pacientes mayores de 10 años, aun cuando la supervivencia también ha mejorado es inferior a la del grupo de 1-9 años y con grandes variaciones entre los países.
Otro punto, que no es constante, es la carga de la enfermedad. Algunos grupos consideran que al identificar infiltraciones importantes, a órganos como hígado, bazo, sistema nervioso central, o a nivel testicular, se presenta mayor riesgo. En nuestro estudio no encontramos diferencias significativas entre casos y controles.
La respuesta al tratamiento es un valor pronóstico relevante en la mayoría de los estudios en la literatura. Encontramos que aquellos pacientes con mala respuesta a la prednisona tienen un mayor riego de óbito.
En nuestra serie, la mortalidad, teniendo en cuenta la estratificación en riesgo Alto y Bajo, fue de 57,5% en el grupo con alto riesgo y 33,3% en el grupo con riesgo estándar. En la literatura internacional, pacientes catalogados como de bajo riesgo logran una supervivencia por encima de 90% y los de grupos de alto riesgo, sobre todo los de muy alto riesgo (particularmente el grupo de adolescentes), aún continúan con tasas de supervivencia bajas —alrededor de 60%—, razón por la cual los estudios actuales se enfocan en mejorar los tratamientos para este grupo de pacientes (19).
Desde el punto de vista clínico y de pronóstico desfavorable se mencionan la presencia de visceromegalia. En relación al tamaño promedio del hígado en este estudio, se encontró un valor promedio significativamente mayor en los que fallecieron que los que sobrevivieron (5,35±3,2 vs 4,4±2,4). Un hecho similar fue observado en relación el tamaño promedio del bazo (5,5±4,0 vs ± 4,0±2,8).
El recuento de leucocitos al diagnóstico es uno de los factores de pronóstico cardinal. Tanto el grupo cooperativo Children´s Cancer Group (CCG) como el Pediatric Oncology Group (POG) concuerdan que un recuento de leucocitos totales en sangre periférica al diagnóstico por debajo de 50,000/µL constituye un factor de pronóstico favorable. En nuestro estudio el recuento de leucocitos por debajo de 10 mil se relacionó con una mejor sobrevida.
La anemia fue severa en el 36,2% de los pacientes con cifras de hemoglobina por debajo de 6 g/dL. Aunque en el pasado se consideraba que la hemoglobina por debajo de 7 g/dL tenía un factor pronóstico desfavorable, actualmente se la considera que carece de valor.
En cuanto al recuento de plaquetas, la mitad de los pacientes presentaba trombocitopenia severa, con menos de 50.000 plaquetas/mm3. Los recuentos de plaquetas por debajo de 30,000/mm3 se han considerado como una situación desfavorable y condiciona un factor predisponente en la infiltración al sistema nervioso central. En nuestro estudio el recuento de plaquetas por encima de 100.000/mm3 se asoció con una mejor sobrevida.
En este estudio analizamos los factores sociales, económicos y culturales del niño y su familia que podrían asociarse con retraso en el diagnóstico y tratamiento. Las familias reportadas en este estudio son numerosas, con más de cinco miembros viviendo en el hogar, sin ingreso fijo y en el 60% de los casos con el nivel educativo de los padres que llega solo a nivel primario. El diagnóstico en más 50% de los casos se retrasa en más de un mes. Dentro de las variables socioeconómicas y culturales se observó en este trabajo que los pacientes cuyos padres tenían menor nivel educativo presentaban significativamente mayor riego de óbito. Se han reportado en otros estudios algunas de las variables socioeconómicas analizadas en este trabajo, asociadas con la mortalidad por LLA. Por ejemplo, en el estudio realizado en Indonesia se observó menor supervivencia libre de evento en pacientes con LLA de hogares pobres y con bajo nivel educativo de los padres (20).
Podemos observar que a lo largo de estos años una mejoría en la Remisión completa continua (RCC) alcanzada. El porcentaje de sobrevida aumentó de 28,5% en el año 2000 a 85,1% en el 2012.
CONCLUSIÓN
Se observó en este trabajo que los pacientes con algún grado de desnutrición, presencia de manifestaciones hemorragíparas, y categorizados como riesgo alto por mala respuesta a la prednisiona en el día 8 tuvieron un mayor riesgo de óbito. En relación a los hallazgos de laboratorio, encontramos que aquellos pacientes con hiperleucocitosis y con plaquetopenia tienen un mayor riego de óbito. Así como pacientes que provienen de hogares con padres que tienen bajo nivel educativo. Hacemos énfasis en las herramientas diagnósticas, como el inmunofenotipo, el análisis citogenético y la biología molecular, que contribuirán a estratificar mejor el grupo riesgo en LLA y que no fueron analizados en este trabajo.
REFERENCIAS
1. Rivera G, Pinkel D, Simone J, HancockM, Crist W. Treatment of acute lymphoblastic leukemia, 30 years experience at St Jude Children´s Research Hospital. New Eng J Med. 1986;315:657-663. [ Links ]
2. Mirro J. How common is childhood cancer. Childhood Cancer. 2000;11:17-20. [ Links ]
3. Parkin DM, Stiller CA, Draper GJ. The international incidence of childhood cancer. Int J Cancer. 1998;42:511-20. [ Links ]
4. Villasís Keever MA, Arias Gómez J, Escamilla Núñez A, Bonilla Rojas J. Metaanálisis sobre los factores pronóstico relacionados con la mortalidad en niños con leucemia linfoblástica aguda. Bol Med Hosp Infant Mex. 2012;69(3):175-89. [ Links ]
5. Pui CH, Relling MV, Downing JR. Acute lymphoblastic leukemia. N Engl J Med. 2004;350:1535-1548. [ Links ]
6. Pui CH, Sandlund JT, Pei D, Campana D, Rivera GK, Ribeiro RC, Rubnitz JE, Razzouk BI, Howard SC, Hudson MM, Cheng C, Kun LE, Raimondi SC, Behm FG, Downing JR, Relling MV, Evans WE; Total Therapy Study XIIIB at St Jude Children's Research Hospital. Improved outcome for children with acute lymphoblastic leukemia: results of total therapy study XIIIB at St Jude Children´s Research Hospital. Blood. 2004;104:2690-6. [ Links ]
7. Pui CH, Carroll WL, Meshinchi S, Arceci RJ. Biology, risk stratification, and therapy of pediatric acute leukemias: an update. J Clin Oncol. 2011;29:551-565. [ Links ]
8. Margolin JF, Rabin KR, Steuber CP, Poplack DG. Acute lymphoblastic leukemia. En: Pizzo PA, Poplack DG, eds. Principles and practice of pediatric oncology. Philadelphia: Lippincot Williams & Williams; 2011. p. 518-565. [ Links ]
9. Pui CH, Evans WE. Treatment of acute lymphoblastic leukemia. N Engl J Med. 2006;354:166-78. [ Links ]
10.Samudio A, Figueredo D, Lassaletta A, Zelada O, Peris A, Bogado Yinde L, Relyea G, Pérez A, Madero L, Ribeiro R, Masera G, Caniza MA. Building a National Pediatric Cancer Center and Network in Paraguay: Lessons for Addressing Challenges in a Low-income Country. J Pediatr Hematol Oncol. 2015 Jul;37(5):383-90. [ Links ]
11. Valsecchi MG, Tognoni G, Bonilla M, Moreno N, Baez F, Pacheco C, Hernandez AP, Antillon-Klussmann F, Machin S, Cabanas R, Navarrete M. Clinical epidemiology of childhood cancer in Central America and Caribbean countries. Ann Oncol. 2004;15:680-85. [ Links ]
12. Bonilla M, Moreno N, Marina N, deReyes G, Shurtleff SA, Downing JR, Behm FG, Harrison PL, Ribeiro RC, Peña O, Crist WM, Antillon FG. Acute lymphoblastic leukemia in a developing country: preliminary results of a nonrandomized clinical trial in El Salvador. J Pediatr Hematol Oncol. 2000;22:495-501. [ Links ]
13. Laosombat V, Wongchanchailert M, Sattayasevana B, Wiriyasateinkul A, Watana-Arepornchai S. The treatment of children with acute lymphoblastic leukemia in Thailand. Med Pediatr Oncol. 2002;38:266-68. [ Links ]
14. Möricke A, Zimmermann M, Reiter A, Henze G, Schrauder A, Gadner H, Ludwig WD, Ritter J, Harbott J, Mann G, Klingebiel T, Zintl F, Niemeyer C, Kremens B, Niggli F, Niethammer D, Welte K, Stanulla M, Odenwald E, Riehm H, Schrappe M. Long-term results of five consecutive trials in childhood acute lymphoblastic leukemia performed by the ALL-BFM study group from 1981 to 2000. Leukemia. 2010;24:265-84. [ Links ]
15. Lobato-Mendizábal E, López-Martínez B, Ruiz-Argüelles GJ. A critical review of the prognostic value of the nutritional status at diagnosis in the outcome of therapy of children with acute lymphoblastic leukemia. Rev Invest Clin. 2003;55:31-35. [ Links ]
16. Rogers PC. Importance of nutrition in pediatric oncology. Indian J Cancer [serial online] 2015 [cited 2016 Apr 1];52:176-8. Available from: http://www.indianjcancer.com/text.asp?2015/52/2/176/175830. [ Links ]
17. Gurney JG, Severson RK, Davis S, Robison LL. Incidence of cancer in children in the United States. Sex-, race-, and 1-year age-specific rates by histologic type. Cancer. 1995;75:2186-95. [ Links ]
18. Gaynon PS, Angiolillo AL, Carroll WL, Nachman JB, Trigg ME, Sather HN, Hunger SP, Devidas M; Children's Oncology Group. Long-term results of the children's cancer group studies for childhood acute lymphoblastic leukemia 1983-2002: a Children's Oncology Group Report. Leukemia. 2010 Feb;24(2):285-97. [ Links ]
19. Salzer WL, Devidas M, Carroll WL, Winick N, Pullen J, Hunger SP, Camitta BA. Long-term results of the pediatric oncology group studies for childhood acute lymphoblastic leukemia 1984-2001: a report from the children´s oncology group. Leukemia. 2010;24:355-70. [ Links ]
20. Mostert S, Sitaresmi MN, Gundy CM, Sutaryo, Veerman AJP. Influence of socioeconomic status on childhood acute lymphoblastic leukemia treatment in Indonesia. Pediatrics. 2006;118;e1600-e1606. [ Links ]














